基于NLRP3 信号通路探讨清开灵对肝纤维化大鼠的影响及作用机制
王珊珊,白俊杰,于 雪,范盎然,杜庆红*,李卫红
1.北京中医药大学,北京 100029;2.西藏藏医药大学,西藏 拉萨 850000;3.北京京煤集团总医院,北京 102300
肝纤维化是各种因素引起肝脏损伤后的一种修复反应,是各种慢性肝病经历的一种共同病理过程,主要表现为细胞外基质(extracellular matrix, ECM)的大量积累[1]。 肝纤维化继续进展可形成肝硬化甚至是肝癌,严重影响患者的生存质量,肝纤维化导致的肝硬化已成为全球第11 位的致死原因[2]。 随着全球慢性肝脏疾病(如病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病、自身免疫性肝病、胆汁淤积性肝病等)的发病率不断升高,肝纤维化的发病率也居高不下[3]。 肝纤维化发病机制主要涉及炎症、氧化应激、线粒体功能障碍、铁超载、多细胞因子相互作用等[4],其中慢性炎症既是肝纤维化的重要特征,也是维持肝纤维化不断进展的重要因素[5]。 研究表明,NLRP3炎症小体的激活在炎症中起到重要作用,可直接影响肝纤维化进程[6-7]。 因此,通过抑制NLRP3 炎症小体通路激活可能会减轻肝组织损伤,起到减缓甚至逆转肝纤维化的作用。
清开灵口服液是由胆酸、珍珠母、猪去氧胆酸、栀子、水牛角、板蓝根、黄芩苷、金银花等多种中药成分组成的复方制剂,目前临床多用于治疗上呼吸道感染、肺炎、病毒性脑炎、发热等疾病[8],其在肝纤维化中的报道很少。 基于炎症在肝纤维化发病及进展中的重要作用以及清开灵口服液良好的抗炎功效,本实验观察清开灵口服液对CCl4大鼠肝纤维化程度的影响,并基于NLRP3 炎症小体通路探索其抗肝纤维化的机制。
1 材料
1.1 实验动物
健康雄性SD 大鼠44 只,体质量(200±20) g,购自北京斯贝福生物有限公司[动物生产许可证号:SCXK(京)2019-0010]。饲养于北京中医药大学实验动物中心,许可证号SYXK(京)2020-0033,本实验经北京中医药大学动物伦理委员会审查通过,审查号为BUCM-4-2020122005-4180。
1.2 药物与试剂
清开灵口服液(广州白云山明兴制药有限公司,批号591109);CCl4分析纯(福晨化学试剂有限公司,批号20200902);橄榄油分析纯(上海麦克林生化科技有限公司,批号0815210-500 mL);羟脯氨酸(hydroxyproline,HYP)、谷胱甘肽过氧化物酶(glutathione peroxidation, GSH-Px)检测试剂盒(南京建成生物工程研究所,批号分别为20200922、20200923);肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)ELISA 试 剂盒(美国Thermo Fisher 公司, 批号分别为715101420、728101520);NOD 样受体热蛋白结构域3(NOD-like receptor protein domain 3)一抗(美国NOVUS 公司,批号NBP2-12446);GAPDH 一抗(武汉三鹰公司,批号60004-1-Ig);衔接蛋白凋亡相关斑点样蛋白(adaptor protein apoptosis-related dot-like protein,ASC)一抗、Caspase-1一抗(美国Santa Cruz 公司,批号分别为SC-514414、SC-56036);免疫组化检测肝组织α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)一抗(美国CST 公司,批号19245s);HRP 山羊抗兔二抗、HRP 山羊抗小鼠二抗(武汉赛维尔生物科技有限公司,批号分别为GB23303、GB23301);脱脂奶粉(美国BD 公司,批号8141815);ECL 超敏发光液(美国Cytiva 公司,批号17365298);Steady Pure通用型RNA 提取试剂盒、Evo M-MLV 反转录试剂预混液、SYBR Green Pro Taq HS 预混型qPCR 试剂盒(湖南艾克瑞生物工程有限公司,批号分别为A2A0929、A2A1386、A3A0272)。
1.3 仪器
AH480 型全自动生化分析仪(美国BECKMAN COULTER 公司);Epoch 型全波长酶标仪(美国Bio Tek公司);5810R 型高速冷冻离心机(德国Eppendorf公司);ME204E 型电子分析天平(美国METTLER TOLEDO 公司);CFX-96 型荧光定量PCR 仪(美国Bio-Rad 公司);Aperio VERSA 型超分辨显微组织成像系统(美国Leica 公司);JJ-12J 型脱水机(武汉俊杰电子有限公司);RM2016 型病理切片机(上海徕卡仪器有限公司);KD-P 型组织摊片机(浙江省金华市科迪仪器设备有限公司);MX-F 型涡旋混合器(武汉赛维尔生物科技有限公司);c600 型Azure Imager 多功能分子成像系统(美国Azure 公司)。
2 方法
2.1 分组、造模及给药
适应性喂养3 d 后,将44 只大鼠随机分成空白组(8 只)、模型组(20 只)、清开灵口服液组(QKL组,16 只),设置4 周与8 周两个时间点。采用CCl4灌胃法制作大鼠中毒性肝纤维化模型(CCl4与橄榄油1∶1 融合,配成50% CCl4混合溶液)。 除空白组外,模型组与各治疗组首次造模剂量为4 mL·kg-1,后以2 mL·kg-1造模,每周2 次[9]。 造模后第2 周采用清开灵口服液灌胃治疗,给药剂量为5 mL·kg-1·d-1(按照体表面积进行换算:给药剂量为成人量的6倍),空白组和模型组给予等体积生理盐水。 实验期间所有大鼠正常饮食与饮水,每周测量大鼠体质量一次以及时校对灌胃剂量。造模过程中模型组死亡4 只,4 周或8 周后取材。 腹主动脉采血分离血清,用于后续指标检测。
2.2 指标检测及方法
2.2.1 肝脾指数测定 摘取肝、脾,经PBS 冲洗后用滤纸吸干水分并及时测量湿重,计算肝脾指数。脏器指数=脏器湿重(g)/大鼠体质量(g)×100%。
2.2.2 肝功能测定 用全自动生化分析仪检测血清AST、ALT、T-BIL 含量。
2.2.3 炎症因子检测 ELISA 法检测肝组织中TNF-α、IL-1β 的含量以反映炎症情况。
2.2.4 HE 和Masson 染色 每只大鼠取大小约1 cm×1 cm×0.6 cm 的肝右叶放入4%多聚甲醛中固定,后续行常规HE 染色观察肝组织形态结构变化;Masson 染色观察胶原纤维增生情况,并通过Image J 软件半定量分析各组肝脏中胶原容积分数(collagen volume fraction, CVF)。
2.2.5 免疫组化检测α-SMA 的表达 将组织切片进行抗原修复,5%山羊血清封闭,滴加α-SMA 的一抗(1∶600),4 ℃孵育过夜,滴加二抗(1∶200),孵育50 min,然后滴加DAB 显色液、复染、分化、返蓝、脱水、封片。通过Aperio VERSA 仪器进行组织切片扫描及图像采集分析。
2.2.6 HYP 含量测定及GSH-Px 活力检测 取30 mg肝组织,按1∶9 比例加入0.27 mL 生理盐水,制备10%组织匀浆,并稀释为最佳浓度,测定HYP 含量及GSH-Px 的活力。 检测步骤与方法严格遵照相应试剂盒说明书进行。
2.2.7 Western blot 法检测NLRP3、ASC、Caspase-1、α-SMA 蛋白的表达 肝组织匀浆,离心取上清。电泳、电转、封闭后,各指标加上相应的一抗,NLRP3(1∶600)、ASC(1∶500)、Caspase-1(1∶500)、α-SMA(1∶1 000),4 ℃一抗孵育过夜,加二抗、超敏发光液(electrochemiluminescence, ECL),采用Azure Imager 仪器进行曝光,得到相应条带,结果用Image J 软件进行分析。
2.2.8 RT-PCR 检测NLRP3、ASC、Caspase-1、α-SMA mRNA 表达 用总PCR 提取试剂盒从肝组织中提取总RNA,反转录为cDNA,反转录条件:37 ℃15 min,85 ℃5 s,4 ℃∞。 然后扩增,扩增条件95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环。GAPDH 作为内参,并绘制扩增曲线与熔解曲线,用Bio Rad CFX Manager 软件进行数据分析,结果以2-△△ct表示。 引物序列详见表1。

表1 基因引物表
2.3 统计学方法
3 结果
3.1 清开灵口服液对大鼠肝组织形态结构的影响
空白组肝组织以中央静脉为中心,肝索呈放射状排列(图1A)。 4 周模型组肝细胞发生脂肪变性及坏死,在中央静脉周围和坏死区域有少量炎症细胞浸润(图1B);随着肝损伤加重,8 周模型组肝细胞脂肪变性和坏死更广泛,炎症细胞浸润更明显,肝结构破坏(图1D)。与4 周、8 周模型组相比,QKL 组显著改善肝细胞形态、减轻炎症细胞浸润及胶原纤维增生(图1C、1E)。
3.2 清开灵口服液对大鼠肝组织胶原纤维增生的影响
空白组肝组织仅在中央静脉和门管区周围见少量胶原纤维(图2A)。 4 周模型组在中央静脉、门管区及肝小叶周围均有大量胶原纤维生成(图2B);8周模型组胶原纤维增生更明显,并将坏死区域相互连接或中央静脉-中央静脉连接或中央静脉-汇管区连接,形成桥接样纤维化(图2D)。 与4 周、8 周模型组比较,QKL 组的胶原增生显著减轻(图2C、2E)。 与空白组比较,4 周、8 周模型组CVF 均显著增加(P<0.01);与8 周模型组相比,4 周模型组CVF 增加明显(P<0.01);相比4 周、8 周模型组,同时期QKL 组CVF均明显下降(P<0.01)。 详见表2。
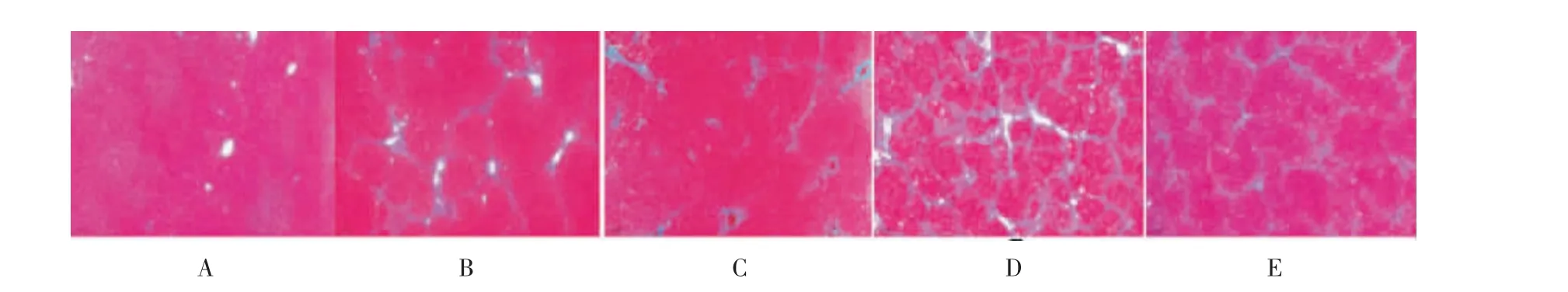
图2 清开灵口服液对肝组织胶原纤维增生的影响(Masson,×50)
表2 清开灵口服液对大鼠肝组织CVF分析结果(±s,n=6,%)
注:与空白组相比,##P<0.01;与4 周模型组相比,**P<0.01;与8周模型组相比,&&P<0.01。
组别空白组模型组QKL 组4 周8 周2.178±0.286 22.976±1.845##13.302±1.445**2.178±0.286 46.512±2.649##**24.600±2.092&&
3.3 清开灵口服液对大鼠肝组织HYP 含量的影响
与空白组相比,4 周与8 周模型组HYP 含量均明显升高(P<0.01),并且8 周模型组肝脏HYP 含量显著高于4 周(P<0.01),与Masson 染色结果一致。与4 周、8 周模型组相比,同时期QKL 组肝组织HYP 含量明显下降(P<0.01)。 详见表3。
表3 清开灵口服液对肝组织HYP 含量的影响(±s,n=6,μg/g)

表3 清开灵口服液对肝组织HYP 含量的影响(±s,n=6,μg/g)
注:与空白组相比,##P<0.01;与4 周模型组相比,**P<0.01;与8周模型组相比,&&P<0.01。
组别空白组模型组QKL 组4 周8 周52.45±10.88 302.66±38.55##215.79±43.12**77.73±13.02 612.06±77.59##**298.26±51.77&&
3.4 清开灵口服液对大鼠肝脏指数、脾脏指数的影响
与空白组相比,4 周、8 周模型组大鼠的肝脏指数与脾脏指数均显著升高(P<0.01);与4 周模型组相比,8 周模型组脾脏指数明显升高(P<0.01),肝脏指数有升高趋势但差异无统计学意义(P>0.05);与4 周、8 周模型组相比,同时期QKL 组大鼠的肝脏指数与脾脏指数均明显降低(P<0.05)。 详见表4。
表4 清开灵口服液对大鼠肝脾指数的影响(±s,n=6)
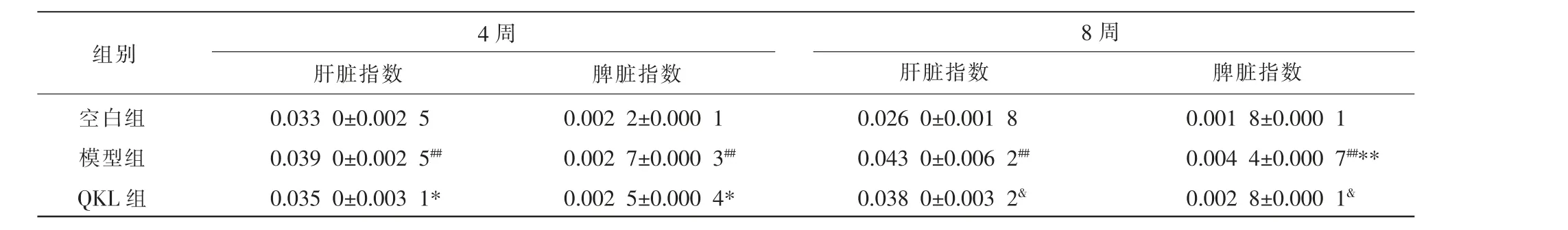
表4 清开灵口服液对大鼠肝脾指数的影响(±s,n=6)
注:与空白组相比,##P<0.01;与4 周模型组相比,*P<0.05,**P<0.01;与8 周模型组相比,&P<0.05。
组别4 周肝脏指数 脾脏指数8 周肝脏指数 脾脏指数空白组模型组QKL 组0.033 0±0.002 5 0.039 0±0.002 5##0.035 0±0.003 1*0.002 2±0.000 1 0.002 7±0.000 3##0.002 5±0.000 4*0.026 0±0.001 8 0.043 0±0.006 2##0.038 0±0.003 2&0.001 8±0.000 1 0.004 4±0.000 7##**0.002 8±0.000 1&
3.5 清开灵口服液对大鼠血清AST、ALT、T-BIL 的影响
与空白组相比,4 周模型组大鼠血清ALT、AST显著升高(P<0.01),8 周模型组大鼠ALT、AST、T-BIL均显著升高(P<0.01);与4 周模型组相比,8 周模型组ALT、AST、T-BIL 含量升高更明显(P<0.01);与4周、8 周模型组相比,同时期QKL 组ALT、AST、TBIL 含量均明显降低(P<0.01,P<0.05)。 详见表5。
表5 清开灵口服液对大鼠血清AST、ALT、T-BIL 的影响(±s,n=6)
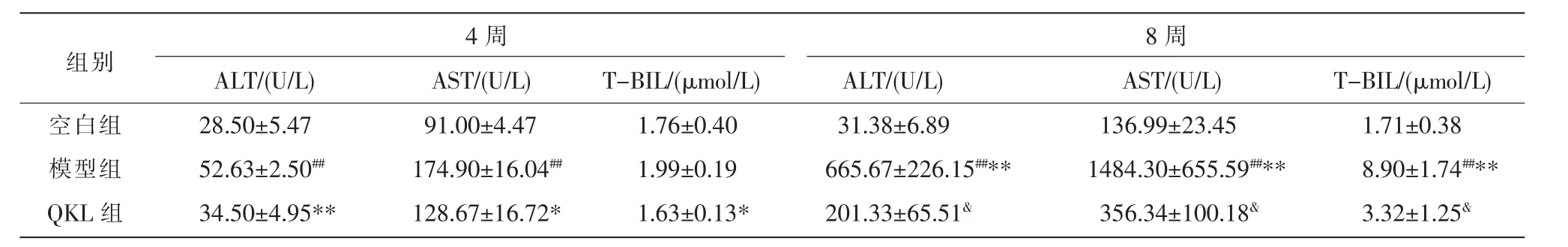
表5 清开灵口服液对大鼠血清AST、ALT、T-BIL 的影响(±s,n=6)
注:与空白组相比,#P<0.05,##P<0.01;与4 周模型组相比,*P<0.05,**P<0.01;与8 周模型组相比,&P<0.05。
组别空白组模型组QKL 组4 周ALT/(U/L) AST/(U/L) T-BIL/(μmol/L)28.50±5.47 52.63±2.50##34.50±4.95**91.00±4.47 174.90±16.04##128.67±16.72*1.76±0.40 1.99±0.19 1.63±0.13*8 周ALT/(U/L) AST/(U/L) T-BIL/(μmol/L)31.38±6.89 665.67±226.15##**201.33±65.51&136.99±23.45 1484.30±655.59##**356.34±100.18&1.71±0.38 8.90±1.74##**3.32±1.25&
3.6 清开灵口服液对大鼠肝组织GSH-Px 活力的影响
与空白组相比,4 周与8 周模型组GSH-Px 的活力均显著减弱(P<0.01);与4 周模型组相比,8 周模型组GSH-Px 的活力显著下降(P<0.01);与4 周、8 周模型组相比,同时期QKL 组肝组织GSH-Px 的活力显著增强(P<0.01,P<0.05)。 详见表6。
表6 清开灵口服液对肝组织GSH-Px 活力的影响(±s,n=6,U/mg prot)

表6 清开灵口服液对肝组织GSH-Px 活力的影响(±s,n=6,U/mg prot)
注:与空白组相比,##P<0.01;与4 周模型组相比,**P<0.01;与8周模型组相比,&&P<0.01。
组别空白组模型组QKL 组4 周8 周3 158.55±304.05 1 715.45±222.54##2 505.61±124.13**3 014.22±321.32 775.57±81.36##**1 631.33±87.15&&
3.7 清开灵口服液对大鼠肝组织炎症因子TNF-α、IL-1β 的影响
与空白组相比,4 周模型组IL-1β 含量明显升高(P<0.01),TNF-α 含量有明显升高趋势,但无统计学差异(P>0.05);8 周模型组TNF-α、IL-1β 含量均明显升高(P<0.01)。 与4 周模型组相比,8 周模型组TNF-α、IL-1β 含量明显升高(P<0.01)。与4 周、8 周模型组相比,同时期QKL 组TNF-α、IL-1β 含量均降低(P<0.01,P<0.05)。 详见表7。
表7 清开灵口服液对大鼠肝组织炎症因子TNF-α、IL-1β 的影响(±s,n=6,ng·mL-1)
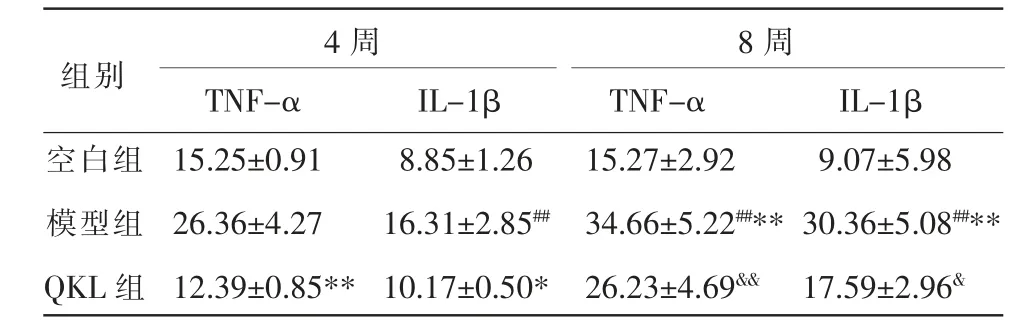
表7 清开灵口服液对大鼠肝组织炎症因子TNF-α、IL-1β 的影响(±s,n=6,ng·mL-1)
注:与空白组相比,##P<0.01;与4 周模型组相比,*P<0.05,**P<0.01;与8 周模型组相比,&P<0.05,&&P<0.01。
4 周8 周组别TNF-α IL-1β TNF-α IL-1β空白组模型组QKL 组15.25±0.91 26.36±4.27 12.39±0.85**8.85±1.26 16.31±2.85##10.17±0.50*15.27±2.92 34.66±5.22##**26.23±4.69&&9.07±5.98 30.36±5.08##**17.59±2.96&
3.8 清开灵口服液对大鼠肝组织中α-SMA 表达的影响
与空白组相比,4 周模型组α-SMA 的表达增多(图3A、3B),并且随着肝损伤加重,8 周模型组α-SMA 表达更强(图3D)。 与4 周、8 周模型组相比,QKL 组肝组织α-SMA 的表达明显减少(图3C、图3E)。

图3 清开灵口服液对肝组织中α-SMA 表达的影响(免疫组化,400)
3.9 清开灵口服液对大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA mRNA 表达的影响
与空白组相比,4 周、8 周模型组中NLRP3、ASC、Caspase-1、α-SMA mRNA 表达量均明显升高(P<0.01);与4 周模型组相比,8 周模型组NLRP3、ASC、α-SMA 的mRNA 升高明显(P<0.05,P<0.01);与4 周、8 周模型组相比,QKL 组NLRP3、ASC、Caspase-1、α-SMA 的mRNA 表达量均明显下降(P<0.05,P<0.01)。 详见表8。
表8 清开灵口服液对大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA mRNA 表达的影响(±s,n=6)

表8 清开灵口服液对大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA mRNA 表达的影响(±s,n=6)
注:与空白组相比,##P<0.01;与4 周模型组相比,*P<0.05,**P<0.01;与8 周模型组相比,&P<0.05,&&P<0.01。
组别空白组模型组QKL 组4 周NLRP3 ASC Caspase-1 α-SMA 0.92±0.15 1.87±0.38##1.33±0.36*1.01±0.14 2.14±0.23##1.51±0.39*1.02±0.23 1.88±0.52##1.06±0.35**1.08±0.39 2.64±0.57##1.57±0.35**8 周NLRP3 ASC Caspase-1 α-SMA 1.03±0.24 2.55±0.45##*1.07±0.24&&1.06±0.33 2.70±0.58##*1.22±0.28&1.01±0.15 1.95±0.30##1.12±0.45&&1.04±0.28 4.52±1.06##**2.25±0.49&&
3.10 清开灵口服液对大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA 蛋白表达的影响
与空白组相比,4 周、8 周模型组中NLRP3、ASC、Caspase-1、α-SMA 蛋白表达量均明显升高(P<0.05,P<0.01);与4 周模型组相比,8 周模型组Caspase-1 表达量明显升高(P<0.01)。与4 周模型组相比,QKL 组中ASC、α-SMA 表达量明显下降(P<0.05),NLRP3、Caspase-1 表达量有下降趋势,但差异无统计学意义(P>0.05);与8 周模型组相比,QKL 组中NLRP3、ASC、Caspase-1、α-SMA 蛋白表达量均明显下降(P<0.05)。 详见表9、图4。
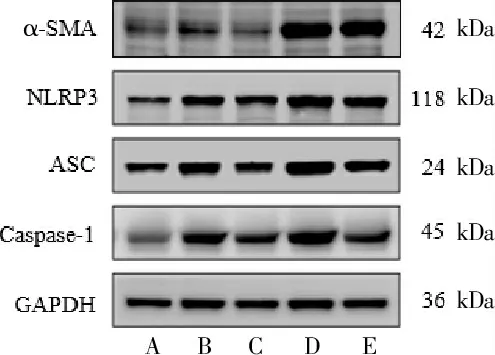
图4 清开灵口服液对CCl4 大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA 蛋白表达
表9 清开灵口服液对CCl4 大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA 蛋白表达的影响(±s,n=3)

表9 清开灵口服液对CCl4 大鼠肝组织NLRP3、ASC、Caspase-1、α-SMA 蛋白表达的影响(±s,n=3)
注:与空白组相比,#P<0.05,##P<0.01;与4 周模型组相比,*P<0.05,**P<0.01;与8 周模型组相比,&P<0.05。
4 周8 周蛋白 空白组模型组 QKL 组模型组 QKL 组NLRP3 ASC Caspase-1 α-SMA 0.71±0.11 0.54±0.10 0.56±0.09 0.34±0.12 0.97±0.08#0.85±0.09#0.86±0.12##0.61±0.14#0.81±0.02 0.58±0.07*0.71±0.13 0.37±0.09*1.09±0.07##0.96±0.18##1.16±0.10##**0.75±0.12##0.93±0.13&0.68±0.22&0.91±0.12&0.45±0.17&
4 讨论
近年来,肝纤维化基础研究领域取得了很大的进展,但是目前在全球范围内尚无针对肝纤维化的生物或化学药物,研发抗肝纤维化的药物仍然是这个领域内的热点,也是临床的迫切需求[10]。在中医学无肝纤维化病名,常以“肝著”“黄疸”“肋痛”“癥瘕积聚”等名称代指肝纤维化,目前大多数学者认为肝纤维化的基本病机多为热毒久稽、肝络受损等,临床治疗和组方原则亦大多围绕上述病机展开[11]。清开灵口服液可清热解毒,且现代药理学研究表明清开灵口服液中诸多药物成分如板蓝根、黄芩苷、栀子、金银花等均有抗炎、抗病毒的作用[12],并有研究证实该药可以抑制大量炎症细胞因子的释放,减轻对器官的大面积损伤[13],而炎症又是肝纤维化发生过程中的关键因素[14]。本实验结果显示,临床上具有明确抗炎作用的清开灵口服液显著缓解CCl4大鼠肝纤维化,并基于炎症初步揭示清开灵口服液抗肝纤维化的机制。
清开灵由吴瑭《温病条辨》中的“安宫牛黄丸”加减而来。 由于安宫牛黄丸中名贵药材较多,得之不易,同时方中的朱砂、雄黄含有重金属成分,长期使用易导致重金属蓄积中毒,因此,现代中药对安宫牛黄丸的组方进行了加减化裁,创制了中成药清开灵。 其中,牛黄、水牛角二者协同达到增强清热解毒的作用,二者与珍珠母配伍可有镇静、抗惊厥、强心退热的功效;黄芩苷与金银花配伍起到增强清热解毒的功效;黄芩苷与栀子合用则增强清热泻火解毒的作用,二者可协助牛黄清心包之热。 黄芩苷、栀子与板蓝根配伍有很强的抗菌、抗病毒、抗炎和退热的作用,众药合用达到清热解毒抗炎的目的[15]。炎症反应是急性或慢性肝病患者病程进展的一个重要影响因素,在初期炎症反应中可作为预防和保护肝脏细胞的一种有效机制[16],但损伤因子的长期刺激可导致炎症细胞[如库普弗(Kupffer)细胞]大量聚集,活化的Kupffer 细胞可分泌丰富的细胞因子(如TNF-α、IL-1β)[17],细胞因子的大量生成刺激窦周隙中的静止肝星状细胞(hepatic stellate cell, HSC)并促使HSC 活化,进而导致肝纤维化的形成。因此,本实验从清热解毒抗炎的角度观察清开灵抗肝纤维化的作用及其机制。
本研究从不同角度综合评价清开灵口服液的抗肝纤维化作用。 清开灵口服液在4 周和8 周均能明显抑制HYP 合成,这与Masson 染色结果一致,二者均直接反映清开灵口服液可减轻胶原生成,缓解CCl4大鼠肝纤维化。 本研究观察了清开灵口服液在改善肝功能、缓解肝组织结构紊乱、抗氧化等方面的作用。 结果显示,清开灵口服液在4 周和8 周能显著降低血清AST、ALT、T-BIL 的含量,这提示经清开灵治疗以后,肝细胞损伤明显减轻;肝脾指数明显下降,提示肝损伤引起的肝、脾大和炎性充血减轻;HE染色显示肝组织炎症细胞浸润、组织结构紊乱、纤维组织增生明显减轻。 活性氧产生和清除的平衡在人类健康中起着重要作用[18],ROS 的大量生成会促进肝星状细胞大量激活,促进肝纤维化发展[19],GSHPx 作为抗氧化防御系统中的酶清除剂可以保护细胞免受氧化损伤[20],清开灵口服液可显著提升GSHPx 的活力,这提示清开灵显著提高机体抗氧化能力。在炎症方面,清开灵口服液在两个时间点均能显著抑制肝组织TNF-α、IL-1β 等炎症因子合成,结合肝组织炎症细胞浸润明显减轻,这提示清开灵口服液显著减轻肝组织炎症。
近年来的基础研究表明,活化的HSC 是肝损伤时合成细胞外基质的主要细胞[21],而炎症是HSC 活化、引发并维持肝纤维化进展的重要因素。当机体受到各种炎症因子刺激时,静息状态的HSC 被大量激活并转化为具有增生、收缩、合成ECM 功能的肌成纤维细胞(myofibroblast, MF),引起肝组织结构的改变与重塑,从而导致肝纤维化[22]。 α-SMA 是HSC 活化的标志性蛋白[23],本研究发现清开灵口服液可显著降低α-SMA 表达水平,表明清开灵口服液可抑制HSC 的活化。 肝损伤引发的炎症是机体对有害因素的一种适应性反应,经常伴有大量炎症细胞的弥漫浸润,在可控范围内以维持机体的稳态环境[24],但随着损伤因子的持续刺激,促炎因子、细胞因子、趋化因子等大量释放,继续刺激机体更深一步的炎症反应, 炎症信号不断扩大形成级联反应。 目前已证实,在肝纤维化进程中有许多炎症因子参与其中[25],如TNF-α、IL-1β、IL-18 等,这些因子将募集并活化Kupffer 细胞、巨噬细胞,一方面发挥抗损伤作用,另一方面使炎症反应不断放大,促进HSC 不断活化。 炎症小体活化是引发炎症反应的重要机制。
在目前所有已知炎症小体中,NOD 样受体家族研究较为广泛,其中NLRP3 炎症小体也是研究最清楚一种炎症小体[26],它的激活对于纤维化发展必不可少[27]。 NLRP3 炎症小体由NLRP3、ASC、pro-caspase-1 3 部分构成[28],它是一种细胞内生物大分子蛋白复合物,是先天免疫的重要组成部分,在宿主防御系统和炎症信号传导过程中发挥着重要作用。 它既可存在于肝细胞,也可在Kupffer 细胞、HSC 等非实质细胞中表达。 NLRP3 炎性小体激活后,IL-18 前体和IL-1β 前体被(Caspase-1 切 割 为 成 熟 的IL-18 和IL-1β[29],促进HSC 向MFs 转化[30]。 本研究显示,4周、8 周模型组NLRP3、ASC、Caspase-1 在蛋白及基因水平均明显升高,提示NLRP3 炎症小体通路参与了肝纤维化形成,这个与Gong 等[31]的研究一致。 清开灵口服液可明显抑制IL-1β 合成,因此,推测清开灵口服液可通过抑制NLRP3 炎症小体的活化来缓解肝纤维化进程。 接下来,本次研究了清开灵口服液对NLRP3 炎症小体各成分表达的影响。结果显示,4 周及8 周清开灵口服液组NLRP3、ASC、Caspase-1 在基因及蛋白水平均明显下降,说明清开灵口服液确实能够抑制NLRP3 炎症小体活化,并且随着作用时间延长,效果越明显,这与清开灵可通过抑制NLRP3 减轻胆汁淤积性肝损伤的报道一致[32]。
综上所述,清开灵口服液显著抑制CCl4大鼠肝纤维化进程,并具有抗炎、抗氧化、保护肝功能的作用,其抗纤维化的机制与抑制HSC 活化和NLRP3炎症小体活化有关。 本研究初步阐明了清开灵口服液抗肝纤维化机制,后期课题组将继续研究其潜在的机制与靶点,为临床抗肝纤维化提供疗效确切、机制清楚的药物。

