基于IGF-1/PI3K/Akt 信号通路探讨象皮生肌膏对压力性损伤大鼠模型的影响及机制研究
郭李梦,彭 露,高子琪,刘 彬,廖若夷*
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208
压力性损伤多由于强烈或长期坐卧形成局部组织受压,出现持续的局部组织供血、供氧减少,形成压力性溃疡[1]。 现阶段临床常见的Ⅳ期压力性损伤的治疗手段为负压引流(vacuum sealing drainage,VSD),其可较有效地消除局部坏死组织,加速创面康复,但在实际临床实践时,单纯运用VSD 治疗Ⅳ期压力性损伤,不仅整个病程治疗周期较长,临床效果欠佳,而且对于行动障碍患者、老年人群、癌症人群,压力性损伤伴发的炎性反应可能造成炎性因子风暴而导致患者死亡[2-3]。 在中医学中,压力性损伤属“席疮”“压疮”范畴[4]。 清代著名外科医家顾世澄有云:“席疮为大病后久而生眠疮也,乃皮肉先死,不治。 ”《素问·病能论篇第四十六》论述:“夫痈气之息者,宜以针开除去之,夫气盛血聚者,宜石而泻之,此所谓同病异治也。”中医学对压力性损伤的病因病机及发展预后均有着较深入的见解及治疗经验[5]。 课题组前期研究表明,象皮生肌膏可明显修复压疮及慢性难愈性创面[6]。 三乙醇胺乳膏是海藻酸盐类外用药,研究显示其有助于降解受损组织中的胶原,使成纤维细胞激活,加快肉芽组织及新生毛细血管的形成,目前已广泛应用于创面修复[7],故本研究选取该药作为阳性对照药。 本研究拟进一步探究象皮生肌膏治疗压力性损伤的相关机制,为压力性损伤的中西医结合临床治疗提供参考。
1 材料与方法
1.1 实验动物
50 只SPF 级SD 大鼠,雌雄各半,由湖南中医药大学动物实验中心统一购买,动物许可证号:SCXK(湘)2019-0004,体质量180~200 g,8~10 周龄。 饲养温度22~25 ℃,饲养湿度45%~75%,动物设施许可证:SYXK(湘)2019-0009,自由摄食。 本研究符合湖南中医药大学动物伦理学要求(伦理批准号:LLBH-202105070005)。
1.2 实验药物
象皮生肌膏(由湖南中医药大学第一附属医院中成药房提供,批号:20211106,规格:100 g/瓶);三乙醇胺乳膏(法国Biafine 公司,批号:20210904,规格:46.5 g/支)。
1.3 主要试剂与仪器
磷脂酰肌醇3 激酶(phosphoinositide3-kinase,PI3K)鼠单克隆抗体(批号:60500315)、蛋白激酶B(protein kinase B,Akt)鼠单克隆抗体(批号:47020613)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)鼠单克隆抗体(批号:60110720)、类胰岛素一号生长因子(insulin-like growth factors-1, IGF-1)鼠单克隆抗体(批号:43400618)均购自美国Cell Signaling Technology 公司;PBS 缓冲液(美国Hyclone 公司,批号:80334412);苏木精核染液、伊红染色液(中国Abiowell 公司,批号:20210816、20210801);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(批号:20210413)、白细胞介素-1β(interleukin-1β, IL-1β)ELISA 试剂盒(批 号:20210526)、白细胞介素-6(interleukin-6, IL-6)ELISA 试剂盒(批号:20210702)、IGF-1 总RNA 提取试剂盒(批号:20210427)、PI3K 总RNA 提取试剂盒(批号:20210614)、Akt 总RNA 提取试剂盒(批号:20210302)、mTOR 总RNA 提取试剂盒(批号:20210524)均购自武汉博士德生物工程有限公司;无菌生物护创膜(湖南金瑞祥药业有限公司,批号:20210705)。
超净工作台(中国亚泰隆公司,型号:CJ-2NB);病理切片机(金华市益迪医疗设备有限公司,型号:YD315);电泳仪(型号:DYY-6C)、转膜仪(型号:DYCZ-40D)均购自中国北京六一生物科技有限公司;包埋机(中国武汉俊杰电子有限公司,型号:JBP5);旋转蒸发仪(中国上海一恒科学仪器有限公司,型号:RV-211M);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R)。
1.4 动物造模与分组
SD 大鼠适应性喂养3 d,麻醉后(戊巴比妥钠80 mg/kg)将大鼠侧卧位固定,使用动物专用剃毛仪暴露施压位置(选取大腿右侧股薄肌部)。 依照程红等[8]借助压力装置制备压力性损伤大鼠模型的方法进行造模,施压部位可见明显压力性红斑(约压力锤大小),同时,30 min 内按之不褪色视为压力性损伤大鼠模型建立成功。上述操作均严格无菌操作。随机选取成模后的压力性损伤大鼠模型分为模型组、阳性对照组、象皮生肌组、联合给药组,每组10 只。 另选10 只健康SPF 级SD 大鼠作为空白组,仅同部位置入磁性装置,不予施加压力。
1.5 动物给药
空白组与模型组均予生理盐水纱布外敷;象皮生肌组创面均匀涂抹厚度约1 mm 的象皮生肌膏,宽度以超过创缘2 mm 为度,使用无菌生物护创膜覆盖创面;阳性对照组创面均匀涂抹厚度约1 mm的三乙醇胺乳膏,宽度以超过创缘2 mm 为度,使用无菌生物护创膜覆盖创面;联合给药组创面按上述方法予等量三乙醇胺乳膏及象皮生肌膏混匀后涂抹外用。 均连续用药21 d。
1.6 动物取材
药物干预结束后,在大鼠眼球处取血1 mL 左右,随即将血液置于4 ℃的低温下以离心半径8.7 cm、3 000 r/min 离心15 min,取上层血清,于-20 ℃冰箱保存,备用。 后续断颈处死大鼠,取创面施压部位组织约1 g,部分立即置于-80 ℃冰箱,用于行Western blot 及RT-PCR 操作,部分以多聚甲醛固定,备用。
1.7 创面面积情况
借助小动物计量尺量取创面的长度及宽度最大值,面积(cm2)计算方法为最大长度(cm)×最大宽度(cm)。
1.8 创面组织HE 染色
4%多聚甲醛液固定创面施压部位组织,分别进行漂洗、脱水、透明和石蜡包埋、切片等步骤,HE 染色观察创面组织病理情况,光学显微镜下随机选取5 个视野进行观察并摄片。
1.9 血清TNF-α、IL-1β、IL-6 炎性因子检测
将各组大鼠血清从-20 ℃冰箱取出,再次以1 500 r/min 离心5 min(离心半径8.7 cm),去除杂质,ELISA 法检测血清TNF-α、IL-1β、IL-6 炎性因子水平,操作严格按说明书进行。
1.10 Western blot 法 检 测 创 面 组 织PI3K、Akt、mTOR、IGF-1 蛋白表达
RIPA 缓冲液提取创面组织蛋白裂解物,以离心半径8.7 cm,12 000 r/min 离心15 min,BCA 法检测蛋白浓度。SDG-PAGE 凝胶电泳,室温封闭1.5 h,洗 膜 后 加PI3K(1∶1 000)、Akt(1 ∶2 000)、mTOR(1∶1 000)、IGF-1(1∶1 000)抗体,4 ℃孵育过夜。 二抗HRP 标记的山羊抗兔IgG 抗体(1∶7 500)室温孵育1.5 h 后显影,结果运用Image Lab 软件进行分析。
1.11 RT-PCR 法检测创面组织PI3K、Akt、mTOR、IGF-1 的mRNA 表达
收集各组大鼠创面组织,Trizol 提取创面组织总RNA,紫外分光光度计测定RNA 的浓度和纯度。参照试剂盒说明书合成cDNA,SYBR Green RTPCR 试剂盒扩增PI3K、Akt、mTOR、IGF-1,重复3次,以相对定量2-ΔΔCt分析上述基因相对表达量,引物序列见表1。

表1 引物序列
1.12 统计学方法
采用SPSS 22.0 及Graphpad Prism 8.1 软件进行统计分析,每组至少重复3 次,所有计量资料均采用“±s”表示,检验各组数据的正态性和方差齐性,多组均数比较采用单因素方差分析(One-Way ANOVA),重复测量资料进行球形分布检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠创面愈合情况及创面面积比较
空白组大鼠创面在第21 天时已基本愈合。在造模第7 天、造模第14 天、造模第21 天,与空白组比较,模型组大鼠创面面积明显增大(P<0.05);与模型组比较,阳性对照组、象皮生肌组、联合给药组创面面积均减小(P<0.05);阳性对照组与象皮生肌组创面面积比较,差异无统计学意义(P>0.05);与阳性对照组及象皮生肌组比较,联合给药组创面面积缩小(P<0.05)。 详见表2、图1。

图1 压力性损伤大鼠模型创面形态学观察(造模第21 天)
表2 各组大鼠创面面积比较(±s,cm2)
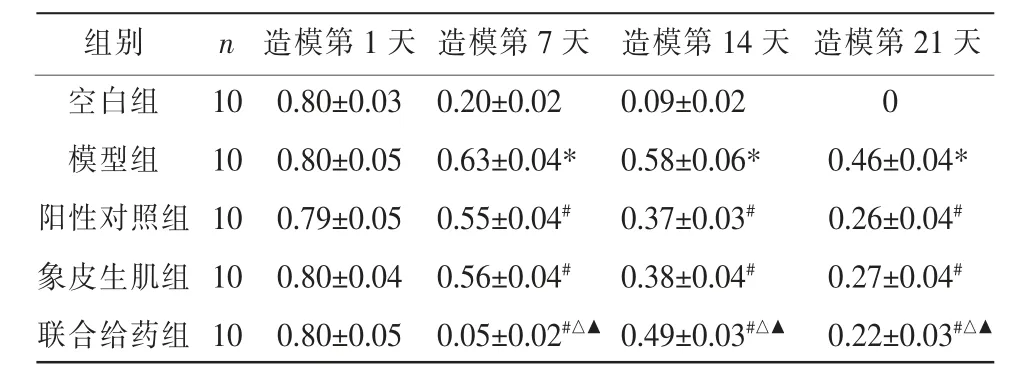
表2 各组大鼠创面面积比较(±s,cm2)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与阳性对照组比较,△P<0.05;与象皮生肌组比较,▲P<0.05。
组别空白组模型组阳性对照组象皮生肌组联合给药组造模第21 天0 0.46±0.04*0.26±0.04#0.27±0.04#0.22±0.03#△▲n 10 10 10 10 10造模第1 天0.80±0.03 0.80±0.05 0.79±0.05 0.80±0.04 0.80±0.05造模第7 天0.20±0.02 0.63±0.04*0.55±0.04#0.56±0.04#0.05±0.02#△▲造模第14 天0.09±0.02 0.58±0.06*0.37±0.03#0.38±0.04#0.49±0.03#△▲
2.2 各组大鼠模型创面组织病理学情况比较
空白组大鼠创面病理结构较完整,组织细胞排列较规则且病理致密,未见明显组织坏死碎片、水肿及炎性浸润;模型组大鼠创面病理可见明显的肌肉纤维坏死碎片,空泡变性,纤维肿大、横断;阳性对照组、象皮生肌组、联合给药组大鼠可见不同程度的病理缓解。 详见图2。
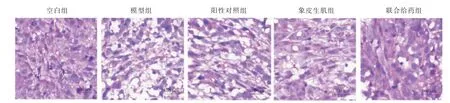
图2 各组大鼠组织病理学情况(HE,×100,标尺=100 μm)
2.3 各组大鼠血清炎性因子水平比较
与空白组比较,模型组大鼠血清炎性因子TNF-α、IL-1β、IL-6 水平明显升高(P<0.05);与模型组比较,阳性对照组、象皮生肌组、联合给药组大鼠血清炎性因子TNF-α、IL-1β、IL-6 水平显著降低(P<0.05);阳性对照组与象皮生肌组血清炎性因子TNF-α、IL-1β、IL-6 水平比较,差异无统计学意义(P>0.05);与阳性对照组及象皮生肌组比较,联合给药组血清炎性因子TNF-α、IL-1β、IL-6 水平明显降低(P<0.01)。 详见表3。
表3 各组大鼠血清炎性因子比较(±s)

表3 各组大鼠血清炎性因子比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与阳性对照组比较,△P<0.05;与象皮生肌组比较,▲P<0.05。
组别空白组模型组阳性对照组象皮生肌组联合给药组IL-6/(pg/mL)80.36±3.57 141.35±5.26*116.25±4.86#118.36±5.03#95.76±2.91#△▲n 10 10 10 10 10 TNF-α/(pg/mL)92.24±5.23 256.35±6.38*183.14±5.65#178.25±6.27#135.24±5.11#△▲IL-1β/(pg/mL)16.45±2.86 39.52±3.28*25.23±1.94#26.36±1.57#20.15±1.42#△▲
2.4 各组大鼠IGF-1/PI3K/Akt 信号通路蛋白及mRNA 表达情况
与空白组比较,模型组大鼠PI3K、Akt、mTOR、IGF-1蛋白及mRNA 表达明显升高(P<0.05);与模型组比较,阳性对照组、象皮生肌组、联合给药组大鼠PI3K、Akt、mTOR、IGF-1 蛋白及mRNA 表达显著升高(P<0.05);阳性对照组与象皮生肌组PI3K、Akt、mTOR、IGF-1 蛋白及mRNA 表达比较,差异无统计学意义(P>0.05);与阳性对照组及象皮生肌组比较,联合给药组PI3K、Akt、mTOR、IGF-1 蛋白及mRNA 表达明显升高(P<0.01)。 详见图3、表4—5。

图3 各组大鼠创面组织PI3K、Akt、mTOR、IGF-1 蛋白表达条带图
表4 各组大鼠创面组织PI3K、Akt、mTOR 及IGF-1 的蛋白表达水平比较(±s)

表4 各组大鼠创面组织PI3K、Akt、mTOR 及IGF-1 的蛋白表达水平比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与阳性对照组比较,△P<0.05;与象皮生肌组比较,▲P<0.05。
组别空白组模型组阳性对照组象皮生肌组联合给药组IGF-1 0.06±0.02 0.33±0.04*0.39±0.03#0.42±0.05#0.90±0.05#△▲n 10 10 10 10 10 PI3K 0.05±0.02 0.30±0.03*0.39±0.05#0.41±0.04#0.49±0.05#△▲Akt 0.03±0.01 0.32±0.03*0.50±0.04#0.53±0.05#0.91±0.05#△▲mTOR 0.05±0.01 0.28±0.04*0.43±0.03#0.46±0.04#0.94±0.06#△▲
表5 各组大鼠创面组织PI3K、Akt、mTOR 及IGF-1 的mRNA 表达水平比较(±s)
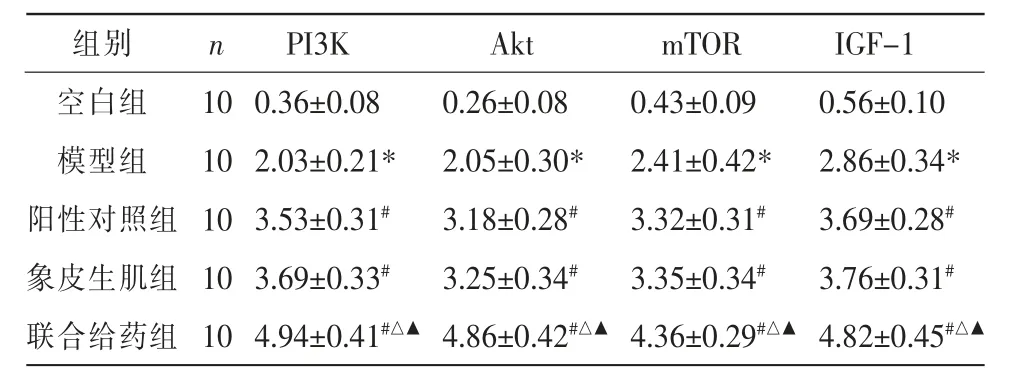
表5 各组大鼠创面组织PI3K、Akt、mTOR 及IGF-1 的mRNA 表达水平比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与阳性对照组比较,△P<0.05;与象皮生肌组比较,▲P<0.05。
组别空白组模型组阳性对照组象皮生肌组联合给药组IGF-1 0.56±0.10 2.86±0.34*3.69±0.28#3.76±0.31#4.82±0.45#△▲n 10 10 10 10 10 PI3K 0.36±0.08 2.03±0.21*3.53±0.31#3.69±0.33#4.94±0.41#△▲Akt 0.26±0.08 2.05±0.30*3.18±0.28#3.25±0.34#4.86±0.42#△▲mTOR 0.43±0.09 2.41±0.42*3.32±0.31#3.35±0.34#4.36±0.29#△▲
3 讨论
压力性损伤是中老年患者在临床上最常见的并发症之一,临床治疗中颇为棘手[9]。 有研究认为,压力性损伤的愈合与机体免疫功能密切相关[10]。 有文献综述认为,压力性损伤创面存在大量的炎性反应,同时创面愈合与机体微环境变化及免疫调节存在密切关联[11]。研究表明,TNF-α 能够抑制创面微小血管生成及结缔组织细胞增殖[12]。近年来较多研究表明,血清TNF-α、IL-1β、IL-6 水平可作为评价创面愈合程度的生物标志物[13-14]。 中医学认为本病多因机体局部受压所致,压力性损伤的病机为气虚血瘀、蕴毒形成,为本虚标实之证,多以气虚为本,蕴毒为标[15]。因此,压力性损伤的治疗原则应为扶正祛邪,标本兼治[16-18]。 本研究结果显示,象皮生肌膏可有效降低血清炎性因子水平,促进创面愈合。
创面修复的病理进程与多个基因、蛋白及细胞因子的调控密切相关,但它们的启动及传导又需要相关信号通路的激活。 IGF-1 是IGF-1/PI3K/Akt 信号通路的重要调节起始点,PI3K 及Akt 可被IGF-1激活,从而调节创面修复的各个生物学过程[19]。本研究结果显示,象皮生肌膏能够促进IGF-1/PI3K/Akt信号通路PI3K、Akt、mTOR、IGF-1 蛋白及mRNA 表达。 在健康的生理状态下,PI3K、Akt、mTOR 及IGF-1 在细胞内的表达水平很低[20],本研究结果亦表明,空白组的上述蛋白表达明显低于其他各组。 但当机体损伤时,IGF-1 水平反应性快速升高,PI3K 快速活化,当压力性损伤发生时,PI3K 被大量募集,招募PDK1、Akt、mTOR 信号蛋白互相结合,从而调控多种细胞因子及炎性抑制因子,促进创面修复[21],这属于机体创面修复的生理机制,因此,在应激状态下,压力性损伤大鼠模型中上述蛋白表达明显高于空白组。在象皮生肌膏干预后,IGF-1/PI3K/Akt 信号通路持续被激活,促进PI3K、Akt、mTOR、IGF-1 蛋白持续高水平表达,从而促进压力性损伤创面修复。
压力性损伤的修复愈合是一个多因素的续贯、交叉、动态的过程。 近期XIA 等[22]研究显示,IGF-1/PI3K/Akt 信号通路在压力性损伤的损伤与修复过程中扮演着重要角色。 本研究结果显示,与模型组比较,各药物干预组可显著升高大鼠创面受压组织的PI3K、Akt、mTOR、IGF-1 蛋白及mRNA 表达,且联合给药组升高程度最大,提示象皮生肌膏可通过调控IGF-1/PI3K/Akt 信号通路关键蛋白表达,促进创面愈合。 近期研究[23]显示,IGF-1 能够通过拮抗炎性反应,从而缓解组织损伤,同时对损伤组织局部缺氧缺血发挥保护作用,是介导压力性损伤修复的重要细胞因子。 PI3K/Akt 信号通路是IGF-1 发挥生物学作用的主要信号通路,廖小婷[24]研究显示,IGF-1/PI3K/Akt 信号通路可拮抗创面炎性因子表达水平,降低局部炎性因子水平,同时可激活下游的VEGF途径促进创面微小血管新生。 本研究结果显示,象皮生肌膏可有效降低创面炎性反应程度,能够有效改善局部组织损伤,缩短炎症反应程度,促进组织修复。
综上所述,象皮生肌膏能明显促进压力性损伤创面修复,有效降低血清炎性因子水平,可能与象皮生肌膏上调IGF-1/PI3K/Akt 信号通路相关蛋白表达,抑制炎性因子表达相关。

