半夏泻心汤含药血清对胃癌细胞外泌体诱导的腹膜间皮细胞FN1、LAMC1表达及胃癌细胞与腹膜间皮细胞黏附、侵袭的影响
丁富勇 ,刘喜平 ,陈启明 ,戴丽蓉 ,王庆苗 ,施丽娟 ,朱中博 ,何玲
1.甘肃中医药大学附属医院,甘肃 兰州 730050;2.甘肃中医药大学,甘肃 兰州 730000; 3.兰州大学第一医院,甘肃 兰州 730000
半夏泻心汤是治疗寒热错杂痞证的经典名方,出自《伤寒杂病论》,具有平调寒热、消痞散结之效。用于治疗肝癌、胃癌等消化道肿瘤及复发转移已有众多临床报道[1-3],疗效肯定。本课题组前期实验研究表明,半夏泻心汤对胃癌荷瘤裸鼠有明显抑瘤作用[4],且可抑制人胃癌细胞生长增殖[5-6]。同时研究发现,半夏泻心汤含药血清可保护胃癌上清液对腹膜间皮细胞的损伤[7],抑制人胃癌腹膜高转移潜能细胞增殖及侵袭转移[8]。本研究在前期研究基础上,分离人胃癌NCI-N87细胞外泌体,通过NCI-N87细胞外泌体诱导人腹膜间皮细胞HMrSV5,观察半夏泻心汤含药血清对胃癌细胞来源外泌体诱导的腹膜间皮细胞纤维连接蛋白1(FN1)和层粘连蛋白γ1(LAMC1)表达及胃癌细胞与腹膜间皮细胞黏附、侵袭的影响,探讨半夏泻心汤防治胃癌腹膜转移的机制。
1 实验材料
1.1 药物
半夏泻心汤(法半夏12 g,干姜9 g,黄芩9 g,黄连3 g,人参9 g,大枣4枚,炙甘草9 g),饮片由甘肃中医药大学附属医院提供,经甘肃中医药大学药学院景明教授鉴定符合2020年版《中华人民共和国药典》规定。全方药物混合并浸泡30 min,煎煮2次,第1次加8倍量水,煎煮1.5 h,第2次加6倍量水,煎煮1 h,合并煎液,过滤,滤液减压浓缩至原药材浓度为2.7、1.35、0.675 g/mL,于4 ℃冰箱保存备用。
1.2 动物与细胞
SPF级雄性SD大鼠60只,6~8周龄,体质量200~250 g,甘肃中医药大学动物实验中心提供,动物生产许可证号SCXK(甘)2020-0001,动物使用许可证号SYXK(甘)2020-0009。饲养于温度23~25 ℃、相对湿度50%±10%的SPF级实验室。本研究动物实验经甘肃中医药大学实验动物伦理委员会批准(2018-009)。
人腹膜间皮细胞HMrSV5、人胃癌NCI-N87细胞,购自上海中科院细胞库,传至第3代备用。
1.3 试剂与仪器
FN1 ELISA检测试剂盒(深圳子科生物科技有限公司,批号ZK-H1730),LAMC1 ELISA检测试剂盒(上海研尊生物科技有限公司,批号YZ-E987777),BCA蛋白定量试剂盒(上海易色医疗科技有限公司,批号BC201),外泌体提取试剂盒(美国SBI,批号EXOTC50A-1),RNA提取试剂盒(日本Takara公司,批号9767),兔来源CD63一抗(英国Abcam公司,批号ab134045),兔来源CD9一抗(英国Abcam公司,批号ab92726),兔来源钙网蛋白(calreticulin)一抗(英国Abcam公司,批号ab92516),羊抗兔IgG(英国Abcam公司,批号ab150077),DMEM培养基(美国Gibco公司,批号11995-065),胎牛血清(美国Gibco公司,批号HLC0101),基质胶(美国Corning公司,批号356234),CFSE染色剂(美国Bioscience公司,批号65-0850-84)。
7500型透射电子显微镜(日本Hitachi公司),ECLIPSE Ti型倒置荧光显微镜(日本Nikon公司),TDL-50B型低速台式离心机(上海安亭科学仪器厂),353097型8 μm Transwell小室(美国Costar公司),实时荧光定量PCR仪(美国ABI Stepone plus公司),DYCP-31DN型电泳仪(北京六一生物科技有限公司),Trans-blot转膜装置(美国Bio-Rad公司),Tanon-4200型凝胶成像系统(中国Tanon公司),Multiskan Mk3酶标仪(赛默飞世尔仪器有限公司)。
2 实验方法
2.1 含药血清制备
按照前期方法制备半夏泻心汤[9]和5-氟尿嘧啶(5-FU)[10]含药血清,将40只大鼠按随机数字表法分为正常对照组、5-FU组和半夏泻心汤低、中、高剂量组,每组8只。适应性饲养5 d后,半夏泻心汤低、中、高剂量组每日分别予相应溶液13.5、27、54 g/kg灌胃,其余各组灌胃等体积生理盐水,2 mL/次,2次/d;5-FU组按0.015 g/kg尾静脉注射5-FU注射液(0.125 g/5 mL),其余各组注射等体积空白溶剂,连续2周。末次给药后1 h,3%戊巴比妥钠1.5 mL/kg腹腔注射麻醉大鼠,腹主动脉采集全血,静置分层后3000 r/min离心10 min,收集血清,56 ℃水浴灭活30 min,经0.22 µm微孔滤膜过滤除菌,混匀分装,-20 ℃冰箱保存备用。临用时配制成10%含药血清。
2.2 NCI-N87细胞外泌体分离
用无外泌体完全培养基(含10%胎牛血清、1%青-链霉素)培养NCI-N87细胞后,4 ℃、1500 r/min离心5 min,收集细胞培养上清液,4 ℃、5000 r/min离心20 min,0.22 μm滤膜过滤去除较大囊泡,将过滤后的细胞上清液与外泌体提取试剂以5∶1比例混匀,4 ℃孵育过夜,10000 r/min低速离心30 min,弃上清液,所得沉淀用0.5 mL无菌PBS重悬,即得外泌体。取适量外泌体,采用BCA蛋白定量试剂盒进行定量后,于-80 ℃冰箱保存。
2.3 NCI-N87细胞外泌体鉴定
将外泌体以PBS稀释至合适浓度,加入Formvarcarbon载样铜网上,将铜网用2.5%戊二醛固定,移至包被碳膜的微栅网,滴加草酸双氧铀及甲基纤维素-UA液50 μL,置于透射电镜下观察外泌体形态,80 kV拍照并保存。
取外泌体和NCI-N87细胞,加入6×蛋白上样缓冲液,100 ℃加热10 min变性,以20 μg总蛋白上样,电泳、转膜、洗涤、封闭后,分别加CD9、CD63、calreticulin一抗(1∶1000),4 ℃孵育过夜,洗涤,室温孵育二抗(1∶1000)2 h,洗涤,ECL化学发光液(A液与B液等比例混合)显影,Image J软件分析CD9、CD63、calreticulin蛋白灰度值。
2.4 ELISA检测HMrSV5细胞纤维连接蛋白1和层粘连蛋白γ1含量
将对数期HMrSV5细胞用胰酶消化,完全培养基重悬细胞,调整细胞密度为浓度2×105个/mL,将细胞悬液接种于6孔板,每孔100 μL,将细胞分为正常对照组、模型组、5-FU组和半夏泻心汤低、中、高剂量组,每组3个复孔。将“2.2”项下分离的NCI-N87细胞外泌体用含相应大鼠血清的完全培养基稀释[11],正常对照组加入10%正常对照大鼠血清培养基(无外泌体)1 mL,模型组加入10%正常对照大鼠血清培养基(外泌体浓度为100 μg/mL)1 mL,5-FU组加入10%5-FU大鼠血清培养基(外泌体浓度为100 μg/mL)1 mL,半夏泻心汤低、中、高剂量组分别加入10%半夏泻心汤低、中、高剂量含药血清培养基(外泌体浓度均为100 μg/mL)1 mL,置于37 ℃、5%CO2培养箱培养。分别于24、48、72 h后终止培养,收集细胞上清液,10000 r/min离心15 min,去除细胞碎片,按照ELISA检测试剂盒说明书检测FN1和LAMC1含量。
2.5 RT-qPCR检测HMrSV5细胞纤维连接蛋白1和层粘连蛋白γ1 mRNA表达
收集“2.4”项下培养72 h的HMrSV5细胞,使用Trizol试剂提取总RNA。取5 μg RNA使用反转录试剂盒反转录获得cDNA。以cDNA为模板,采用荧光定量PCR试剂盒进行PCR。反应条件:50 ℃、2 min,95 ℃、2 min,95 ℃、15 s,60 ℃、1 min,共40个循环。以β-actin为内参,计算循环阈值(Ct),采用2-ΔΔCt法计算FN1、LAMC1 mRNA相对表达量。引物由重庆威斯腾科技公司合成,引物序列见表1。

表1 各基因PCR引物序列
2.6 NCI-N87细胞和HMrSV5细胞黏附检测
取对数期NCI-N87细胞,胰酶消化,收集细胞沉淀,PBS洗2遍,加入适量5 μmol/L CFSE染液避光孵育20 min。收集CFSE标记的胃癌细胞,用完全培养基重悬,调整细胞密度为5×104个/mL,避光备用。将NCI-N87细胞悬液100 μL加入“2.4”项下分组培养72 h的HMrSV5细胞中,同时设置空白孔(含10%正常对照大鼠血清的完全培养基)及对照孔(NCI-N87细胞悬液100 μL),置于37 ℃、5%CO2培养箱孵育1 h。弃去培养液,PBS洗3次,洗脱未结合的NCI-N87细胞,倒置荧光显微镜下观察细胞黏附情况,荧光酶标仪激发波长485 nm、发射波长530 nm读取各孔荧光强度,计算细胞黏附率。细胞黏附率(%)=(实验组荧光强度-空白孔荧光强度)÷(对照孔荧光强度-空白孔荧光强度)×100%。
2.7 NCI-N87细胞对HMrSV5细胞侵袭检测
在Transwell上室加入稀释的基质胶50 μL,将密度为5×104个/mL NCI-N87细胞悬液200 μL接种到Transwell上室,下室接种“2.4”项下培养72 h的HMrSV5细胞(密度2×105个/mL)0.5 mL,37 ℃、5%CO2培养箱孵育48 h。取出Transwell小室,弃去培养基,以无菌棉棒轻轻擦去上室残留细胞,用4%多聚甲醛固定上室底面细胞,室温放置15 min,PBS洗去固定液,结晶紫染色30 min,PBS冲洗后显微镜下观察并拍照,在100倍视野下,对膜中间和四周5个视野的染色细胞进行计数,取平均值。
3 统计学方法
采用GraphPad Prism 8.0软件对数据进行分析。计量资料以±s表示,组间比较经方差齐性检验后用方差分析并进行多重比较。P<0.05表示差异有统计学意义。
4 结果
4.1 外泌体鉴定
透射电镜观察到NCI-N87细胞外泌体有完整的双层包膜,形成椭圆或碟状的囊泡结构,内含低密度物质,粒径介于40~80 nm,见图1。

图1 NCI-N87细胞外泌体形态
CD9、CD63是外泌体标志蛋白,calreticulin是内质网内主要的钙离子结合蛋白。Western blot检测结果显示,外泌体CD9、CD63蛋白表达明显高于NCI-N87细胞,而calreticulin蛋白表达明显低于NCI-N87细胞,见图2。提示获得了NCI-N87细胞来源外泌体。

图2 NCI-N87细胞及外泌体CD9、CD63、calreticulin蛋白免疫印迹
4.2 半夏泻心汤含药血清对HMrSV5细胞纤维连接蛋白1和层粘连蛋白γ1含量的影响
与正常对照组比较,各时间点模型组HMrSV5细胞上清液FN1和LAMC1含量明显增加(P<0.01);与模型组比较,半夏泻心汤低、中、高剂量组HMrSV5细胞上清液FN1和LAMC1含量明显减少(P<0.01);与本组48 h比较,培养72 h HMrSV5细胞上清液FN1和LAMC1含量明显增加(P<0.01),见表2。因此后续实验选择含药血清培养72 h。
表2 各组HMrSV5细胞上清液FN1和LAMC1含量比较(±s,ng/mL)

表2 各组HMrSV5细胞上清液FN1和LAMC1含量比较(±s,ng/mL)
注:与正常对照组比较,##P<0.01;与模型组比较,**P<0.01;与48 h比较,△P<0.05,△△P<0.01
组别正常对照组模型组5-FU组半夏泻心汤低剂量组半夏泻心汤中剂量组半夏泻心汤高剂量组n333333 FN1 LAMC172 h 0.12±0.019.65±0.45##2.80±0.36**6.07±0.61**△△5.09±0.35**△△3.42±0.63**△△24 h 13.12±0.2220.12±0.12##10.68±0.24**13.41±0.17**△△14.41±0.33**△△13.67±0.23**△△48 h 16.34±0.1525.64±0.24##16.56±0.37**19.82±0.42**17.38±0.12**18.12±0.45**72 h 25.36±0.3248.80±0.55##30.30±0.14**39.16±0.33**△△38.46±0.63**△△32.12±0.42**△△24 h 0.05±0.025.43±0.41##0.78±0.23**2.45±0.58**△1.46±0.32**△0.87±0.43**48 h 0.07±0.236.37±0.23##1.17±0.25**3.42±0.45**2.34±0.26**1.34±0.32**
4.3 半夏泻心汤含药血清对HMrSV5细胞纤维连接蛋白1和层粘连蛋白γ1 mRNA表达的影响
与正常对照组比较,模型组HMrSV5细胞FN1和LAMC1 mRNA表达明显升高(P<0.01);与模型组比较,半夏泻心汤低、中、高剂量组HMrSV5细胞FN1和LAMC1 mRNA表达明显降低(P<0.01)。见表3。
表3 各组HMrSV5细胞FN1和LAMC1 mRNA表达比较(±s)
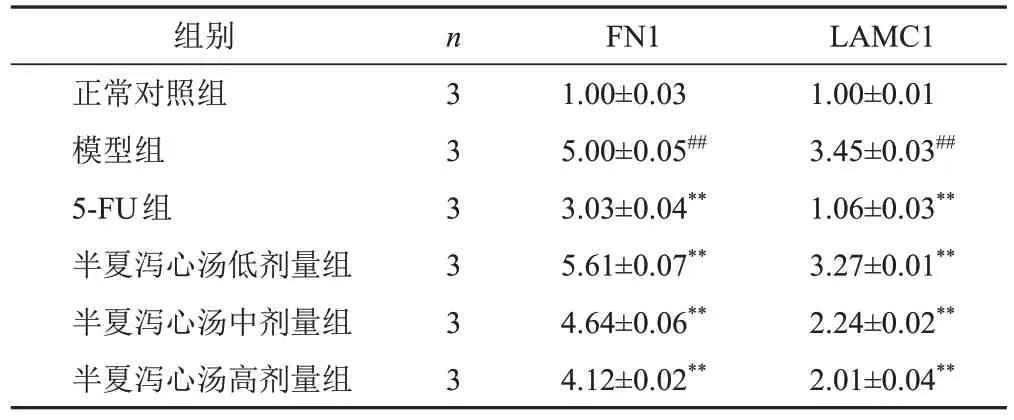
表3 各组HMrSV5细胞FN1和LAMC1 mRNA表达比较(±s)
注:与正常对照组比较,##P<0.01;与模型组比较,**P<0.01
LAMC11.00±0.013.45±0.03##1.06±0.03**3.27±0.01**2.24±0.02**2.01±0.04**组别正常对照组模型组5-FU组半夏泻心汤低剂量组半夏泻心汤中剂量组半夏泻心汤高剂量组n333333 FN11.00±0.035.00±0.05##3.03±0.04**5.61±0.07**4.64±0.06**4.12±0.02**
4.4 半夏泻心汤含药血清对NCI-N87细胞和HMrSV5细胞黏附的影响
与正常对照组比较,模型组NCI-N87细胞和HMrSV5细胞黏附率明显升高(P<0.01);与模型组比较,半夏泻心汤中、高剂量组NCI-N87细胞和HMrSV5细胞黏附率明显降低(P<0.01)。见图3、表4。
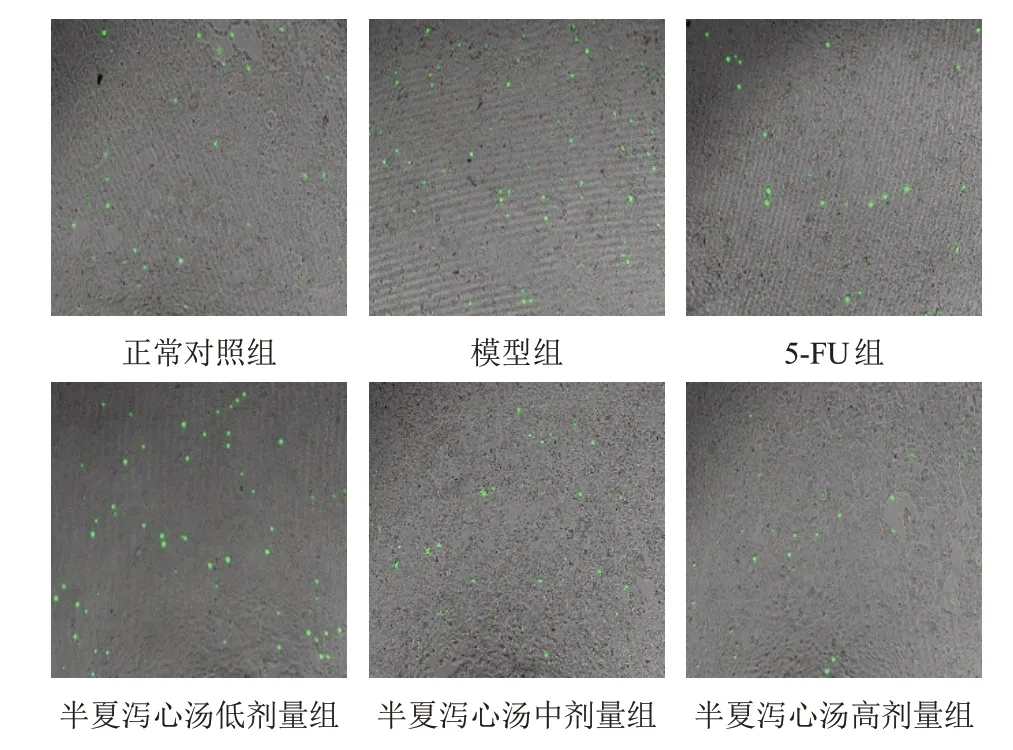
图3 各组NCI-N87、HMrSV5细胞黏附(CFSE染色,×100)
表4 各组NCI-N87、HMrSV5细胞黏附率比较(±s,%)
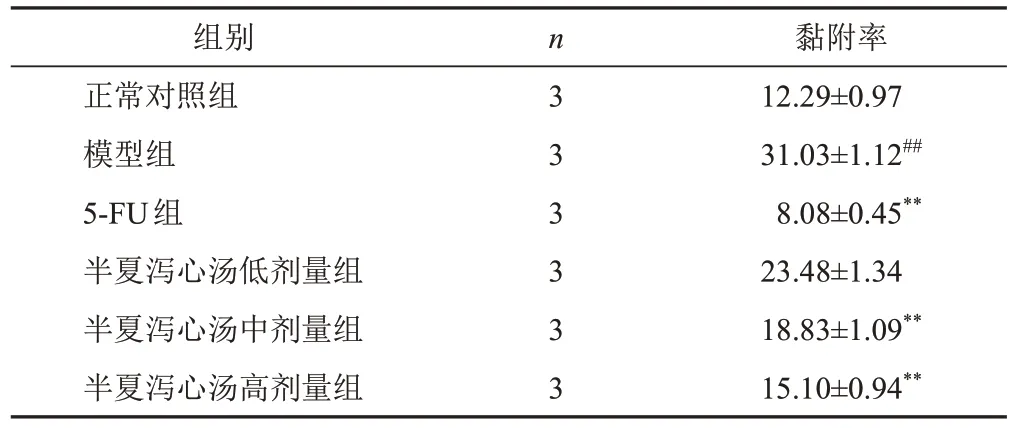
表4 各组NCI-N87、HMrSV5细胞黏附率比较(±s,%)
注:与正常对照组比较,##P<0.01;与模型组比较,**P<0.01
黏附率12.29±0.9731.03±1.12##8.08±0.45**23.48±1.3418.83±1.09**15.10±0.94**组别正常对照组模型组5-FU组半夏泻心汤低剂量组半夏泻心汤中剂量组半夏泻心汤高剂量组n333333
4.5 半夏泻心汤含药血清对NCI-N87细胞向HMrSV5细胞侵袭的影响
与正常对照组比较,模型组NCI-N87细胞向HMrSV5细胞侵袭数量明显增加(P<0.01);与模型组比较,半夏泻心汤低、中、高剂量组NCI-N87细胞向HMrSV5细胞侵袭数量明显减少(P<0.05,P<0.01)。见图4、表5。

图4 各组NCI-N87细胞向HMrSV5细胞侵袭(结晶紫染色,×100)
表5 各组NCI-N87细胞向HMrSV5细胞侵袭数量比较(±s,个)

表5 各组NCI-N87细胞向HMrSV5细胞侵袭数量比较(±s,个)
注:与正常对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
侵袭数量20.20±5.6154.27±4.28##22.55±5.23**40.67±3.14*34.07±2.34**26.53±1.14**组别正常对照组模型组5-FU组半夏泻心汤低剂量组半夏泻心汤中剂量组半夏泻心汤高剂量组n333333
5 讨论
腹膜转移是胃癌患者最常见的复发形式之一[12],其中癌细胞从原发肿瘤剥离形成游离癌细胞,并与腹膜间皮细胞黏附,进而侵入腹膜是形成腹膜转移的关键环节。腹膜间皮细胞是覆盖在腹膜最表层的细胞,是肿瘤细胞转移种植的抵御屏障[13]。已有研究表明,腹膜内游离癌细胞存在并不一定发生腹膜转移,腹膜间皮细胞表型和功能改变是促进游离癌细胞与腹膜间皮细胞黏附、增强癌细胞侵袭和迁移能力的关键因素[14]。研究发现,在癌细胞定植于腹膜间皮细胞前,腹膜间皮细胞已发生表型和功能改变,为癌细胞转移创造有利微环境[15]。
胃癌腹膜转移主要病机为脾胃升降失调,半夏泻心汤为辛开苦降法的代表方剂,方中法半夏、干姜辛开以化痰散结,黄连、黄芩苦降以清解癌毒,人参、大枣、甘草甘补以健脾补虚。全方寒热互用以和其阴阳、辛开苦降以调其升降、补泻兼施以顾其虚实,共奏化痰散结、健脾补虚、清解癌毒之功。课题组前期研究发现,半夏泻心汤能有效预防胃癌根治术后肿瘤复发转移[3],保护胃癌上清液对腹膜间皮细胞的损伤[7],抑制人胃癌腹膜高转移潜能细胞增殖及侵袭转移[8,16]。
外泌体是一类直径为50~100 nm的内吞衍生囊泡,是细胞间通讯的重要载体,各种类型细胞均可分泌外泌体,相对于普通细胞,癌细胞可分泌大量外泌体,在促进肿瘤转移方面发挥重要作用[17-18]。外泌体可富集、包裹细胞外的miRNA、mRNA、蛋白质、细胞因子等多种生物信息物质,并将其远距离传递至受体细胞,内化后激活胞内信号通路及蛋白表达,对受体细胞生物学特性进行精细调节[19]。研究表明,胃癌患者血液中外泌体含量较健康人群明显增加,且其携带的生物信息物质与健康人群也明显不同[20],并证实胃癌来源的外泌体能诱发腹膜间皮细表型和功能改变,参与癌细胞在腹膜扩散发展,促进胃癌腹膜转移[21]。
FN1是大分子的细胞外基质糖蛋白,LAMC1是存在于基底膜中的非胶原糖蛋白,2种蛋白均参与多种生物过程,包括组织、胚胎发育,伤口愈合等[22-23],尤其FN1是促进几乎所有种类癌细胞形成和发展的重要调节因子[24]。同时,FN1和LAMC1作为重要的细胞黏附相关分子,通过细胞外基质中精氨酸-甘氨酸-天冬氨酸组成的短肽序列识别整合素家族介导的细胞黏附与迁移,在肿瘤转移过程中发挥重要作用[25-26]。PCR阵列表明,FN1和LAMC1在肿瘤来源外泌体诱导的腹膜间皮细胞中表达显著上调,进一步研究发现,FN1和LAMC1表达上调与外泌体中miRNA等生物信息物质向腹膜间皮细胞传递有关[27]。
本研究结果显示,在胃癌细胞NCI-N87来源外泌体诱导下,各剂量半夏泻心汤均可减弱NCI-N87细胞与腹膜间皮细胞HMrSV5黏附能力及胃癌细胞的侵袭能力,降低HMrSV5细胞FN1和LAMC1蛋白及mRNA表达。表明半夏泻心汤含药血清可通过调节胃癌来源外泌体诱导的腹膜间皮细胞FN1和LAMC1表达,保护腹膜间皮细胞,增强腹膜间皮细胞对肿瘤细胞的抵御,防止胃癌细胞与腹膜间皮细胞黏附及向腹膜侵袭,这可能是半夏泻心汤治疗胃癌腹膜转移的作用机制之一。

