永存左上腔静脉合并心内畸形的产前超声观察
汤梦霞,他林昆,黄燕玲,陆永萍,李祥碧,杨家凤
(云南大学附属医院超声科,云南 昆明 650021)
永存左上腔静脉(persistent left superior vena cava,PLSVC)是胎儿常见的一种血管变异,在胎儿中的发生率为0.3%~0.5%[1]。PLSVC 不合并其他异常存在时多数对血流动力学没有影响,成人期PLSVC 的存在会增加心导管检查、起搏器植入及心外科手术的风险和难度。
PLSVC 及作为引流途径的扩张冠状静脉窦通过血流动力学的改变造成其他心脏结构发育异常。研究认为当合并有心内、外结构异常时提示胎儿存在染色体异常、流产、预后不良等风险[2]。可根据有无合并异常判断预后。出生后超声心动图检查,易受各种因素限制,难以确诊该病,产前超声不受胸骨上窝及胸骨旁声窗的限制,而且无胎肺气体干扰,易于显示左上腔静脉。
因此产前诊断胎儿永存左上腔静脉以及是否合并异常尤为重要。
1 资料与方法
1.1 资料来源
胎儿产前超声检查资料来源于云南大学附属医院影像采集子系统,妊娠结局相关资料来源于医院病例系统。主要收集指标包括:孕妇的一般人口学特征,胎儿产前超声检查情况,妊娠结局(引产、流产、继续妊娠)
1.2 研究对象
2019 年1 月1 日 至2022 年12 月31 日在云南大学附属医院行产前超声检查的胎儿19 438 例,存在PLSVC 的胎儿90 例,90 例PLSVC 血流均汇入右房。所有孕妇的产前资料完整,诊断为PLSVC 时孕周为17+6周~32 周,孕妇年龄20~45 岁,均为单胎妊娠。
1.3 研究方法
产前检查情况 收集2019 年1 月1 日至2022年12 月31 日期间在我院行超声检查存在PLSVC的胎儿,记录孕妇的年龄、诊断PLSVC 的孕周、合并心内外畸形及软指标异常情况。
研究分组情况 根据胎儿是否合并异常分为合并异常(A 组)及不合并异常(B 组),追踪记录胎儿宫内情况及妊娠结局。
1.4 统计学处理
本研究中计数资料以例数n和构成比(%)表示,通过SPSS 25.0 统计软件运用χ2检验进行分析,P< 0.05 为差异有统计学意义。
2 结果
2.1 产前超声筛查情况
A 组胎儿40 例(44.4%),其中合并心内异常26 例(28.9%),合并心外异常例21 例(23.3%),B 组胎儿50 例(55.6%)。合并心内异常的胎儿中主动脉弓缩窄或主动脉发育不良最常见(9 例),其次为室间隔缺损(7 例),心内异常的超声图像见图1;合并心外异常的胎儿中单脐动脉最常见(14 例,15.6%)。26 例PLSVC 合并心内畸形胎儿的产前检查情况见表1。

表1 PLSVC 合并心内畸形情况[n(%)]Tab.1 Combined intracardiac malformations in PLSVC[n(%)]
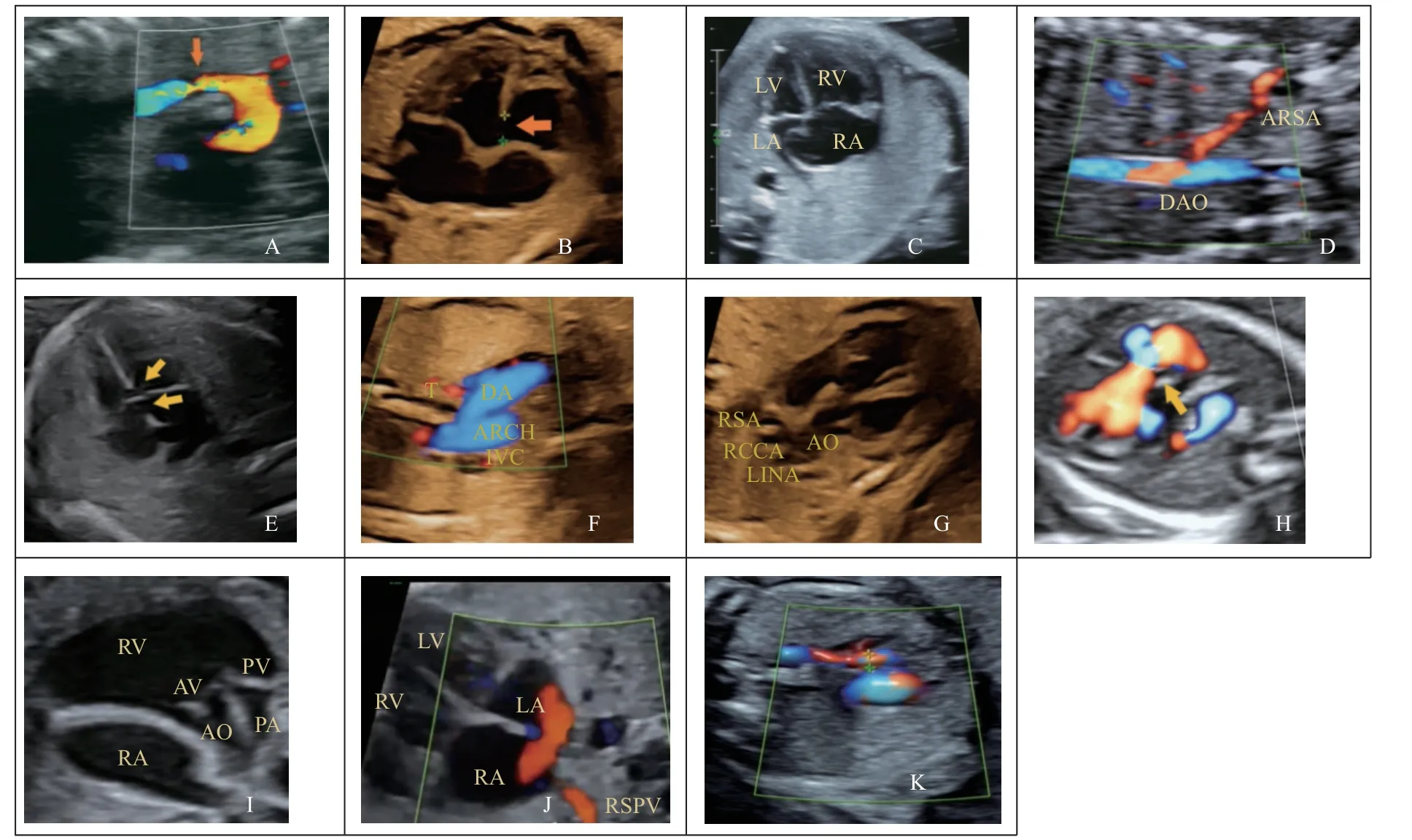
图1 合并心内异常的产前超声图像Fig.1 Prenatal ultrasound images of combined intracardiac abnormality
2.2 诊断时的孕周情况
在20~24 周 行3 级筛查 时诊断 的76 例(84.4%)胎儿中,A 组36 例,B 组40 例,在24 周后诊断的14 例(15.6%)胎儿中,A 组4 例,B 组10 例,差异无统计学意义,P> 0.05(表2)。
2.3 合并心内外结构异常及妊娠结局情况
90 例PLSVC 胎儿中,合并心内异常26 例,胎儿的产前超声检查情况及妊娠结局见表3。

表3 26 例合并心内异常胎儿的产前超声及妊娠结局Tab.3 Prenatal utrasound and pregnancy outcome in 26 fetuses with combined intracardiac abnormality
产前超声检查伴有主动脉弓缩窄或主动脉发育不良的9 例胎儿中,5 例定期超声监测,1 例心功能恶化宫内死亡,1 例存在宫内生长受限,出生后为低体重儿,因呼吸窘迫及心力衰竭死亡,3 例心功能监测情况正常,出生后2 例胎儿证实为主动脉弓轻度缩窄,1 例胎儿未见主动脉弓缩窄。
76 例20~24 周行3 级筛查时诊断的胎儿中,14 例引产,2 例流产,1 例宫内死亡,3 例出生后死亡,56 例胎儿继续妊娠,出生后存活。
14 例24 周后诊断的病例中,最晚诊断孕周为32+1周,14 例胎儿均继续妊娠,出生后存活,1 例胎儿在30 周诊断为部分型肺静脉异位引流,出生后被证实,已行肺静脉异位引流矫治术,术后良好。
3 讨论
永存左上腔静脉(persistent left superior vena cava,PLSVC)是胎儿一种常见的血管变异引起的静脉回流异常,PLSVC 存在时,胎儿左上肢、左侧大脑的回流静脉血通过左上腔静脉汇入心脏,与正常引流途径相比,心脏的容量负荷未发生改变,PLSVC 通过冠状静脉窦汇入右心房时,心脏血流动力学无明显改变;若通过左心耳、左肺静脉或CS 汇入左心房,则导致静脉血汇入动脉系统,是形成右向左分流的原因。在胚胎发育过程中,连接心前静脉的左锁骨静脉发育,左心前静脉逐渐萎缩退化,在一些情况下左心前静脉退化不全,则形成持续性的左上腔静脉。[3]胎儿期发病率0.3%~0.5%,本研究中发病率为0.46%。PLSVC 根据不同的引流方式分为四型。80%-90%胎儿永存左上腔静脉通过冠状静脉窦引流至右心房为I 型,此类型冠状静脉窦常扩张;也有少部分左上腔静脉的血流直接引流至右心房;或引流至左心房。本研究PLSVC 均为I 型。
本研究PLSVC 合并心内畸形最多为主动脉弓缩窄或弓发育不良,均在行三级超声检查时发现。Gustapane 等人报告在超声扫描时20.9%的PLSVC与主动脉弓缩窄或发育不良有相关性[4],一项病例报告表也明胎儿存在PLSVC 时应该关注有无主动脉弓缩窄[5]。关于主动脉弓缩窄的病因,根据“阻塞性理论”假设,PLSVC 的引流途径引起CS 扩张,由于空间限制,可能导致左侧阻塞性病变的形成。Agnoleti G 等认为左上腔静脉的持续存在会扰乱左心室的正常发育,与左心室流入和流出阻塞密切相关[6]。
据Kele A 及曹群等[7-8]的报道,PLSVC 合并心脏结构异常谱系为房室间隔异常、室间隔缺损、主动脉弓缩窄或发育不良,本组PLSVC 合并心脏结构异常第二位是室间隔缺损,第三位是左心发育不良。
产前超声筛查发现PLSVC,常规通过四腔心切面及三血管切面。四腔心切面扩张的冠状静脉窦是间接征象,三血管切面肺动脉左侧的左上腔静脉是直接征象,旋转探头显示静脉管腔与冠状静脉窦相连,汇入右心房即明确诊断。
冠状静脉窦(coronary sinus,CS)是接收胎儿心肌静脉血的正常解剖结构,起自主动脉根部,沿心房后方的左房室沟走行,接受心肌的静脉血后汇入右房,随着妊娠周数的增加,冠状静脉窦内径逐渐增加。在妊娠期间的正常内径是1-3.2 mm,当内径大于4 mm 时,可认为冠状静脉窦扩张[9]。冠状静脉窦扩张的原因很大一部分是由于持续性左上腔静脉的存在引起的,而且PLSCV 合并心脏结构畸形时静脉窦扩张更明显[10]。本研究中7 例在云南大学附属医院产检病例是在28~32 周行二次排畸时发现PLSVC,其余7 例是孕28 周后转诊到云南大学附属医院行胎儿超声心动图检查发现。复习7 例胎儿的产前超声检查存图,三级筛查时四腔心切面没有明显扩张的冠状静脉窦,三血管切面肺动脉左侧没有明显的管道结构。分析原因是三级筛查时冠状静脉窦虽然引流左上腔静脉的血流,但没有引起扩张,间接征象不明显,对于三血管切面肺动脉左侧细小左上腔静脉图像探查不仔细,造成漏诊。14 例晚孕期诊断的PLSVC,一例合并肺静脉部分异位引流,不合并其他心内心外的异常。没有造成冠状静脉窦更多血容量的增加,可能也是三级筛查时冠状静脉窦没有明显扩张的原因。14 例PLSVC 没有合并其他心内结构异常,也证明了早期即出现扩张的CS 阻塞左心发育的理论。
本组9 例主动脉弓异常胎儿中,5 例还合并其他心脏异常如室缺、右室双出口、左心偏小,合并心外异常如肾缺如、唇腭裂等,4 例因合并其它心内外异常引产,弓异常的5 例胎儿产前定期超声监测,1 例心功能恶化宫内死亡,1 例存在宫内生长受限,出生后为低体重儿,新生儿因呼吸窘迫及心力衰竭死亡,3 例未发现心功能恶化。关于心功能恶化的原因,一方面认为动脉导管的组织延伸到主动脉的管壁上,出生前,主动脉峡部的血流主要来自动脉导管,出生后由于氧气的刺激动脉导管关闭,主动脉由于有静脉导管组织的存在也逐渐闭合,婴儿心脏后负荷增加,出现心力衰竭、肺水肿,导致病情恶化[11],另一方面,弓异常胎儿主动脉弹性减低,而且主动脉弹性的损伤与心脏收缩功能下降有关[12]。评估胎儿的心功能并在随后的孕期观察心功能变化是重要的。
鉴于 PLSVC 这种静脉变异与先天性心脏病(coronary heart disease,CHD)之间的关系,并影响到妊娠结局,我们将PLSVC 视为 CHD 的标志物。三级筛查时不限于扩张冠状静脉窦的间接征象,联合无名静脉切面扫查,提高左上腔静脉的检出率[13]。只要发现 PLSVC,标准切面(三血管和气管切面、四腔切面和流出道切面)的筛查不足以排除心脏异常。需要观察主动脉弓、肺静脉角等切面完善胎儿心脏结构的评估,观测主动脉横弓远端内径和主动脉瓣环内径的Z 值有助于胎儿出生后主动弓脉缩窄的预测[14]。在监测主动脉弓可能异常的同时,也要避免假阳性的诊断,因为正常胎儿主动脉峡部血流量仅占联合心脏排出量的10%~15%,与主动脉其他节段相比较,峡部血流充盈较差,正常情况下峡部内径可以轻度细窄。

