基于TCGA 数据库筛选宫颈鳞状细胞癌潜在的预后标志物及验证
颜怡君 ,杨宏英 ,张红平 ,李 政 ,贾 岳 ,赵 敏
(1)云南大学附属医院核医学科,云南 昆明 650021;2)昆明医科大学第三附属医院/云南省肿瘤医院妇科,云南 昆明 650118;3)医务部,云南 昆明 650118)
宫颈癌是发病率较高的常见妇科癌症之一,也是全球第四大导致女性死亡的癌症[1],仅次于乳腺癌、结直肠癌和肺癌。宫颈癌发病逐渐年轻化[2],而且容易发生淋巴节转移或蔓延,导致患者预后不佳[3-4]。据统计,全球每年新增病例604 127 例,死亡人数超过 341 831 例[5],其中超过90%的死亡病例发生在包括中国在内的发展中国家。据世界卫生组织估计,从2015 年到2030 年,全世界宫颈癌的死亡率将增加约22%。对于包括中国在内的发展中国家来说,宫颈癌仍是一个重要的公共卫生问题。宫颈癌的主要病理类型85%以上是宫颈鳞状细胞癌(cervical squamous cell carcinoma,CESC),宫颈脱落细胞筛查、HPV 检测和阴道镜的联合应用对CESC 癌前病变检出率较高,同时随着HPV 疫苗的普及,可有效降低患CESC 的风险,但昂贵的检查费用和宫颈癌预防的普及教育不足,导致包括中国在内的发展中国家妇女未能广泛获得筛查和疫苗接种的机会,同时CESC 的早期症状并不典型以及现有诊断方法的局限性,因而超过50%的患者就诊时已伴局部浸润或淋巴转移,5 a 生存率不足17%。在当今个性化医疗的时代,为实现对CESC 患者的精准治疗,手术后第一时间准确预测患者的预后转归情况尤为重要。因此,临床上迫切需要寻找能够准确预测CESC 患者预后的特异性标志物,以便能通过个性化的治疗和随访方案来改善患者预后。
miRNA 是一类具有调节功能的单链非编码RNA,其长度为19~25 个核苷酸,通过与靶基因mRNA 的3’端非翻译区(3’-untranslated region,3’-UTR)结合[6],来降解某些特定基因或抑制其表达,从而影响蛋白水平的表达或功能。miRNA可以调节约 60% 的蛋白质编码基因,因此被称为人类基因组的“主调节剂”[7]。miRNA 与肿瘤增殖、侵袭、转移、肿瘤细胞的生长和凋亡有关[8],已被鉴定为一种有效的肿瘤抑制因子/启动子(TsmiRs/Onco-miRs),具有成为生物标志物的潜力。
本研究利用TCGA 公共数据库中CESC 的miRNAs 表达数据及相关临床数据,通过生物信息学方法构建了一个由4 个miRNAs(miR-505-5p、miR-142-3p、miR-532-5p、miR-218-1-3p)组成的预后风险模型,在CESC 组织中验证后显示miR-505-5p 在CESC 组织中的表达显著低于癌旁组织,同时通过细胞实验发现miR-505-5p 与CESC 细胞增殖、迁移和凋亡密切相关。进一步预测并初步验证了TBL1XR1 作为miR-505-5p 靶基因的可能性,为miR-505-5p 作为CESC 的预后标记物及探索CESC 发生的潜在分子机制提供一定的依据。
1 资料与方法
1.1 筛选CESC 中差异表达的miRNAs
从TCGA 数据库(The Cancer Genome Atlas,https://portal.gdc.cancer.gov/)中下载255 例CESC 组织和2 例癌旁正常组织的miRNAs 测序信息和相应临床数据,将miRNAs 表达量在癌与癌旁正常组织相差2 倍以上(|logFC∣ > 1),校正后P值 <0.05(FDR < 0.05)作为过滤条件,利用R 语言中的edgeR 包对miRNAs 的表达进行差异分析,绘制差异表达miRNAs 的火山图;利用pheatmap 包,选择上调和下调最显著的20 个miRNAs,绘制热图。
1.2 CESC 预后风险模型的构建
对差异表达的miRNAs 与生存时间的关系使用Kaplan-Meier 生存分析,根据P< 0.05,得到与生存相关的miRNAs,定义每个miRNA 的表达中位值,分为高低表达组,并绘制生存曲线。结合患者的生存时间,对上述得到与生存相关的miRNAs 进行单因素COX 分析,找出预后相关的miRNAs。比较每个miRNA 与生存时间的关系,计算每个miRNA 与CESC 患者生存的风险比(hazardratio,HR)和P值,以P< 0.05 的标准筛选出与CESC 患者预后显著相关的miRNAs。单因素COX 分析发现5 个miRNAs 与生存显著相关,进一步对这5 个miRNAs 进行多因素COX 分析,利用R 软件中的caret 包对所有样本等分为训练组(Train 组)和验证组(Test 组),对5 个miRNAs进行随机组合,最终发现4 个miRNAs 构建的多因素COX 风险预后模型在验证组中准确度最高。
1.3 风险预后模型评价
根据Train 组构建多因素Cox 回归分析的结果及风险系数(coef),计算基于miRNA 表达量的风险评分(risk score),计算公式为:风险评分(risk score)=风险基因1 的表达量×coef1+风险基因2 的表达量×coef2+...+风险基因n 的表达量×coefn(coef 为风险系数);对Train 组和Test组的每个样品进行风险评分,依据Train 组风险评分的中位数将所有样本分为高风险组和低风险组。利用R 软件中survival 包分别绘制Train 组、Test 组及所有样本的风险生存曲线,比较高低风险组的生存差异;利用R 软件中的survival ROC包绘制构建模型的ROC 曲线,用于评价模型预测患者预后的准确性。
1.4 样本收集
选取2020 年9 月至2021 年5 月在昆明医科大学第三附属医院就诊,且病理确诊为宫颈鳞状细胞癌的患者作为研究对象,于术中留取宫颈鳞状细胞癌组织及癌旁组织(癌旁组织距癌组织 > 2 cm)各21 份,立即放入装有RNA 保存溶液(RNA SAVE)的耐超低温的冻存管中,后转存到-80 ℃冰箱中保存。本研究获得了昆明医科大学第三附属医院伦理委员会的批准,所有患者均签订了知情同意书。
1.5 细胞、主要试剂与仪器
人子宫颈鳞癌细胞(SiHa)来自美国ATCC,由武汉普诺赛生命科技有限公司复苏后保存使用。FastKing RT Kit(With gDNase)FastKing cDNA 逆转录试剂盒购自北京TIANGEN,Bulge-Loop miRNA qRT-PCR Starter Kit、Ribo FECT CP Transfection Kit 转染试剂盒、miR-505-5p 及U6 引物均购自广州锐博生物科技有限公司,Taq Pro Universal SYBR qPCR Master Mix 购自南京诺唯赞,BCA 蛋白浓度测定试剂盒、RIPA 裂解液购自碧云天生物,CCK-8 试剂盒购自上海东仁化学,凋亡试剂盒购自上海七海复泰生物,DMEM 基础培养基购自美国Gibco 公司,TBL1XR1 抗体购自北京Bioss,GAPDH 抗体购自上海Abmart。
1.6 实验方法
1.6.1 RT-PCR 检测CESC 组织中4 个miRNAs的表达将21 例CESC 组织和21 例癌旁组织分别作为实验组和对照组,液氮研磨20 mg 组织后,采用TRIZOL 提取总RNA,并在ND-1000 型紫外分光光度计中测RNA 的浓度,A260/280 比值在1.8~2.0 者可用于后续实验,并根据RNA 浓度计算RT-PCR 反应体系中所需总RNA 的体积。按照逆转录试剂盒说明将样本中提取的RNA 逆转录为cDNA,在罗氏LightCycle 96 实时荧光定量PCR 仪中按照RT-PCR 说明书进行扩增反应,反应条件为95℃预变性10 min,95℃变性2 s,60℃退火20 s,70℃延伸10 s,共进行40~45 个循环,采用U6 作为内参基因,每个样本均设3 个复孔。反应结束,做Ct 值分析。实验结果以2-△△Ct法即相对表达量来表示,2-△△Ct==2^-[(Ct 实验组目的基因-Ct 实验组内参基因)-(Ct 对照组目的基因-Ct 对照组内参基因)]。
1.6.2 细胞培养及转染将复苏后的SiHa 细胞接种至含有10%胎牛血清、1%青链霉素混合液、1%谷氨酰胺的DMEM 培养基中,并放入5%CO2,37℃的培养箱中培养。取对数期生长的细胞用0.25%胰酶消化收集细胞,将细胞接种至不同的孔板中(6 孔板、12 孔板、96 孔板),至细胞培养至融合度60%左右时,按照转染试剂盒Ribo FECT CP Transfection Kit 说明书转染mimics NC及miR-505-5p mimics,6 孔板于转染24 h 后用于PCR 检测、WB 检测及流式检测细胞凋亡,12孔板用于做划痕实验,96 孔板于转染24 h 后进行CCK8 检测。以SiHa 细胞正常培养和转染mimics NC 作为对照组,转染miR-505-5p mimics作为过表达组,再次采用RT-PCR 对各组细胞中miR-505-5p 的表达情况进行检测,方法同1.6.1。
1.6.3 CCK8 法检测3 组细胞增殖于转染24 h后去除培养板中的细胞上清液,设置空白对照孔,每孔加入100 μL 基础培养基;向每孔中加入10 μL CCK-8 溶液,放回培养箱中避光孵育2 h,用酶标仪在450 nm 处检测各孔的OD 值;按以下公式计算细胞活力:细胞活力%=(实验孔OD-空白孔OD)/(对照孔OD-空白孔OD)×100%。实验重复3 次。
1.6.4 细胞划痕实验于转染后加入0.25%胰酶消化并收集3 组细胞,调整细胞浓度至1.0×105个/mL,接种至新的12 孔板中,每组3 孔重复。过夜培养至融合度95%时,用10 μL 枪头横竖划两条线,基础培养基洗一次,加入完全培养基,0 h、12 h、24 h、48 h 时间点拍照观察,直至中间划痕长满为止。
1.6.5 流式细胞仪检测3 组细胞的凋亡情况于转染后24 h 收集各组细胞,按照凋亡试剂盒说明书在流式细胞仪中检测各组细胞的凋亡。实验重复3 次。
1.6.6 miR-505-5p 靶基因预测使用miRDB(http://www.mirdb.org/)、miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/php/download.php)、TargetScan(http://www.targetscan.org/)3 个数据库分别进行miR-505-5p 的靶基因预测,对3 个数据库预测出的靶基因取交集,设置过滤条件为P< 0.01,进行GO(GeneOntology,基因本体论)和KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)功能及通路的富集分析。通过生物信息学的方法分析靶基因在TCGA 数据库CESC 组织中的表达情况,为了进一步缩小研究范围,选择TCGA 数据库中CESC 组织和癌旁组织差异表达2 倍以上的靶基因作为研究对象。经预测分析,TBL1XR1 可能是miR-505-5p 的靶基因。
1.6.7 RT-PCR 检测 miR-505-5p 对 TBL1XR1RNA 表达水平的影响 取转染mimics NC 及miR-505-5p mimics 24 h 后的2 组细胞,采用TRIZOL 提取细胞中总RNA,逆转录为cDNA 后按照PCR 扩增试剂盒说明书进行扩增,以GAPDH 作为内参,GAPDH 上游引物(序列:TTGCCCTCAACGACCACTTT),GAPDH 下游引物(序列:TGGTCCAGGGGTCTTACTCC),TBL1XR1上游引物(序列:AAGTGCTGGAGTAGACAAG),TBL1XR1 下游引物(序列:AATGCTGGTGCT GAATGA),反应体系包括Taq Pro Universal SYBR qPCR Master Mix 5 μL、上游引物 0.25 μL、下游引物0.25 μL、cDNA 模板1.0 μL、Nuclease-Free Water 3.5 μL,反应条件为95 ℃预变性10 min,95℃变性2 s,60 ℃退火20 s,70 ℃延伸10 s,进行40~45 个循环,每个样本均设3 个复孔,通过2-△△Ct法分析TBL1XR1 的相对表达量。
1.6.8 蛋白印迹法检测miR-505-5p 对TBL1XR1蛋白水平的影响取转染mimics NC 及miR-505-5p mimics 24 h 后的2 组细胞,加入RIPA 裂解液冰浴上裂解,离心后,使用超微量分光光度计,测量每个样本蛋白浓度。根据各个样本蛋白浓度,调整各样本上样体积,保证每个样品的蛋白上样量均为30 μg,进行SDS-PAGE 电泳,反应结束后,使用湿转法将蛋白质样品转至PVDF 膜,将PVDF 膜置于5%的牛血清白蛋白中,室温封闭1 h,TBST 漂洗后加入TBL1XR1 抗体(1∶1 000)4℃冰箱过夜,取出后TBST 缓冲液漂洗,加入酶标山羊抗小鼠抗体(1∶2 000),室温孵育2 h,TBST洗膜后,ECL 显色并平放在凝胶成像仪里采集图像。每个样本重复3 次。
1.7 统计学处理
采用 SPSS26.0 软件及Graph prism 对数据进行统计分析,组间比较采用Mann-Whitney U 秩和检验或t检验,3 组间比较采用单因素方差分析来比较组间差异,采用Pearson 或Spearman 相关法来检验miR-505-5p 相对表达量与宫颈癌患者各临床资料间的相关性。以P< 0.05 为差异有统计学意义。
2 结果
2.1 差异miRNA 的筛选
相比于正常组织,在CESC 组织中共有115个差异表达的miRNAs(上调39 个,下调76 个),绘制火山图(图1),并选择上调与下调最显著的前20 个miRNAs 绘制热图(图2)。图中红色表示该基因在CESC 组织中的表达较正常宫颈组织上调;绿色表示该基因在CESC 组织中的表达较正常宫颈组织下调。

图1 CESC 中115 个差异表达的miRNAs 火山图Fig.1 Volcano map of 115 differentially expressed miRNAs in CESC heatmap

图2 CESC 组织中差异表达最显著的前20 个miRNAs 热图Fig.2 Heat map of the top 20 miRNAs with the most significant differential expression in CESC tissues
2.2 CESC 预后风险模型的构建
分析115 个差异表达miRNAs 与生存时间的关系,使用Kaplan-Meier 生存分析,得到9 个与CESC 患者生存相关的miRNAs(P< 0.05):hsa-miR-101-3p、hsa-miR-142-3p、hsa-miR-145-5p、hsamiR-200c-3p、hsa-miR-218-1-3p、hsa-miR-504-5p、hsa-miR-505-5p、hsa-miR-532-5p、hsa-miR-3613-5p,并分别绘制其生存曲线(图3A-I),红色代表miRNA 高表达组,蓝色代表miRNA 低表达组。
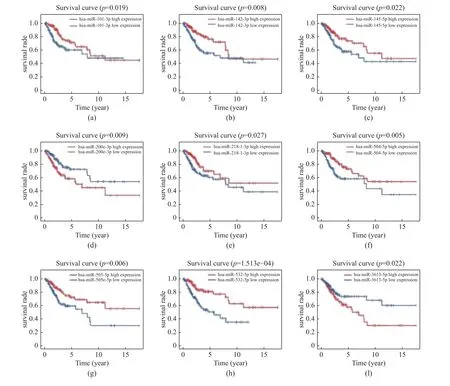
图3 9 个与CESC 患者生存相关miRNAs 的生存曲线Fig.3 Survival curves of 9 miRNAs related to CESC
对9 个与生存相关的miRNAs 进行单因素及多因素Cox 回归分析,最后得到由4 个miRNAs(hsa-miR-505-5p、hsa-miR-142-3p、hsa-miR-532-5p、hsa-miR-218-1-3p)组成的风险预后模型,该模型在验证组中准确度最高,4 个miRNAs 的风险系数均小于零,提示这4 个miRNAs 是患者预后的保护因素,其表达量与生存时间正相关,见表1。

表1 多因素COX 回归分析Tab.1 Multivariate COX regression analysis
2.3 风险评分方程的建立及生存曲线的绘制
根据上述多因素COX 分析得到的4 个miRNAs及风险系数,得到风险评分方程risk score=-0.41*hsa-miR-505-5p 表达量-0.48* hsa-miR-142-3p 表达量-0.81* hsa-miR-532-5p 表达量-0.48* hsa-miR-218-1-3p 表达量。根据此方程,计算每位宫颈鳞状细胞癌患者的risk score 数值,根据Train 组risk score 数值的中位值,将CESC患者分为高风险评分组和低风险评分组,并将此模型运用到Test 组和所有样本中进行验证。利用R 软件中的survival 包绘制风险生存曲线,比较高低风险组的生存差异,红色代表高风险,蓝色代表低风险。Train 组、Test 组和所有样本的生存曲线(图4A、4B、4C)均显示,高风险组生存率明显低于低风险组(P< 0.05),模型准确。
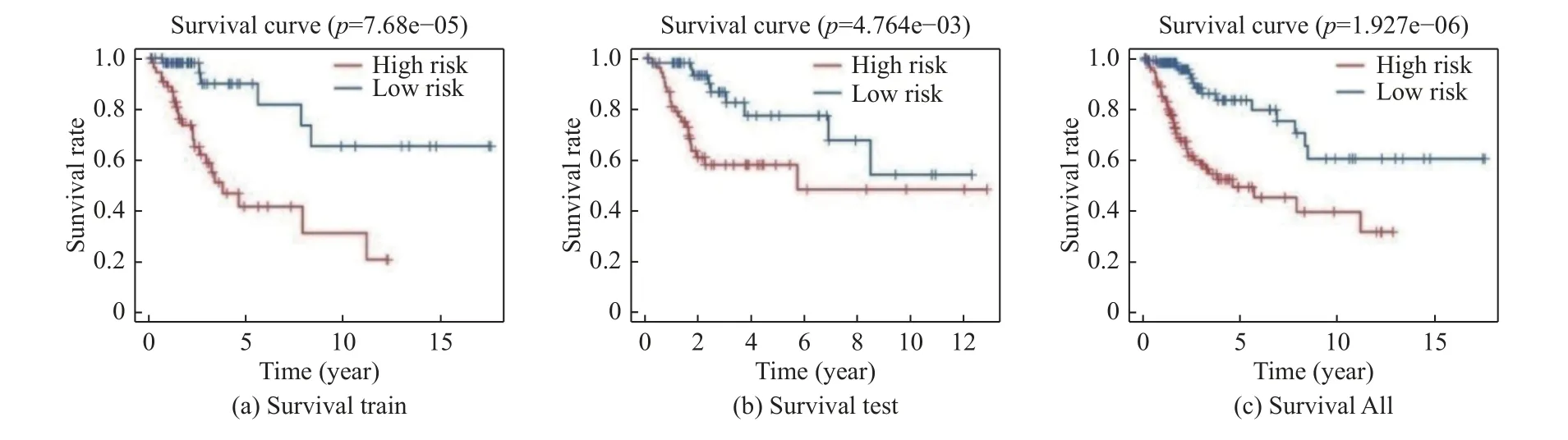
图4 Train 组、Test 组及所有样本的生存曲线Fig.4 Survival curves of Train group,Test group and all samples
2.4 风险预后模型的评价
利用R 中的survival ROC 包分别绘制Train组、Test 组及所有样本的ROC 曲线(图5A、B、C),用以评价模型的准确性。Train 组、Test 组及所有样本的ROC 曲线显示,模型预测CESC 患者预后的AUC 分别为0.859,0.758 及0.795,这表明模型具有良好的敏感性、特异性及一定预测能力。

图5 Train 组、Test 组及所有样本的ROC 曲线Fig.5 ROC curves of Train group,Test group and all samples
2.5 CESC 患者肿瘤组织及癌旁组织中预后风险模型中4 个miRNAs 的表达
CESC 患者肿瘤组织及癌旁组织中4 个miRNAs 的相对表达量结果显示:miR-142-3p、miR-532-5p、miR-218-1-3p 在CESC 肿瘤组织及癌旁组织中差异无统计学意义(表2),miR-505-5p 相对表达量分别为癌组织0.253 5(0.107 1,0.926 8)和癌旁组织0.641 7(0.143 0,5.984 8),miR-505-5p 在CESC 患者癌组织中相对表达量低于癌旁组织(Z=-1.987,P=0.047),且差异具有统计学意义,见图6,因此选择miR-505-5p 作为下一步研究对象。分析CESC 患者组织中miR-505-5p 相对表达量与患者各临床资料的相关性,见表3,miR-505-5p 的相对表达量与患者的临床分期和侵袭程度负相关(P< 0.05,图7)。

表3 miR-505-5p 相对表达量与各临床资料相关性分析Tab.3 Correlation between the relative expression of miR-505-5p and clinical data
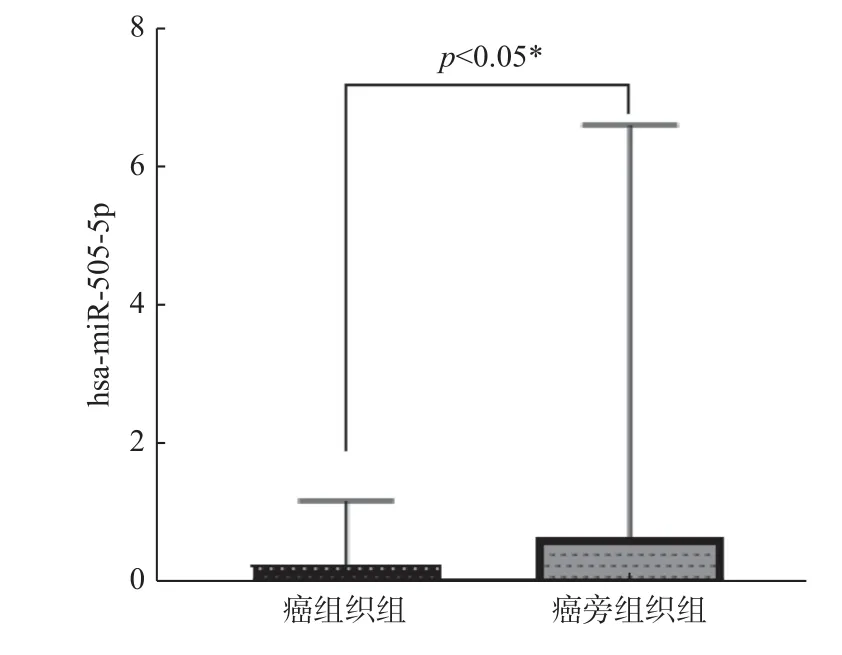
图6 miR-505-5p 在CESC 组织及癌旁组织中的差异表达Fig.6 Differential expression of miR-505-5p in CESC tissues and adjacent tissues

图7 miR-505-5p 相对表达量与临床分期、宫颈侵袭程度的相关性Fig.7 Correlation between the relative expression of Mir-505-5p and clinical stage and cervical invasion degree
2.6 3 组SiHa 细胞中miR-505-5p 相对表达量比较
RT-PCR 检测正常培养组、转染mimics NC组以及转染miR-505-5p mimics 组SiHa 细胞中miR-505-5p 的相对表达量,结果显示miR-505-5p mimics 组中SiHa 细胞的miR-505-5p 的相对表达量高于正常培养组及mimics NC 组(P< 0.05),见图8。

图8 RT-PCR 验证转染效率Fig.8 Transfection efficiency verified by RT-PCR
2.7 miR-505-5p 抑制SiHa 细胞的活力、迁移及促进凋亡
采用CCK8 实验、细胞划痕实验及流式细胞仪分别检测miR-505-5p 对SiHa 细胞的活力、迁移及凋亡的影响,结果显示,与正常培养组及mimics NC 组相比,转染miR-505-5p mimics 后SiHa 细胞活力(P< 0.05)及迁移能力下降,总细胞凋亡率增加(P< 0.05),见图9-11,提示过表达miR-505-5p 抑制SiHa 细胞的活力、迁移能力及促进凋亡。
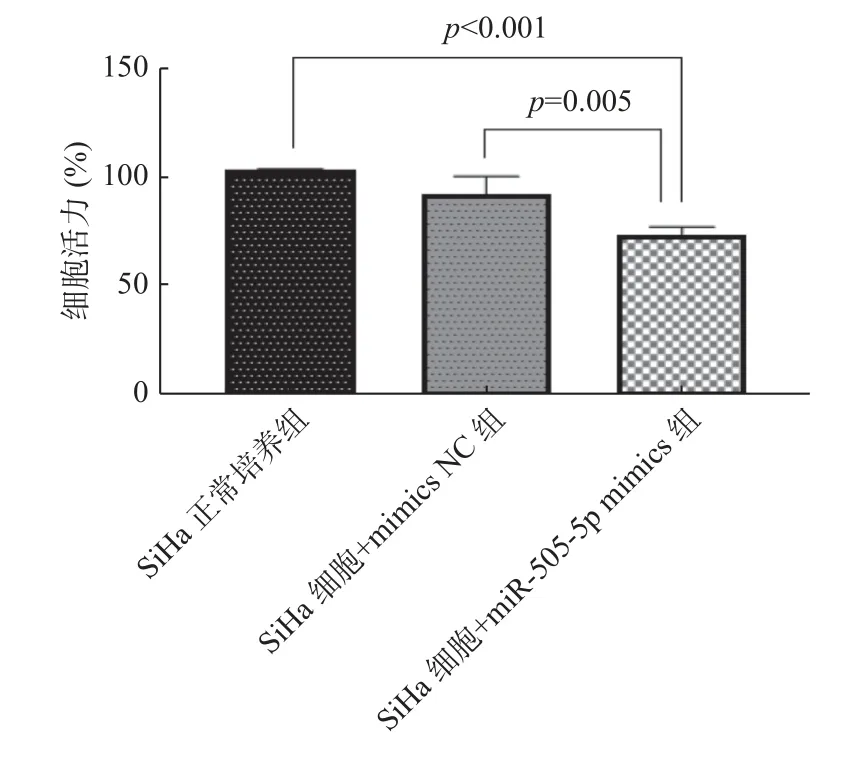
图9 CCK8 检测miR-505-5p 对SiHa 细胞增殖的影响Fig.9 Effect of miR-505-5p on the proliferation of SiHa cells detected by CCK8

图10 划痕实验检测miR-505-5p 对SiHa 细胞迁移的影响(100×)Fig.10 Effect of miR-505-5p on the migration of SiHa cells detected by scratch test(100×)

图11 流式细胞仪检测miR-505-5p 对SiHa 细胞凋亡的影响Fig.11 Effect of miR-505-5p on apoptosis of SiHa cells detected by flow cytometry
2.8 miR-505-5p 靶基因的预测
通过miRDB、miRTarBase、TargetScan3 个数据库分别进行miR-505-5p 的靶基因预测,对三个数据库预测出的靶基因取交集,共有14 个共同靶基因,如图12。为阐释14 个靶基因的功能,进行了GO 和KEGG 功能及通路的富集分析,结果显示14 个靶基因主要参与了细胞信号转导及细胞周期调控的相关信号通路,见图13。同时分析靶基因在TCGA 数据库CESC 组织中的表达状态可知(如表4),TBL1XR1 在宫颈鳞状细胞癌组织中的表达量是癌旁组织2.046 倍,因此选择TBL1XR1 作为目标靶基因。

表4 TCGA 数据库CESC 组织中靶基因的表达Tab.4 Expression of target genes in CESC tissues from TCGA database
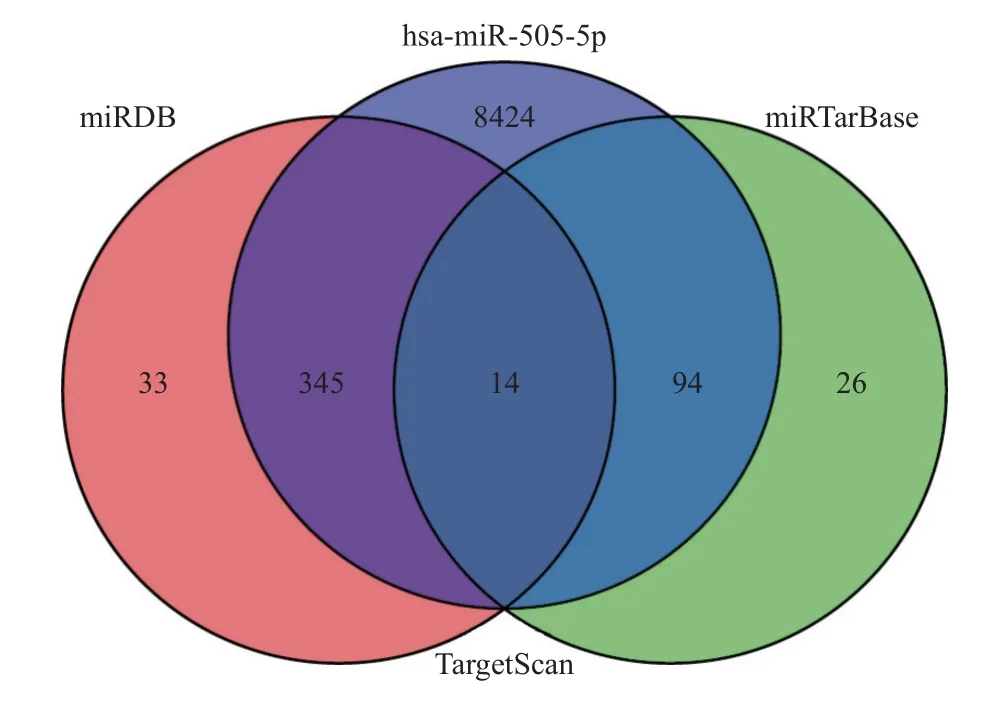
图12 3 个数据库中miR-505-5p 靶基因预测结果Fig.12 Prediction results of miR-505-5p target genes in three databases
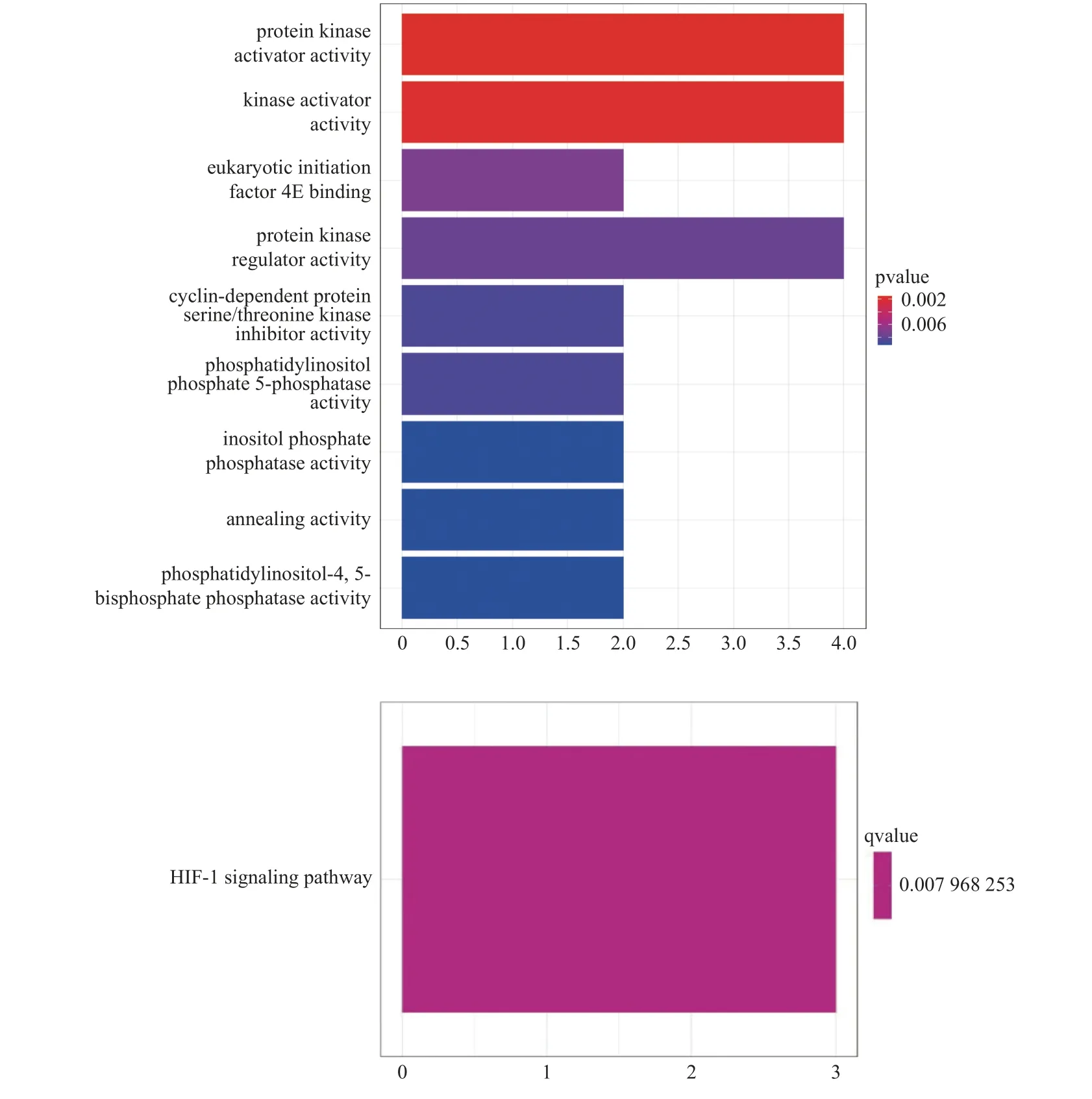
图13 14 个靶基因GO 及KEGG 通路富集Fig.13 Enrichment of GO and KEGG pathways of 14 target genes
2.9 过表达miR-505-5p 抑制TBL1XR1 RNA及蛋白的表达
采用RT-PCR 及蛋白印迹法检测miR-505-5p 对SiHa 细胞中TBL1XR1 RNA 及蛋白表达的影响,结果显示,与mimics NC 组相比,miR-505-5p mimics 组 中SiHa 细 胞TBL1XR1 的RNA 及 蛋白水平下降(图14A、14B,P< 0.05)。说明miR-505-5p 可能抑制TBL1XR1 的表达。
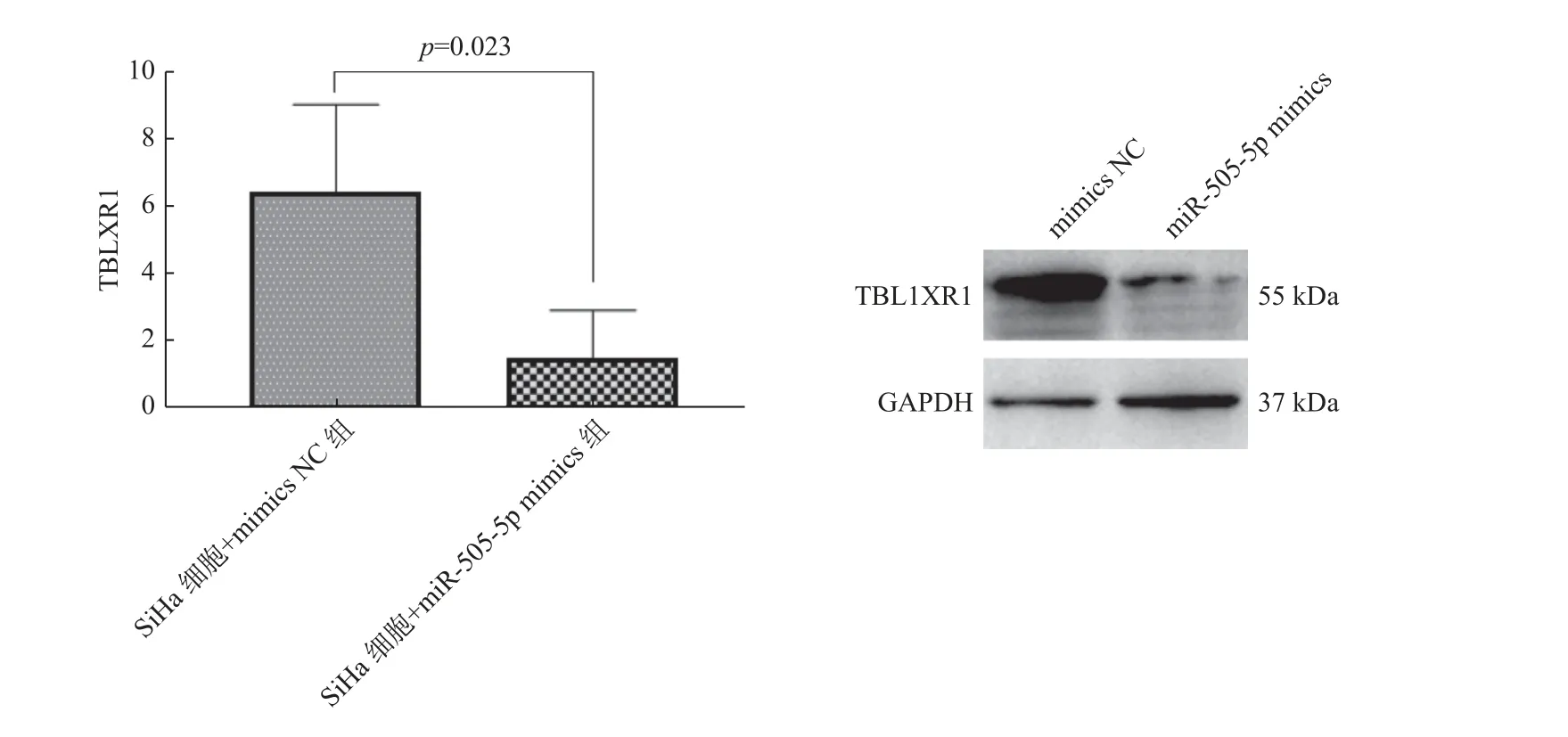
图14 转染miR-505-5p 后细胞中TBL1XRI RNA 及蛋白水平的变化Fig.14 Changes of TBL1XRI RNA and protein levels in cells transfected with miR505-5p
3 讨论
从正常组织到宫颈鳞状细胞癌的复杂过程包括轻度异型增生、中度异型增生、重度异型增生、原位癌和浸润癌,是一个多阶段、多基因调控异常的过程。miRNAs 在肿瘤的发生发展过程中扮演着原癌基因或抑癌基因的双重角色[9],可通过靶向调控各种信号通路中的靶基因来调节肿瘤发生的关键过程[10]。新的miRNAs 和靶基因的发现,将有助于宫颈癌的预后预测和个性化治疗方案的实施。
近年来,利用生物信息学分析法筛选肿瘤预后相关的miRNAs 及其靶基因已成为取代RNA 印迹分析法、微阵列芯片等传统方法成为一种经济高效的分析方法,本研究采用生物信息学方法对 TCGA 数据库中255 例宫颈鳞状细胞癌患者组织及2 例癌旁正常组织相关miRNAs 进行差异分析,共筛选出115 个差异表达倍数在2 倍以上的miRNAs,结合患者临床信息,通过Kaplan-Meier 生存分析、单因素COX 及多因素COX 回归分析,构建了由4 个miRNAs 组成的预后风险模型,这4 个miRNA 分别是miR-505-5p、miR-142-3p、miR-532-5p 和miR-218-1-3p。然 而,TCGA 数据库CESC 组织样本主要来源于美洲白人和黑人,不排除有人种遗传的影响,因此本研究进一步通过收集CESC 组织和癌旁组织来验证预后风险模型中4 种miRNAs 的表达,选择CESC 组织和癌旁组织中差异表达显著的miR-505-5p 作为研究对象,同时探究miR-505-5p 对CESC 细胞功能的影响,结果显示miR-505-5p在CESC 患者癌组织中较癌旁组织低表达,并与CESC 患者临床分期和侵袭程度呈负相关;细胞功能学实验表明,miR-505-5p 可抑制宫颈鳞状细胞癌SiHa 细胞的增殖、迁移并促进其凋亡,提示miR-505-5p 在CESC 中发挥抑癌作用。在既往的研究中,已经报道miR-505-5p 参与调节肿瘤发生的相关细胞通路,并发挥抑癌作用。例如,在一项研究中[11],miR-505-5p 在膀胱癌组织中显著低表达,并通过靶向作用于Polo 样激酶1(polo-like-kinase 1,PLK1)负向调控膀胱癌细胞的增殖和迁移;miR-505-5p[12]可抑制鼻咽癌细胞的迁移和侵袭,并可靶向c-Myc 和β-连环蛋白(β-catenin)来抑制Wnt 信号传导,从而阻止EMT 进程。
为进一步探究miR-505-5p 在宫颈鳞状细胞癌中的潜在作用机制,本研究通过生物信息学分析法筛选出TBL1XR1 是miR-505-5p 的可能靶基因,人类TBL1XR1(转导素 1X 连锁受体蛋白1)基因位于染色体3q26.32,由18 个外显子组成,长度为208661bp。TBL1XR1 编码的蛋白是组成核受体辅助抑制因子(NCoR)的核心成分,可通过调节维甲酸和甲状腺激素受体的沉默介质(SMRT)在转录活性中发挥关键作用[13]。越来越多的研究表明,TBL1XR1 可受多种miRNAs 的调控,在肿瘤中表达上调并作为肿瘤启动子调节各种生物学过程,包括细胞增殖、迁移、肿瘤血管生成和上皮-间质转化(EMT)[14]。例如,miR-1 178-3p[15]在肝癌组织和细胞系中表达下调,miR-1 178-3p过表达通过直接调控TBL1XR1/PI3K/Akt 通路抑制肝癌细胞增殖、迁移和侵袭,在小鼠体内降低肿瘤生长和血管生成。在肺癌[16]中,miR-34c-5p[16]可通过直接靶向TBL1XR1 抑制肺癌细胞的增殖、迁移和侵袭。本研究通过在SiHa 细胞中转染miR-505-5p mimics 后发现,TBL1XR1 表达水平较miR-505-5p NC 组降低,Western blot 实验表明过表达miR-505-5p 后TBL1XR1 蛋白水平降低,初步验证了miR-505-5p 与TBL1XR1 的负向调控关系。既往研究证实TBL1XR1 可通过激活许多信号转导途径[17]来发挥作用,包括Notch23、Wnt-β-catenin、NF-κB 及PI3K/Akt 等,例如,在胰腺癌[18]中,TBL1XR1 的表达可激活c-Met/PI3K/Akt 信号通路以及促进EMT 表型转化,从而诱导胰腺癌细胞的增殖、迁移、侵袭;在非小细胞肺癌(non-small cell lung cancer,NSCLC)中[19]TBL1XR1 通过调节c-Met 介导的MEK 通路介导细胞的存活和增殖。TBL1XR1 作为促癌因子,其高表达被证实与许多肿瘤的不良预后和淋巴转移有关,如胃癌[20]、原发性睾丸淋巴瘤[21]等。Wang 等[22]研究发现,TBL1XR1 的RNA 及蛋白表达水平在宫颈癌细胞和组织中显著上调,TBL1XR1 通过调节NF-κB 和 Wnt-β-catenin 通路来诱导 EMT,与宫颈癌患者的临床分期、生存时间和复发显著相关,并可作为宫颈癌患者的独立预后因素。然而目前尚未报道在宫颈癌中miR-505-5p 与TBL1XR1 的相互作用。
综上所述,本研究初步探究了miR-505-5p在CESC 中可能通过靶向TBL1XR1 发挥抑癌作用,仅是为miR-505-5p 作为CESC 的预后标记物提供一定的依据,同时为CESC 新的靶点的发现提供思路。本研究仍存在许多不足之处,首先,本研究仅在CESC 组织中验证了miR-505-5p 的表达,其是否能作为CESC 无创预后标记物还应在患者体液中验证,并可进一步通过随访CESC 患者生存时间和状态来证实。其次,miR-505-5p与TBLIXRI 的靶向关系也只是初步预测,还需通过荧光素酶报告基因、TBL1XR1 敲低回复等实验来证实二者的靶向关系。

