小分子c-Met激酶抑制剂Foretinib的合成
赵培培, 张 帆, 王 刚
(锦州医科大学 药学院,辽宁 锦州 121001)
Foretinib(XL880),化学名为N-{3-氟-4-{6-甲氧基-7-[3-(4-吗啉)丙氧基]喹啉}-4-氧基-苯基}-N-(4-氟苯基)-2,2-二亚甲基丙二酰胺,是由美国Exelixis公司研发的一种对肝细胞生长因子(hepatocyte growth factor, HGF)和血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)具有双重抑制作用的小分子多靶点酪氨酸激酶抑制剂[1]。体外研究表明:Foretinib对Met和KDR的抑制作用最强,IC50值分别为0.40 nmol/L和0.86 nmol/L;对Ron、 KIT、 Flt-1/3/4、 PDGFR-β和Tie-2也具有特殊的抑制活性,但作用稍弱,对Ron、 KIT、 Flt-1、 Flt-3和Flt-4的IC50值分别为3.00 nmol/L、 6.70 nmol/L、 6.80 nmol/L、 3.60 nmol/L和2.80 nmol/L;对成纤维生长因子受体(fibroblast growth factor receptors, FGFR)和表皮生长因子受体(epidermal growth factor receptor, EGFR)几乎没有抑制活性[2-3]。目前,Foretinib对于头颈部癌、乳头状肾癌、肝细胞癌、胃癌和非小细胞肺癌等肿瘤的治疗处于不同的临床试验阶段[4-11]。此外,尚有临床前研究表明,Foretinib对食管腺癌、人胶质母细胞癌和卵巢癌等恶性肿瘤细胞具有显著的抑制作用[1, 12-13]。
目前,已有多篇文献报道了Foretinib的合成路线。文献[14]是以4-(3-卤代丙氧基)-3-甲氧基苯乙酮为原料,经硝化、与吗啉亲核取代、硝基还原、与甲酸乙酯环合、氯代、与2-氟-4-硝基苯酚醚化、硝基还原和与1-[(4-氟苯基)胺甲酰基]环丙烷-1-羧酸酰化反应制得目标化合物。文献[15]是以4′-羟基-3′-甲氧基苯乙酮(2)为原料,经与N-氯丙基吗啉醚化、硝化、硝基还原、与甲酸乙酯环合、与3,4-二氟硝基苯醚化、硝基还原以及与1-[(4-氟苯基)胺甲酰基]环丙烷-1-羧酸(2)酰化反应制得目标化合物,总收率为0.76%。与文献[15]相比,文献[16]仅调整了反应顺序,4′-羟基-3′-甲氧基苯乙酮先与1-溴-3-氯丙烷发生醚化反应,再进行硝化和吗啉亲核取代反应制得中间体5-甲氧基-4-[3-(4-吗啉基)丙基]氧基-2-硝基苯乙酮(5),后续反应步骤与文献[15]基本相同,总收率为4.56%。上述路线普遍存在原辅料价格昂贵、反应体系复杂、所用试剂种类较多、操作繁琐及收率低等缺点,不适合工业化生产。本文在参考已有合成路线的基础上,对Foretinib的合成路线和合成工艺进行了优化,路线见图1,以4′-羟基-3′-甲氧基苯乙酮为起始原料,经与1-溴-3-氯丙烷醚化、硝化、吗啉亲核取代、与N,N-二甲基甲酰胺二甲基缩醛缩合、还原环合、氯代和与2-氟-4-硝基苯酚醚化和硝基还原制得氨基化合物(10);另一方面,1,1-环丙二羧酸氯代后与4-氟苯胺反应生成化合物(12);最后,化合物10和化合物12发生酰化反应制得目标化合物Foretinib(1),反应总收率为26.06%,目标化合物纯度为99.40%。该路线原辅料价廉易购得,反应条件温和,操作及后处理简单,与已有路线相比总收率提高了5.71~34.29倍,更适合于大规模生产。

图1 Foretinib的合成路线
1 实验部分
1.1 仪器与试剂
MP50型超越熔点仪(温度未经校正);AVANCE III 400 MHz型核磁共振仪(CDCl3和DMSO-d6为溶剂,TMS为内标);TSQ质谱仪;日立L-2000型高相液相色谱仪。
所用试剂均为市售分析纯或化学纯。
1.2 合成
(1) 4-(3-氯丙氧基)-3-甲氧基苯乙酮(3)的合成
将5.00 g(30.09 mmol)4′-羟基-3′-甲氧基苯乙酮(2)溶解于10.00 mL的N,N-二甲基甲酰胺中,依次加入5.82 g碳酸钾(42.11 mmol)和0.25 g(1.51 mmol)碘化钾,室温搅拌30 min后,向上述反应液中滴加4.15 mL(42.09 mmol)1-溴-3-氯丙烷,继续室温反应8 h。在剧烈搅拌下,将反应液缓慢倒入冰水中,搅拌30 min,抽滤,用水洗涤滤饼,干燥,得白色固体7.11 g,收率97.41%, m.p.61.9~63.0 ℃;1H NMR(CDCl3, 400 MHz),δ: 7.56(d,J=5.6 Hz, 1H), 7.53(s, 1H), 6.92(d,J=5.6 Hz, 1H), 4.24(t,J=4.0 Hz, 2H), 3.92(s, 3H), 3.78(t,J=4.0 Hz, 2H), 2.57(s, 3H), 2.35~2.31(m, 2H)。
(2) 4-(3-氯丙氧基)-5-甲氧基-2-硝基苯乙酮(4)的合成
将5.00 g(20.60 mmol)化合物3溶解于10.00 mL乙酸酐中,将反应瓶置于冰浴中,控制反应温度≤2 ℃,在此温度下向反应液中缓慢滴加2.00 mL(28.89 mmol)浓硝酸,滴加过程控制温度≤10 ℃,滴加完毕,升温至室温反应30 min。在剧烈搅拌下,将上述反应液快速倒入冰水中,搅拌1 h,抽滤,干燥,得粗品,70.00%乙醇重结晶,得黄色针状晶体2.86 g,收率48.25%, m.p.67.3~69.2 ℃;1H NMR(CDCl3, 400 MHz),δ: 7.65(s, 1H), 6.76(s, 1H), 4.26(t,J=4.0 Hz, 2H), 3.96(s, 3H), 3.78(t,J=4.0 Hz, 2H), 2.50(s, 3H), 2.36~2.32(m, 2H)。
(3) 5-甲氧基-4-[3-(4-吗啉基)丙基]氧基-2-硝基苯乙酮(5)的合成
将5.00 g(17.38 mmol)化合物4溶解于20.00 mL甲苯中,然后依次加入3.60 g(26.05 mmol)碳酸钾和0.15 g(0.90 mmol)碘化钾,室温搅拌30 min后,向上述反应液中滴加6.06 mL(69.56 mmol)吗啉,滴加完毕,升温至回流反应13 h。待反应液冷却至室温后,减压浓缩反应液至干,向残留物中加入25.00 mL水,室温搅拌30 min,抽滤,用水洗涤滤饼,干燥,得黄色固体5.78 g,收率98.30%, m.p.93.8~94.7℃;1H NMR(CDCl3, 400 MHz),δ: 7.64(s, 1H), 6.75(s, 1H), 4.19(t,J=4.4 Hz, 2H), 3.96(s, 3H), 3.72(t,J=3.2 Hz, 4H), 2.53(t,J=4.4 Hz, 2H), 2.50(s, 3H), 2.47(s, 4H), 2.08~2.04(m, 2H); ESI-MS,m/z: 339.15{[M+H]+}。
(4) 1-{5-甲氧基-4-[3-(4-吗啉基)丙氧基]-2-硝基}苯基-3-二甲氨基-2-烯-1-丙酮(6)的合成
将5.00 g(14.78 mmol)化合物5和10.80 mL(81.30 mmol)N,N-二甲基甲酰胺二甲基缩醛依次加入到15.00 mL甲苯中,回流反应7 h。待反应液冷却至室温后刮壁,有固体析出,抽滤,用甲苯洗涤滤饼,干燥,得金黄色固体5.63 g,收率96.84%, m.p.149.7~150.5 ℃;1H NMR(CDCl3, 400 MHz),δ: 7.61(s, 1H), 6.84(s, 1H), 5.20(s, 1H), 4.17(t,J=4.4 Hz, 2H), 3.94(s, 3H), 3.73(t,J=3.2 Hz, 4H), 3.08(s, 3H), 2.85(s, 3H), 2.53(t,J=4.4 Hz, 2H), 2.47(s, 4H), 2.07~2.03(m, 2H); ESI-MS,m/z: 394.20{[M+H]+}。
(5) 6-甲氧基-7-[3-(4-吗啉基)丙氧基]-4-羟基喹啉(7)的合成
将4.27 g还原铁粉(76.25 mmol)加入到25.00 mL的80%乙醇中,滴加10滴浓盐酸,回流反应30 min。稍冷,向上述反应液中分批加入5.00 g(12.71 mmol)化合物6,继续回流反应2 h。趁热抽滤,滤饼用95.00%乙醇继续回流20 min后,趁热抽滤,重复2次。合并滤液,减压浓缩滤液至干。向残留物中加入50.00 mL水,用饱和碳酸钠溶液调节pH至9,抽滤,滤饼用水打浆,抽滤,用水洗涤滤饼,干燥,得黄绿色固体3.60 g,收率88.98%, m.p.84.2~86.2 ℃;1H NMR(CDCl3, 400 MHz),δ: 11.48(s, 1H), 7.70(s, 1H), 7.61(d,J=4.4 Hz, 1H), 6.98(s, 1H), 6.24(d,J=4.8 Hz, 1H), 4.09(t,J=4.0 Hz, 2H), 3.91(s, 3H), 3.68(t,J=2.8 Hz, 4H), 2.49(t,J=4.8 Hz, 2H), 2.43(s, 4H), 2.06~2.03(m, 2H); ESI-MS,m/z: 319.17{[M+H]+}。
(6) 4-氯-6-甲氧基-7-[3-(4-吗啉基)丙氧基]喹啉(8)的合成
将5.00 g(15.70 mmol)化合物7分批加入到25.00 mL三氯氧磷中,滴加3滴N,N-二甲基甲酰胺,回流反应1 h。反应液冷却至室温后,减压浓缩反应液至干,在剧烈搅拌下,将残留物倒入碎冰中,用饱和碳酸钠溶液调节pH至9,抽滤,滤饼用水打浆,干燥,得灰白色固体4.94 g,收率93.39%, m.p.107.4~108.2 ℃;1H NMR(CDCl3, 400 MHz),δ: 8.57(d,J=4.8 Hz, 1H), 7.44(s, 1H), 7.40(s, 1H), 7.35(d,J=4.8 Hz, 1H), 4.27(t,J=6.8 Hz, 2H), 4.04(s, 3H), 3.73(t,J=4.4 Hz, 4H), 2.57(t,J=6.8 Hz, 2H), 2.48(s, 4H), 2.16~2.09(m, 2H); ESI-MS,m/z: 337.13{[M+H]+}。
(7) 6-甲氧基-7-[3-(4-吗啉基)丙氧基]-4-(2-氟-4-硝基苯基)喹啉(9)的合成
将5.00 g(14.84 mmol)化合物8和3.03 g(19.29 mmol)的2-氟-4-硝基苯酚依次加入到25.00 mL氯苯中,回流反应6 h,待反应液冷却至室温后,减压浓缩反应液至干,向残留物中加入50.00 mL水,用1.00 mol/L氢氧化钠溶液调节pH至10,室温搅拌1 h,抽滤,滤饼用水打浆,干燥,得淡黄色固体6.07 g,收率89.38%, m.p.135.4~137.5 ℃;1H NMR(CDCl3, 400 MHz),δ: 8.58(d,J=5.2 Hz, 1H), 8.19(dd,J=9.6 Hz, 2.4 Hz, 1H), 8.15~8.12(m, 1H), 7.48(s, 1H), 7.43(s, 1H), 7.34(t,J=8.0 Hz, 1H), 6.55(d,J=5.2 Hz, 1H), 4.29(t,J=6.4 Hz, 2H), 4.02(s, 3H), 3.73(t,J=4.4 Hz, 4H), 2.58(t,J=7.2 Hz, 2H), 2.49(s, 4H), 2.18~2.11(m, 2H); ESI-MS,m/z: 458.17{[M+H]+}。
(8) 6-甲氧基-7-[3-(4-吗啉基)丙氧基]-4-(2-氟-4-氨基苯基)喹啉(10)的合成
将2.45 g(43.72 mmol)还原铁粉加入到25.00 mL的95%乙醇中,滴加浓盐酸10滴,回流反应30 min。稍冷,向上述反应液中分批加入5.00 g(10.93 mmol)化合物9,回流反应1 h。趁热抽滤,滤饼用95.00%乙醇继续回流20 min后,趁热抽滤,重复2次。合并滤液,待滤液冷却至室温,抽滤,干燥,得浅棕色固体。滤液减压浓缩至干,向残留物中加入20.00 mL水,用饱和碳酸钠溶液调节pH至8,抽滤,干燥,得浅粉色固体,合并2次所得固体,共4.29 g,收率91.82%, m.p.170.5~171.5 ℃;1H NMR(CDCl3, 400 MHz),δ: 8.47(d, 1H,J=5.2 Hz), 7.58(s, 1H), 7.42(s, 1H), 7.04(t,J=8.4 Hz, 1H), 6.56(d,J=11.6 Hz, 1H), 6.51(d,J=8.4 Hz, 1H), 6.40(d,J=4.8 Hz, 1H), 4.27(t,J=6.4 Hz, 2H), 4.04(s, 3H), 3.83(s, 2H), 3.73(s, 4H), 2.58(t,J=6.8 Hz, 2H), 2.49(s, 4H), 2.15~2.12(m, 2H); ESI-MS,m/z: 428.20{[M+H]+}。
(9) 1-[(4-氟苯基)胺甲酰基]环丙烷-1-羧酸(12)的合成
将5.00 g(38.43 mmol)1,1-环丙二羧酸(11)加入到25.00 mL二氯甲烷中,将反应瓶置于冰浴中,控制温度≤2 ℃,在此温度下向反应液中缓慢滴加5.86 mL(42.27 mmol)三乙胺,滴加过程控制温度≤5 ℃,滴加完毕,冰浴反应30 min。向上述反应液中缓慢滴加3.07 mL(42.27 mmol)氯化亚砜,滴加过程控制温度≤5 ℃,滴加完毕,冰浴反应2 h。再向反应液中缓慢滴加4.00 mL(42.27 mmol)4-氟苯胺,滴加完毕,冰浴反应3 h。向上述反应液中加入50.00 mL的10%(w/v)氢氧化钠溶液,分离有机相,用10%(w/v)氢氧化钠溶液萃取(3×10.00 mL),弃去有机相。合并水相,
用二氯甲烷(2×10.00 mL)洗涤。水相用2.00 mol/L盐酸溶液调节pH至2~3,抽滤,干燥,得白色固体5.62 g,收率65.52%, m.p.181.8~184.4 ℃;1H NMR(DMSO-d6, 400 MHz),δ: 10.66(s, 1H), 7.61(dd,J=5.6 Hz, 2.4 Hz, 2H), 7.15(t,J=6.0 Hz, 2H), 1.41(s, 4H); ESI-MS,m/z: 222.06{[M-H]-}。
(10) Foretinib(1)的合成
将3.13 g(14.02 mmol)化合物12、 3.13 g(23.37 mmol)1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和2.37 g(17.54 mmol)1-羟基苯并三唑一水合物加入到25.00 mL二氯甲烷中,室温反应30 min,然后将5.00 g(11.70 mmol)化合物10加入上述反应液中,室温反应12 h。反应完毕,抽滤,弃去滤饼,滤液用50.00 mL水稀释,室温搅拌1 h,分离有机相,水相用二氯甲烷萃取(3×10.00 mL),合并有机相,依次用饱和碳酸氢钠溶液(3×10.00 mL)洗涤,水(3×10.00 mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂,干燥,得淡黄色固体6.32 g,收率85.41%, m.p.99.3~101.1 ℃;1H NMR(DMSO-d6, 400 MHz),δ: 10.40(s, 1H), 10.01(s, 1H), 8.47(d,J=6.8 Hz, 1H), 7.93~7.88(m, 1H), 7.65(dd,J=11.6 Hz, 6.8 Hz, 2H), 7.53(s, 2H), 7.45~7.39(m, 2H), 7.16(t,J=11.6 Hz, 2H), 6.42(d,J=6.8 Hz, 1H), 4.20(t,J=8.0 Hz, 2H), 3.95(s, 3H), 3.60(t,J=5.6 Hz, 4H), 2.51~2.41(m, 6H), 2.01~1.96(m, 2H), 1.48(s, 4H); ESI-MS,m/z: 633.25{[M+H]+}; 纯度99.40%[色谱柱:Venusil XBP C18, 4.6×250 mm×5 μm,柱温:30 ℃,检测波长:241 nm,流动相:乙腈∶醋酸铵溶液(pH=5.2)=50 ∶50,V∶V]。
2 结果与讨论
2.1 化合物4的合成
化合物3的结构中2-位、3-位和6-位均可发生硝化反应,但反应难易程度不同。为了得到2-位的单硝化产物,从反应收率、产物纯度和操作是否简便等角度出发,本文分别考察了不同的反应溶剂、硝化试剂及反应温度对硝化反应的影响,结果如表1所示。当以乙酸酐为反应溶剂,浓硝酸为硝化试剂25 ℃反应时,反应时间短,仅为0.5 h,收率较高。且反应结束后,将反应液倒入冰水中可直接得到固体产物,无需萃取,操作简便。本文还对浓硝酸的用量进行了优化,通过TLC监测发现,当浓硝酸的用量为1.1 eq.时,即使延长反应时间仍有原料剩余;当浓硝酸的用量≥1.2 eq.时,化合物3可以全部转化为化合物4。其中,浓硝酸用量为1.4 eq.,收率最高可达48.25%。
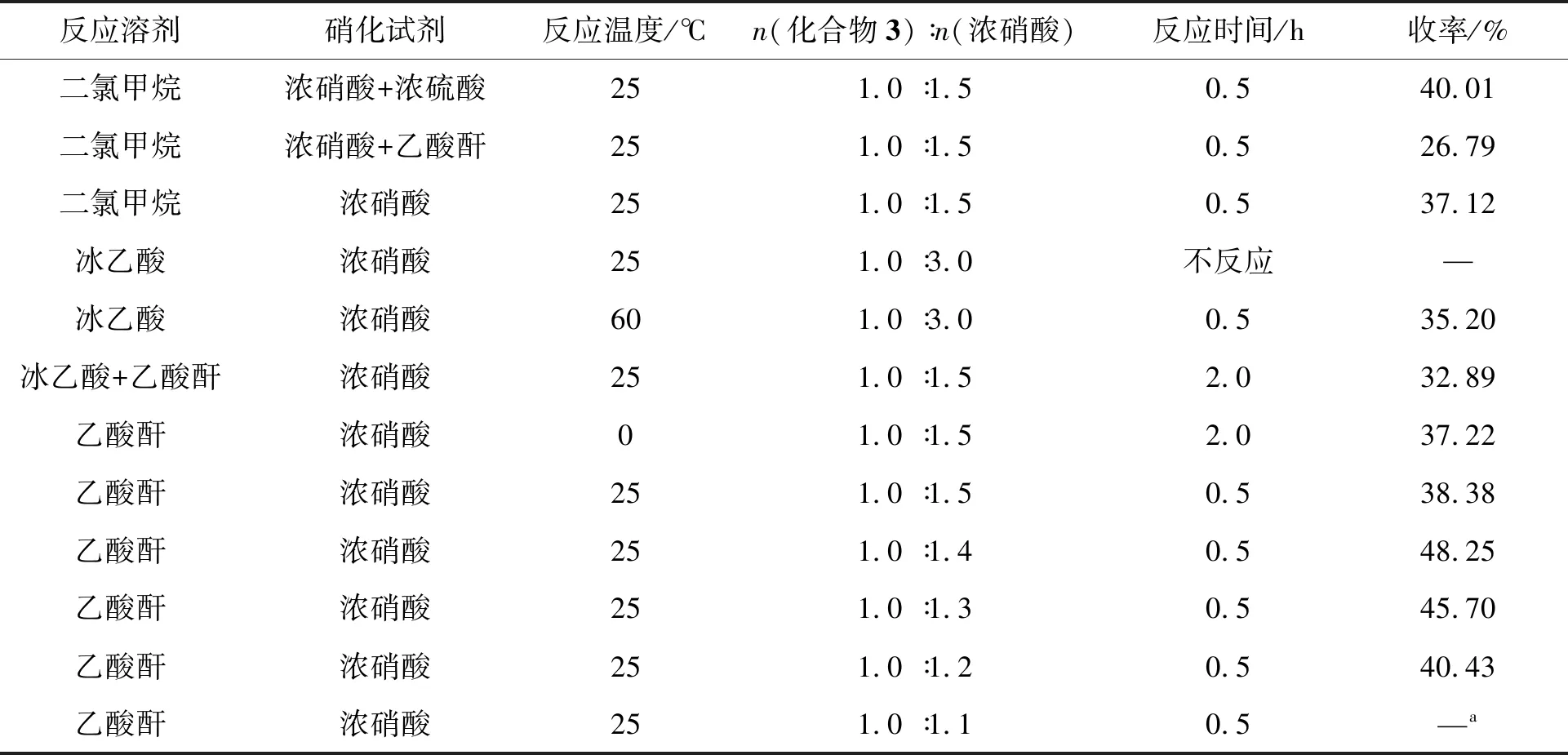
表1 硝化试剂、反应溶剂和反应温度对硝化反应结果的影响
2.2 化合物7的合成
文献[14-16]报道的合成4-羟基喹啉化合物7的方法一般是:硝基化合物5在钯/碳或铁/氯化铵作用下还原为氨基,然后再与甲酸乙酯在醇钠的作用下环合形成喹啉环。文献[17]制备喹啉环时,选择邻硝基苯乙酮化合物为原料,首先羰基α-位的甲基与N,N-二甲基甲酰胺二甲基缩醛发生缩合反应得到1-苯基-3-二甲氨基-2-烯-1-丙酮化合物,然后该化合物结构中的硝基被还原为氨基后,发生自身环合反应形成喹啉环。本文采用上述方法由化合物5经与N,N-二甲基甲酰胺二甲基缩醛缩合和还原环合2步反应合成得到化合物7,反应历程见图2, 2步反应总收率可达86.17%,比文献[15-16]分别提高了30.81%、 24.82%,而且该方法反应条件温和,使用试剂种类更少。

图2 化合物7的合成机理
2.3 化合物9的合成
化合物8与2-氟-4-硝基苯酚反应制备化合物9为醚化反应。醚化反应一般是在非质子性溶剂中,有机碱或无机碱的存在下进行的。2-氟-4-硝基苯酚结构中的硝基和氟原子都是吸电子基团,使氧原子的电子云密度降低,亲核性下降,酚羟基的亲核取代反应变得困难,因此文献[14-16]中使用了碱性较强的碳酸铯和2,6-二甲基吡啶。由于反应物和产物在高温条件下都比较稳定,可以通过升高反应温度加速反应的进行,分别尝试了N,N-二甲基甲酰胺、二甲基亚砜、二苯醚、二甲苯和氯苯作为反应溶剂,在140 ℃左右反应。研究表明,当以氯苯和二甲苯为反应溶剂时,无需碱的参与,醚化反应也可顺利进行,而且反应收率较高,均大于85.00%,从生产成本考虑,选择价格较为便宜的氯苯作为醚化反应溶剂。
2.4 化合物1的合成
化合物10与化合物12反应生成化合物1的本质是芳氨基的酰化反应。上述酰化反应可以由羧基化合物12首先经氯代反应转化为酰氯,再与氨基化合物10在三乙胺存在下发生酰化反应。通过TLC监测发现,该方法会在酰化过程中产生多个杂质,且极性与目标化合物相近,增加了分离纯化的难度。将三乙胺更换为4-二甲氨基吡啶也不能达到理想的效果。酰化反应也可以由氨基化合物10和羧基化合物12在多肽缩合剂的作用下直接反应。本文尝试了由与化合物10和化合物12在缩合剂1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和催化剂1-羟基苯并三唑一水合物的作用下制备目标化合物1。通过TLC监测发现,该方法没有杂质生成,并且1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和1-羟基苯并三唑一水合物水溶性较好,易于除去,收率和目标化合物的纯度都较高。
3 结论
本文设计的Foretinib的合成路线选择价廉易得的4′-羟基3′-甲氧基苯乙酮(2)作为起始原料,经过醚化、硝化、亲核取代、缩合、还原环合和氯代等9步反应制备得到Foretinib(1),总收率为26.06%,纯度为99.40%。本合成路线反应条件温和,操作简单,后处理简便,各步反应收率均较高,为Foretinib的上市销售和工业化生产奠定了基础。

