卵泡液中sRAGE、Vit D和TNF-α的含量与卵母细胞质量的相关性研究
许嘉绵,毛丽华,林春丽,熊萍,黄吴键,刘芸*
(1.福建医科大学福总临床医学院,福州 350025;2.中国人民解放军联勤保障部队第九○○医院生殖医学中心,福州 350025)
由始基卵泡发育为成熟卵泡的过程中,卵泡受体内外多种因素影响。体外因素如环境、饮食、精神状态等,体内因素包括下丘脑-垂体-卵巢轴的作用、卵冠丘复合物的旁分泌因子作用以及由颗粒细胞、卵泡膜细胞分泌的代谢物组成的卵泡液的影响等[1-3]。卵母细胞质量对胚胎发育潜能起重要作用,从而进一步影响胚胎种植和临床妊娠率。在辅助生殖助孕过程中,胚胎形态学评估是目前筛选可移植胚胎的主要方法,但其有效性仍然不足,如能在卵母细胞阶段对其质量进行评估,将增加胚胎筛选指标,提高对胚胎着床能力判断的准确性。卵泡液(FF)代表着卵母细胞及颗粒细胞生长的环境,可能对卵母细胞质量产生影响[4]。在人体内,肿瘤坏死因子-α(TNF-α)和可溶性晚期糖基化终产物受体(sRAGE)主要介导炎症反应和氧化应激的发生,维生素D(Vit D)主要参与机体钙磷代谢的稳态调节,研究发现这些物质都参与到女性生殖系统的功能调节活动中,且能在卵泡液内被检测到,可能对卵母细胞发育有调节作用[5-7]。本研究通过检测单个卵母细胞FF中sRAGE、Vit D和TNF-α的含量,探讨其与卵母细胞及胚胎质量的关系,为临床不孕患者的诊疗提供新思路。
资料和方法
一、研究对象
选择2021年6月至2022年8月于联勤保障部队第九○○医院生殖中心行IVF-ET治疗的不孕女性(12例)的81个卵母细胞的FF样本。该研究符合赫尔辛基宣言。该研究已通过医院伦理委员会审查,所有研究对象均签署知情同意书。纳入标准:输卵管因素不孕患者且年龄<38岁,基础窦卵泡数5~15个、获卵数3~15个,基础促卵泡素≤12 U/L、体质量指数(BMI)为17~25 kg/m2。排除标准:多囊卵巢综合征(PCOS);合并卵巢手术史、子宫畸形、子宫内膜异位症、卵巢早衰等生殖系统疾病;合并内分泌、慢性代谢性疾病;遗传性疾病史;男方畸形精子症、逆行射精症、阻塞性无精子症等。
二、研究方法
1.促排卵方案:所有患者均接受拮抗剂灵活方案进行控制性促排卵(COH),促性腺激素(Gn)使用注射用重组人促卵泡激素(果纳芬,默克,意大利),用量根据患者年龄、BMI及内分泌激素水平进行调整。当至少有1/3的主导卵泡直径≥18 mm时注射绒毛膜促性腺激素(HCG,艾泽,默克,意大利)进行扳机。
2.样本收集与测定:HCG扳机后36~38 h,在阴道超声引导下经阴道后穹隆穿刺取卵,收集卵母细胞用于IVF后剩余单个卵泡液放置于单独的试管内,避免冲洗液和血液污染卵泡内容物,2 000 r/min离心10 min,取上清液置于-80℃冰箱避光保存待测。
3.二维超声测量卵泡直径:选取该卵泡的最大切面,量取最大长径和其垂直平分线长度横径,取两者平均值并记录。
4.FF体积测量:胚胎实验室的工作人员在显微镜下收集卵母细胞后,将剩余FF倒入5 ml带刻度的无菌离心管中,根据刻度进行测定。
5.卵泡液中sRAGE、Vit D、TNF-α含量测定:均采用ELISA(上海酶联生物)法,检测步骤为:样本孔中加入50 μl待测样本及检测抗体,用封板膜封住反应孔,60 min后将孔中溶液甩净,使用缓冲液进行浸洗,烘干残液,重复洗涤5次;接着加入底物TMB,15 min后加入终止溶液;最后用酶标仪(SPECTRO Star,德国)在450 nm波长依次测量测量各孔的光密度(OD值),计算样本浓度。
6.卵母细胞及胚胎质量评估与分组:81个卵泡中有72个成熟卵母细胞(MⅡ),将其归为成熟卵母细胞组,其余9个归为未成熟卵母细胞组(GV和MI)[8]。胚胎体外培养3 d后,按Peter卵裂期评分系统对胚胎进行评估[9],其中Ⅰ级:卵裂球大小均匀,形状规则,透明带完整,胞质均匀无颗粒现象,碎片<10%;Ⅱ级:卵裂球大小稍不均匀,形状稍不规则,胞质有颗粒现象,碎片<20%;共有61个卵母细胞发育到6~10个卵裂球的Ⅰ、Ⅱ级胚胎[5],将其归于优质胚胎组(n=61),其余为非优质胚胎组(n=20)。有20个胚胎进行新鲜胚胎移植,剩余61个胚胎在体外继续培养至第5~6天,最终形成34个囊胚,按Gardner囊胚期评分系统对囊胚进行评估[10],先根据囊胚的扩张和孵出程度将囊胚分成1~6级,对于3-6级囊胚再根据内细胞团(ICM)和滋养外胚层(TE)细胞进行评分;其中有26个胚胎发育至3期及3期以上、ICM及TE细胞均为B级及以上的囊胚,将其归为优质囊胚组(n=26),其余为非优质囊胚组(n=8)。
三、统计学分析
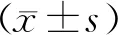
结 果
一、各组卵泡形态和FF中sRAGE、Vit D和TNF-α含量水平检测结果
1.按卵母细胞成熟度分组比较:结果显示,成熟卵母细胞组的卵泡直径、FF体积、FF中sRAGE和Vit D含量显著高于不成熟卵母细胞组(P均<0.05);成熟卵母细胞组的TNF-α水平显著低于不成熟卵母细胞组,差异具有显著性(P<0.05)(表1)。

表1 成熟卵母细胞组与不成熟卵母细胞组间各指标的比较(-±s)
2.按胚胎发育评分分组比较:结果显示,优质胚胎组FF中sRAGE、Vit D含量显著高于非优质胚胎组(P均<0.05),优质胚胎组的TNF-α含量显著低于非优质胚胎组(P<0.05);优质胚胎组卵泡直径、FF体积与非优质胚胎组差异不无统计学意义(P均>0.05)(表2)。

表2 优质胚胎组与非优质胚胎组间各指标的比较(-±s)
3.按囊胚发育情况分组比较:结果显示,优质囊胚组FF中sRAGE、Vit D含量显著高于非优质囊胚组(P均<0.05),优质囊胚组TNF-α含量显著低于非优质囊胚组(P<0.05);优质囊胚组卵泡直径、FF体积与非优质囊胚组差异不具有显著性(P均>0.05)(表3)。

表3 优质囊胚组与非优质囊胚组间各指标的比较(-±s)
二、FF中sRAGE、Vit D和TNF-α水平的相关分析
FF中sRAGE水平与卵母细胞成熟度、胚胎发育情况、囊胚发育情况等指标均有正相关关系(r分别为0.247、0.257、0.385,P均<0.05);FF中Vit D水平与卵母细胞成熟度、胚胎发育情况等指标均呈正相关性(r分别为0.242、0.241,P均<0.05),而与囊胚发育情况呈正相关,但无统计学意义(r为0.299,P>0.05);FF中TNF-α水平与卵母细胞成熟度、胚胎发育情况、囊胚发育情况等指标均有负相关关系(r分别为-0.311、-0.234、-0.417;P均<0.05)(表4、5、6)。

表4 卵泡液sRAGE水平与临床指标相关性

表5 卵泡液维生素D水平与临床指标相关性

表6 卵泡液TNF-α水平与临床指标相关性
FF中sRAGE与Vit D水平显著正相关(r=0.434,P<0.001);FF中sRAGE、Vit D水平与TNF-α水平显著负相关(r分别为-0.623、-0.578,P<0.001)(图1、2、3)。
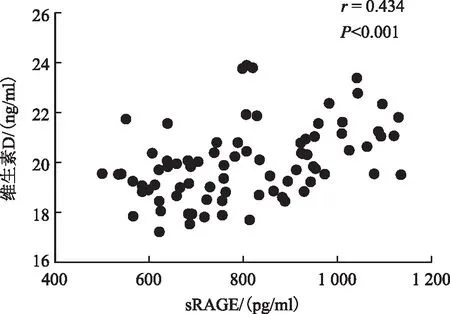
图1 卵泡液中sRAGE水平与维生素D水平的相关性
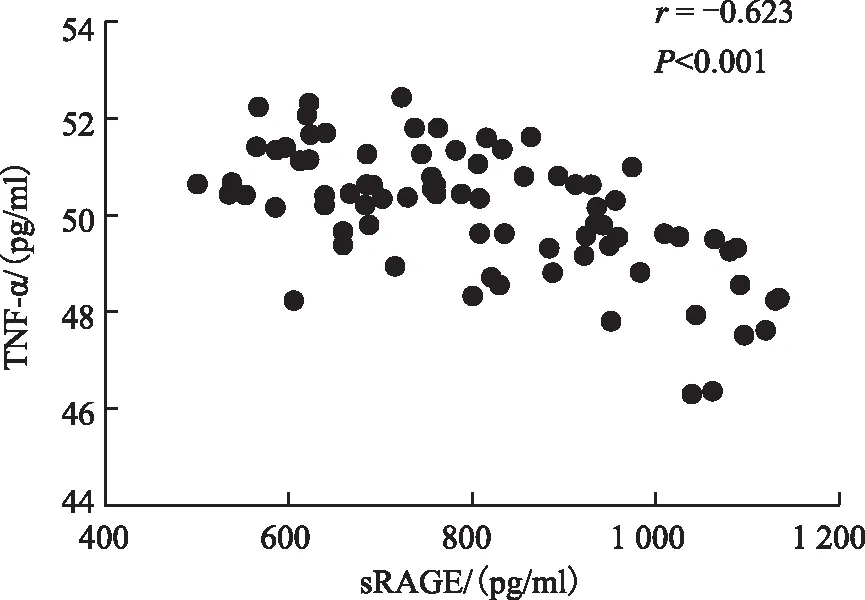
图2 卵泡液中sRAGE水平与TNF-α水平的相关性
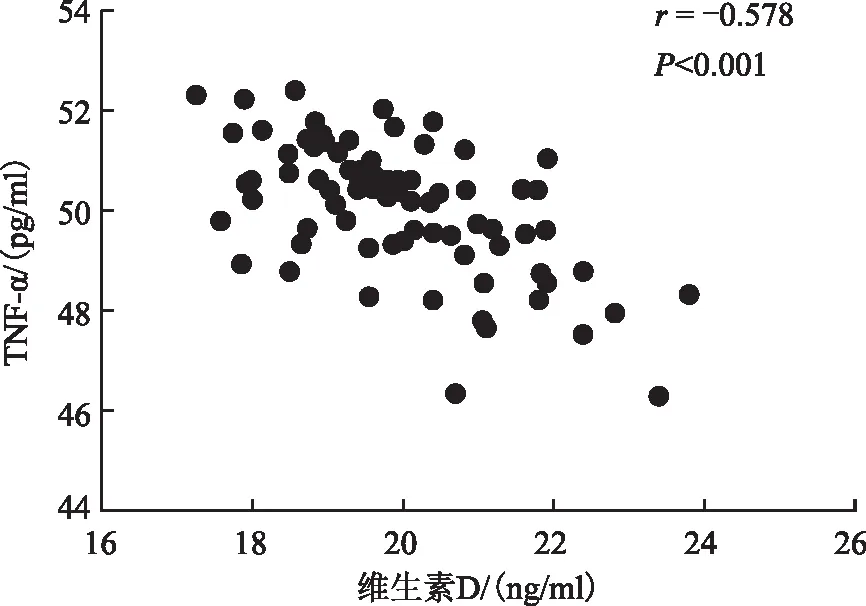
图3 卵泡液中维生素D水平与TNF-α水平的相关性
讨 论
在辅助生殖助孕过程中,形态学评估是筛选可移植胚胎的主要方法,但其存在着某些局限性,如胚胎学者的主观性、静态的胚胎形态学观察、多次将胚胎从培养箱取出观察会改变培养环境等,故形态看起来正常的胚胎可能并不正常[11-12]。因此,如果能够在卵母细胞阶段对其质量进行评估,将增加胚胎筛选指标,提高对胚胎着床能力判断的准确性。卵泡液(FF)中含颗粒细胞、卵泡膜细胞分泌的代谢物以及血浆通过血液卵泡屏障滤过的小分子物质,其代表着卵母细胞及颗粒细胞生长的环境,已有多项研究发现FF中的某些物质可以反映卵母细胞质量、受精能力及随后的胚胎发育潜能[3-4,13]。
sRAGE可通过结合循环的AGEs竞争性抑制AGE-RAGE相互作用和下游促炎症信号,保护细胞组织等免受RAGE-AGEs系统所介导的损伤反应[14]。Takahashi等[5]研究发现,胚胎形态发育良好的卵母细胞卵泡液中的AGE/sRAGE、IL-6和IL-8水平和卵泡颗粒细胞中转录因子4(ATF4)、IL-6和IL-8的mRNA表达显著低于胚胎形态发育不良的卵母细胞;在小干扰RNA(siRNA)耗尽ATF4后,使用牛血清白蛋白(BSA)处理培养的人颗粒细胞,颗粒细胞中IL-6和IL-8的mRNA表达效应减弱。提示AGEs在卵泡中的积累可通过激活卵泡微环境中的ATF4触发炎症,从而降低卵母细胞发育能力。Wang等[15]通过往颗粒细胞培养皿中加入不同水平的sRAGE,研究发现sRAGE在颗粒细胞中通过调节P-ERK和AP-1信号传导减轻了炎症反应。肿瘤坏死因子-α是由单核细胞及巨噬细胞等产生的炎症细胞因子[16]。研究发现TNF-α可以影响卵巢功能、胚胎的附着、滋养层的发育和胎盘细胞增殖等,在女性生殖健康中扮演着重要角色[17-18]。
本研究观察到,卵泡液中sRAGE水平在成熟卵母细胞组、优质胚胎组、优质囊胚组中显著升高(P均<0.05),且与各指标均呈正相关关系(r分别为0.247、0.257、0.385;P均<0.05);而TNF-α水平在成熟卵母细胞组、优质胚胎组、优质囊胚组中显著降低(P均<0.05),且与各指标均呈负相关关系(P均<0.05);同时FF中sRAGE水平与TNF-α水平明显负相关(r为-0.623;P<0.001)。本研究与之前大多数学者们的研究结果相一致,炎症效应会影响卵母细胞及胚胎的发育,而sRAGE作为保护因子,对卵母细胞及胚胎发育具有一定的有利作用,但其具体的调节机制还有待进一步研究。
一项横断面观察研究发现Vit D与囊胚的发育有密切关系,人体内足够的Vit D可增加获得更多数目及更高质量囊胚的概率[19]。Chen 等[20]对377例不孕患者进行病例对照研究发现,血清Vit D水平与白细胞介素6(IL-6)水平呈显著负相关,而Vit D缺乏和高水平IL-6是输卵管性不孕的危险因素,考虑Vit D可能通过抑制IL-6的产生来降低不孕症的风险。进一步研究发现,Vit D能够通过MAPK/NF-κB、ERK信号通路下调TNF-α的表达[21-23]。此外,研究发现补充外源性Vit D可以增加FF中的sRAGE水平[24-25],Vit D对RAGE的抑制或刺激作用由各种信号通路介导,包括MAPK/NF-κB、ADAM10/MMP9等[26-27]。
本研究观察到,FF中Vit D水平在成熟卵母细胞组、优质胚胎组、优质囊胚组中显著升高(P均<0.05),且与成熟卵母细胞、优质胚胎呈正相关关系(r分别为0.242、0.241;P均<0.05);FF中Vit D与TNF-α水平明显负相关(r为-0.578;P<0.001),与sRAGE水平明显正相关(r为0.434;P<0.001)。本研究与之前大多数学者们的研究结果相一致,Vit D与卵母细胞发育密切相关。此外,本研究发现sRAGE与Vit D、TNF-α之间关系密切,对于行IVF助孕治疗的不孕患者,可能通过补充AGEs抑制剂、Vit D等外源性物质来改善卵母细胞所处的炎性微环境,从而改善卵母细胞质量及临床妊娠结局,但其具体机制还有待进一步研究验证。
本研究通过检测单个卵泡直径、体积,FF中sRAGE、Vit D及TNF-α水平以及相应卵母细胞的发育能力,发现胚胎发育良好的卵母细胞的FF中具有更高水平的sRAGE、Vit D和更低水平的TNF-α,提示适当的卵泡微环境对于卵泡健康至关重要。因此,在不孕患者的临床诊疗中,选择具有发育潜能的胚胎,除了依据胚胎形态学评分外,还可以加上卵泡液中sRAGE、Vit D及TNF-α水平的数据,可能对提高IVF临床妊娠率及不孕患者的诊疗提供更多帮助。

