LPS-RS、mNGF对致痫幼鼠保护性研究及TRX、NSE监测
陈冬湄
福建省泉州市儿童医院 362000
癫痫是一种以反复抽搐为表现形式的慢性脑部疾病,在儿童神经系统疾病中非常常见,其原因多样复杂,发病机制复杂,目前大部分国内外学者较认可的说法是癫痫发作的过程出现了脑神经元过度的同步化放电,反复发作,从而引起慢性的脑功能损伤。在可能导致癫痫的各种机制中,自由基的产生起着至关重要的作用,近年来多个研究表明[1],癫痫的发作伴发着自由基的产生,氧化应激被认为是癫痫脑损伤的发病机制之一。本研究采用了PTZ点燃的慢性癫痫幼鼠作为实验模型,分别给予LPS-RS与mNGF对PTZ点燃的慢性癫痫幼鼠进行干预,通过与正常对照组比较血清及海马TRX、NSE的表达差异,从而探讨LPS-RS、mNGF对其表达产生的影响及作用机制,并比较mNGF与LPS-RS对癫痫相关脑神经损伤保护作用的差异。
1 材料与方法
1.1 实验材料
1.1.1 实验动物。清洁级Wistar雄性幼鼠[购自Shanghai SLAC Laboratory Animal Co.,Ltd,许可证号:SCXK(沪)2017-0005],共130只,日龄21d,体质量50~65g。
1.1.2 实验药品。PTZ:美国Sigma公司,生产批号:MKCC1690;LPS-RS:美国invivogen公司,生产批号:RLP-39-02;mNGF:恩经复,厦门未名生物医药有限公司,生产批号:20160311;显影定影试剂:中国江苏凯基生物科技发展有限公司,生产批号:KGP116;rabbit anti-GAPDH(10B8):中国江苏凯基生物科技发展有限公司生产批号:KGAA002;羊抗兔IgG-HRP:中国江苏凯基生物科技发展有限公司,生产批号:KGAA35;大鼠TRX酶联免疫试剂盒、大鼠NSE酶联免疫试剂盒:包括封板膜,密封袋,酶标包被板1x96长期-20℃,标准品(冻干粉),标准品/样品稀释液,生物素抗原冻干粉,亲和素-HRP浓缩液,显色剂A,显色剂B,终止液,浓缩洗涤液等:上海朗顿生物科技有限公司,生产批号:S20180318MY。
1.1.3 仪器及设备。高速冷冻离心机:美国Thermo Sorvall ST 16R;37℃恒温培养箱:上海一恒THZ-100;ELISA酶标仪:美国MD CMAXPLUS;洗板机:拜尔PR510;pH计:美国OHAUS STARTER 2C;分析天平:中国精密分析天平JA3003。
1.2 建立动物模型
1.2.1 分组前准备。实验所使用的130只清洁级Wistar雄性大鼠幼鼠置于实验动物中心隔离检疫室中检疫1周。在检疫期间,检疫室的室内温度维持在22~26℃,相对湿度40%~60%,12/12h昼夜照明变化,幼鼠均可自由进食饲料和水。经1周检疫后无幼鼠死亡,将Wistar雄性大鼠幼鼠转移至屏障环境中。
1.2.2 实验分组。 使用随机数表法将Wistar雄性大鼠幼鼠随机分为4组:A组(空白对照组,n=31只)、B组(EP癫痫组,n=33只)、C组(mNGF组,n=33只)、D组(LPS-RS组,n=33只)
1.2.3 使用PTZ建立慢性癫痫幼鼠模型。建模期间,A组幼鼠给予等剂量9g/L生理盐水,B、C、D组幼鼠每日均给予40mg/kg(质量浓度10g/L)PTZ。给药时间:8:00—10:00am;给药方式:腹腔注射。每次给药后均观察幼鼠活动1h,记录幼鼠的行为学表现。幼鼠癫痫发作程度的分级参照Racine分级[2]标准判定(Ⅳ级及其以上癫痫发作即视为大发作):慢性点燃成功标准:幼鼠出现连续5次Ⅱ级以上癫痫发作即提示点燃成功,慢性点燃成功后PTZ的给药频率改为2~3d给药1次以维持点燃14d。
1.2.4 干预方法。A组:每日给予幼鼠相同剂量9g/L盐水,不给予干预剂;B组:每日给予幼鼠相同剂量9g/L盐水,不给予干预剂;C组:每日给予幼鼠mNGF 4μg/kg;D组:每日给予幼鼠LPS-RS 0.1mg/kg。干预时间:8:00—10:00am,连续给药7d;干预方式:腹腔注射。
1.2.5 取材。在最后一次干预后于A、B、C、D 4个小组每组随机取27只幼鼠进行标本采集,每组于3h、24h、72h三个时段各随机采集9个标本。取材流程:麻醉前禁食8~12h,腹腔注射2%戊巴比妥钠(40mg/kg)。麻醉幼鼠。从幼鼠腹主动脉抽取4ml血液至一次性抗凝血清管,静置10min后,使用高速冷冻离心机(3 000r/min)离心15min,取标本上清液置于-80℃冰箱保存备用。获取血液标本后,立刻予颈椎脱臼法处死幼鼠,将幼鼠脑组织置于冰台上,使用高温180℃可灭RNA酶的手术刀及眼科剪沿矢状裂将脑组织分离,快速游离出海马体,置于去RNA酶的冻存管中,放入液氮中速冻1min,并储存于-80℃超低温冰箱待ELISA检测使用。
1.3 ELISA检测(竞争法) 采用ELISA法(按照试剂盒说明书进行)检测血清及海马TRX及NSE的浓度。
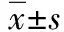
2 检测结果
2.1 各组幼鼠血清不同时间点TRX浓度比较 结合表1结果分析:经过14d慢性癫痫点燃组(B、C、D)3h血清TRX浓度较A组迅速显著升高。A组在3个时间点血清TRX浓度最低,与B、C、D组相比均有统计学差异(P均<0.05);B组在3个时间点血清TRX浓度最高,与A、C、D组相比均有统计学差异(P<0.05);在每个时间点C组血清TRX浓度均高于D组,且C、D组血清TRX均介于A、B组之间,差异有统计学意义(P均<0.05)。

表1 各组血清不同时间点TRX浓度比较
2.2 各组幼鼠海马不同时间点TRX浓度比较 结合表2结果分析:经过14d慢性癫痫点燃组(B、C、

表2 各组海马不同时间点TRX浓度比较
D)3h海马TRX浓度较A组迅速显著升高。A组在3个时间点海马TRX浓度最低,与B、C、D组相比均有统计学差异(P均<0.05);B组在3个时间点海马TRX浓度最高,与A、C、D组相比均有统计学差异(P<0.05);在每个时间点C组海马TRX浓度均高于D组,且C、D组海马TRX均介于A、B组之间,差异有统计学意义(P均<0.05)。
2.3 各组幼鼠血清不同时间点NSE浓度比较 结合表3结果分析:经过14d慢性癫痫点燃组(B、C、D)3h血清NSE浓度较A组迅速显著升高。A组在3个时间点血清NSE浓度最低,与B、C、D组相比均有统计学差异(P均<0.05);B组在3个时间点血清NSE浓度最高,与A、C、D组相比均有统计学差异(P<0.05);在每个时间点C组血清NSE浓度均高于D组,且C、D组血清NSE浓度均介于A、B组之间,差异有统计学意义(P均<0.05)。

表3 各组血清不同时间点NSE浓度比较
2.4 各组幼鼠海马不同时间点NSE浓度比较 结合表4结果分析:经过14d慢性癫痫点燃组(B、C、D)3h海马NSE浓度较A组迅速显著升高。A组在3个时间点海马NSE浓度最低,与B、C、D组相比均有统计学差异(P均<0.05);B组在3个时间点海马NSE浓度最高,与A、C、D组相比均有统计学差异(P<0.05);在每个时间点C组海马NSE浓度均高于D组,且C、D组海马NSE浓度均介于A、B组之间,差异有统计学意义(P均<0.05)。

表4 各组海马不同时间点NSE浓度比较
3 讨论
3.1 NSE在癫痫治疗监测中的作用 烯醇化酶是一种二聚体糖酵解酶,有 3 种已知亚基类型和 5 种同工酶(αα、ββ、γγ、αβ 和 αγ),最初这些同工酶被认为仅存在于神经元中[3],然而,随后被发现神经内分泌细胞和一些非神经元和非神经内分泌细胞也含有NSE。胶质细胞仅含有 αα-烯醇化酶,而 γγ-烯醇化酶对神经元(NSE)具有特异性,它特异性表达于神经元与神经内分泌细胞内,为糖酵解途径中的关键酶,催化2-磷酸甘油酸转变为磷酸烯醇丙酮酸,正常情况下处于低水平表达。当神经元细胞膜受到损伤时,很容易弥散到细胞外介质和脑脊液中,其血清的半衰期>20h,神经元损伤和血脑屏障完整性受损后,NSE 释放至脑脊液并最终进入血液,可对其进行检测,因此,在与中枢或外周神经系统细胞损伤相关的各种疾病中,NSE 被视为神经元损伤和预后的标志物。近十年来国内外已发表了多篇关于癫痫发作和癫痫持续状态后 NSE 升高的报道[4-5]。Rituparna Maiti等人[6]也通过实验证实了卡马西平及奥卡西平等常见抗癫痫药物治疗后均可以使血清NSE水平下降。因此在临床癫痫治疗过程中,血清NSE既可以作为癫痫辅助诊断的一个标志物,同时,对于抗癫痫药物治疗后的疗效判断也是一个非常好用的工具。
3.2 TRX在癫痫治疗监测中的作用 国内外已有众多报道及实验[7]证明,氧化应激被认为是癫痫脑损伤的发病机制之一。在癫痫发作时,由于大脑对氧的高利用率反而更容易受到氧化应激损伤,主要表现为自由基的产生增加、细胞内线粒体的功能障碍[8]等,其中,TRX是一种氧化还原蛋白,一种小型、多功能蛋白,在活性部位含有氧化还原活性二硫醇的保守活性位点序列,TRX以其调节氧化还原和清除活性氧中间体的活性,在细胞内和细胞外的胞内和胞外具有多种重要的生物学作用。TRX是中枢胆碱能神经元的神经调节因子,在机械性脑损伤中被上调,当癫痫发作时出现氧化应激损伤,海马及皮层TRX的蛋白表达水平可上调2~3倍,TRX蛋白表达水平的上调可活化半胱氨酸蛋白酶-3,活化的半胱氨酸蛋白酶-3在海马区可诱导神经元凋亡。相对于皮层,海马更容易受到氧化损伤,故本实验除了采集标本易得的血液,同时检测海马TRX浓度。
3.3 mNGF对癫痫的干预作用 神经生长因子(NGF)是神经营养因子家族的成员之一,在神经元的发育、轴突的生长、神经递质的合成、神经元细胞的凋亡、炎性痛觉过敏等方面发挥着至关重要的调节作用[9]。NGF 通过结合细胞表面的特异性受体,包括酪氨酸激酶 A (TrkA) 和 p75 神经营养因子受体 (p75NTR) 来发挥生物学效应[10]。TrkA 对 NGF 具有高亲和力,NGF-TrkA 信号通路的激活可促进部分细胞增殖、存活或转移[11-13]。TrkA 的激活对癫痫发作模型大脑中神经元的起保护作用。mNGF是从小鼠颌下腺提取的纯化生物蛋白,相对分子质量为26500,由于与人 NGF 具有同源性,mNGF作为药物应用于人类多种中枢神经系统和外周系统疾病的治疗,是目前研究最多的外源性神经生长因子,尤其是周围神经损伤和颅脑外伤的修复效果显著[14]。本实验中通过对4个小组血清、海马TRX及NSE浓度的比较显示,B组(EP组)即使用PTZ建立慢性癫痫幼鼠未使用任何干预剂,血清及海马的TRX及NSE浓度在4个时间段监测均处于最高水平,比较均有统计学差异(P<0.05),而C组即采用mNGF对慢性癫痫幼鼠进行干预后的幼鼠血清及海马的TRX、NSE浓度均较B组下降,但高于A组,比较均有统计学差异(P<0.05),由此推测癫痫患儿反复癫痫发作,大脑损伤持续存在,而mNGF对癫痫造成的神经系统损伤具有明显保护作用。
3.4 LPS-RS的神经保护性作用 Toll样受体4(TLR4)在中枢神经系统中广泛存在,神经元细胞、小胶质细胞、星形胶质细胞和少突胶质细胞均有表达,其中在小胶质细胞中表达最多。TLR4在神经系统免疫炎症中发挥着重要的调节作用,一旦激活,TLR4 可诱导细胞内多条信号转导通路,并最终促进生成许多介导炎症反应的促炎因子[15]。炎症是癫痫发生病理生理机制的重要促进因素,减轻炎症有助于缩小癫痫的范围和程度,有报道称LPS-RS是TLR4的有效抑制剂,是一种来源于红假单胞菌的脂多糖,可以通过竞争TLR4的受体来阻断TLR4信号通路引起的炎症反应。有实验研究[16]已证实LPS-RS的最佳干预剂量为0.1mg/kg,故本实验以此为干预剂量进行实验,通过检测血清及海马的TRX浓度和NSE浓度来反映LPS-RS对癫痫的干预作用。结果显示D组(LPS-RS组)干预后幼鼠血清及海马的TRX浓度及NSE浓度均较B组(EP组)下降,且低于C组(mNGF组),说明LPS-RS对慢性癫痫幼鼠癫痫发作有抑制作用,通过抑制TLR4介导的信号通路抑制中枢神经系统炎症级联反应,从而减轻神经损伤,减少癫痫发作。同时,相较于mNGF对癫痫幼鼠的干预作用,LPS-RS的作用效果更佳。通过本动物实验结果表明,LPS-RS可能尝试作为一种新型的抗癫痫药物应用于临床,但目前仍缺乏大样本数据作为依托,且药物使用时间、应用于人类的物种差异性等问题皆是下一步我们需要面对的难题,攻克癫痫治疗的前路道阻且长。
综上所述,LPS-RS对癫痫的神经损伤起保护作用,可作为癫痫治疗研究的靶点。 mNGF能够修复癫痫反复发作后的神经损伤,对神经元起保护作用。血清TRX、NSE可以作为癫痫治疗监测的指标。

