在线固相萃取/二维液相色谱法检测婴幼儿配方食品中视黄醇顺反异构体和α-生育酚手性异构体
铁晓威,谢 敏,黄百芬,施鸿波,任一平*
(1.欧陆分析技术服务(苏州)有限公司,江苏 苏州 215163;2.浙江省疾病预防控制中心,浙江 杭州 310057;3.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
维生素A 是一类视黄醇类化合物,食物中的维生素A 通常以视黄醇酯的形式存在,如视黄醇棕榈酸酯和视黄醇乙酸酯[1]。视黄醇具有维持视觉功能,影响免疫反应以及胚胎发育期间的基因表达等生理功能[2]。由于其侧链上有4个双键,在天然条件下存在全反式异构体、13-顺式异构体、11-顺式异构体、9-顺式异构体和9,13-双顺式异构体等多种异构体。其中全反式异构体的生物活性最高,13-顺式异构体的活性为75%,11-顺式异构体及9-顺式异构体的活性更低[3]。天然视黄醇主要以长链脂肪酸视黄醇酯的形式存在于乳及乳制品中[1],除了全反式视黄醇外,还存在部分13-顺式视黄醇异构体。图1为全反式视黄醇相关的各种顺式视黄醇的结构图[4]。
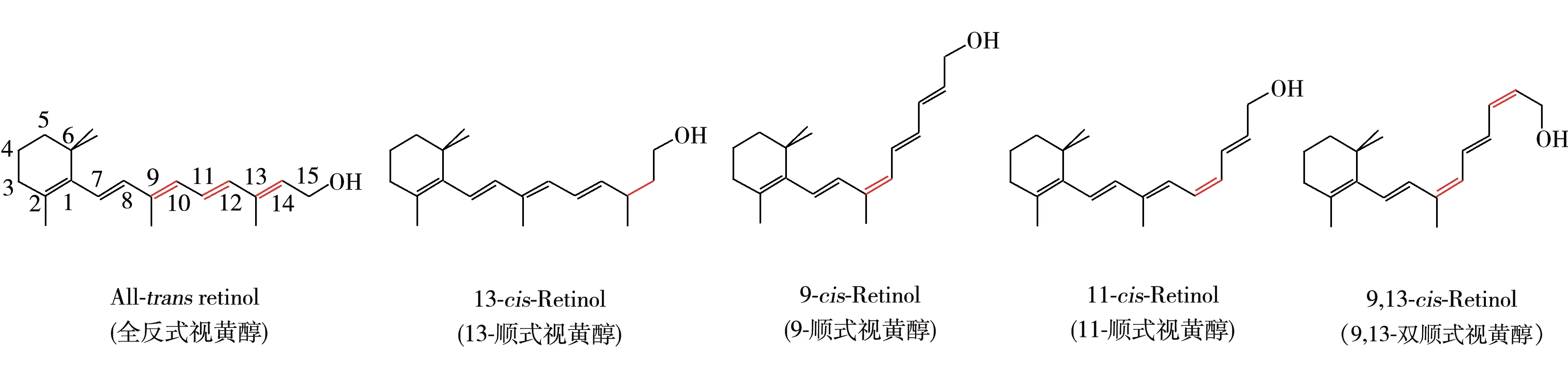
图1 视黄醇与顺式异构体的分子结构Fig.1 Molecular structures of retinol and their cis-isomers
维生素E(各种生育酚异构体)是婴幼儿生长发育的必需营养素。婴儿主要通过母乳或婴幼儿配方乳粉摄取必需的维生素E[5]。在生育酚的4 种结构异构体(α-生育酚、β-生育酚、γ-生育酚和δ-生育酚)中,α-生育酚的生物活性最高,根据工业合成与天然提取的原料来源不同,α-生育酚又分为dl-α-生育酚(工业合成)和d-α生育酚(天然来源)。工业合成的dl-α-生育酚是8 种立体异构体外消旋的混合物。而d-α-生育酚来自天然植物油脂,以RRR-α-生育酚(又称2R,4’R,8’R-α-生育酚)为主要形式[6-8]。不同来源α-生育酚的生物活性有所区别,RRR-α-生育酚的生物活性是工业合成dl-α-生育酚的1.36~2倍[9-10]。图2为4种生育酚异构体以及2种α-生育酚手性异构体的分子结构图。
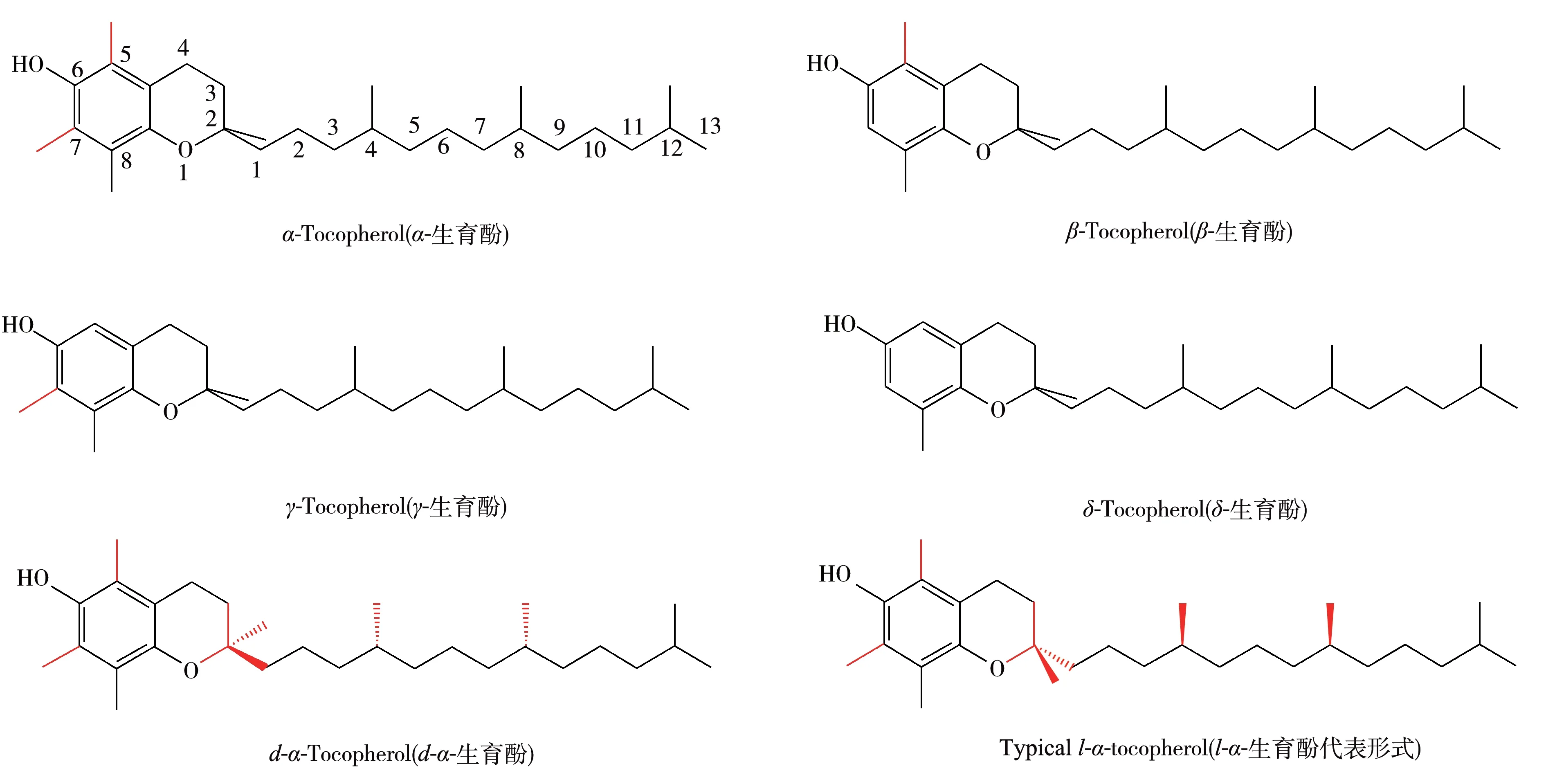
图2 4种生育酚异构体以及2种α-生育酚手性异构体的分子结构Fig.2 Molecular structures of four isomers of tocopherol and two α-tocopherol chiral isomers
现行国标GB5009.82-2016 采用一次皂化,应用C30反相色谱分离,紫外光测定总视黄醇(维生素A),同时检测α-、β-、γ-和δ-生育酚4个异构体[11]。ISO 20633-2015方法采用正相高效液相色谱法测定视黄醇酯类(如视黄醇棕榈酸酯和乙酸酯)[12]。AOAC 2011.15方法针对婴幼儿配方乳粉和成人营养品采用反相液相色谱法测定全反式与13-顺式视黄醇,再根据分子量系数折算成对应酯类[13]。GB 10765 -2021《婴儿配方食品》、GB 10766-2021《较大婴儿配方食品》中规定维生素A的允许用量需折算成视黄醇当量(RE),维生素E 的允许用量需折算成α-生育酚当量(TE)[14-15]。目前与之配套的检测方法标准 GB 5009.82-2016不能分离检测视黄醇的异构体和α-生育酚的手性异构体[11]。
现有的维生素A(视黄醇)和维生素E(生育酚)的主要检测方法有紫外分光光度法、高效液相色谱法(HPLC)、液相色谱-串联质谱法(HPLC-MS/MS)等[17-21]。上述方法的样品预处理需经过皂化、萃取、洗涤、浓缩、复溶等多个步骤,过程繁琐耗时,易造成试样中被测维生素的降解和损失,影响结果的准确性和稳定性。串联质谱检测法则会显著增加检测成本。
近年来开发的在线固相萃取(SPE)/二维液相色谱方法有所创新,主要用于婴幼儿配方食品中脂溶性维生素D2和D3的分离检测,减轻了检测过程的劳动强度和分析时间,并已在部分实验室应用[22-25]。而对视黄醇异构体和生育酚手性异构体的分离一般需要2 个色谱系统或2 次重复进样分离。在线SPE/二维色谱对视黄醇异构体以及α-生育酚手性异构体进行同时分离的研究尚未见报道。已有报道中,对强碱皂化样品在线SPE 所使用的固定相材料均为聚苯乙烯/二乙烯基苯共聚物(PS/DVB),并使用3个以上的清洗溶剂,这对仪器硬件系统提出了较高要求[24-26]。
本研究采用在线固相萃取以及二维液相色谱技术,大幅降低了前处理的复杂程度,增加了可靠性;并实现了4 种生育酚异构体、4 种视黄醇异构体以及d-α-生育酚和l-α-生育酚的完全分离,经紫外和荧光检测器串联检测进行准确定量,为婴幼儿配方食品相关检测提供了更准确、高效和方便的定量方法。
1 实验部分
1.1 材料与试剂
甲醇、乙腈(液相色谱纯,德国默克医药生物科技公司);无水乙醇(分析纯,上海凌峰化学试剂有限公司);氢氧化钾(分析纯,国药集团化学试剂有限公司);抗坏血酸(分析纯,上海阿拉丁生化科技股份有限公司);2,6-二叔丁基对甲酚(BHT,分析纯,上海阿拉丁生化科技股份有限公司);超纯水由美国PALL公司Cascada系列智能实验室超纯水系统制备。
标准物质:全反式视黄醇(纯度98.8%,北京曼哈格生物科技有限公司);13-顺式视黄醇、11-顺式视黄醇、9-顺式视黄醇(纯度90%,默克公司);dl-α-生育酚(纯度97.2%)、d-β-生育酚(纯度98%)、dγ-生育酚(纯度96.2%)、d-δ-生育酚(纯度99.6%)购于北京曼哈格生物科技有限公司。以上标准品按GB5009.82-2016规定经浓度校准后使用。
实验样品:各种婴幼儿配方乳粉由市场采购;国际婴幼儿配方乳粉标准质控品1849a 由雅培公司提供。
1.2 在线SPE二维液相色谱系统
在线SPE 色谱系统:使用Waters ACQUITY Arc 四溶剂低压混合溶剂泵、可更换柱芯夹套式小柱、单体式可控自动六通阀搭建而成。
二维液相色谱系统:包括2 台Waters ACQUITY Arc 四溶剂低压混合溶剂泵、1 台自动进样器(进样量5~500 μL)、2 个可控六通阀、双柱可控柱温箱、1 台二极管阵列紫外检测器和1 台荧光检测器搭建而成。
各部件连接方式及阀切换时状态如图3所示。
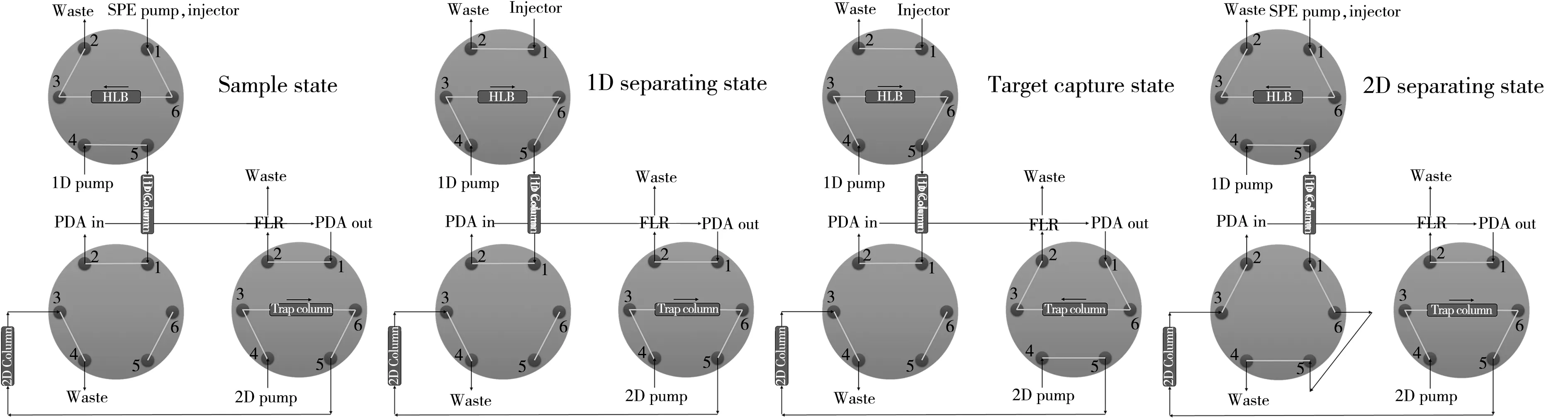
图3 在线二维色谱流路图Fig.3 Online 2D chromatographic flow path diagram
1.3 色谱条件
在线SPE 柱为Waters Oasis HLB(3.9 mm×20 mm,5 μm);一维色谱柱:NanoChrom ChromCore 五氟苯基(PFP)填料柱(4.6 mm×100 mm,3 μm);捕集柱:NanoChrom ChromCore(2.1 mm×30 mm,10 μm);二维色谱柱:NanoChrom UniChiral CND(4.6 mm×150 mm,5 μm)。流动相及梯度如表1所示。
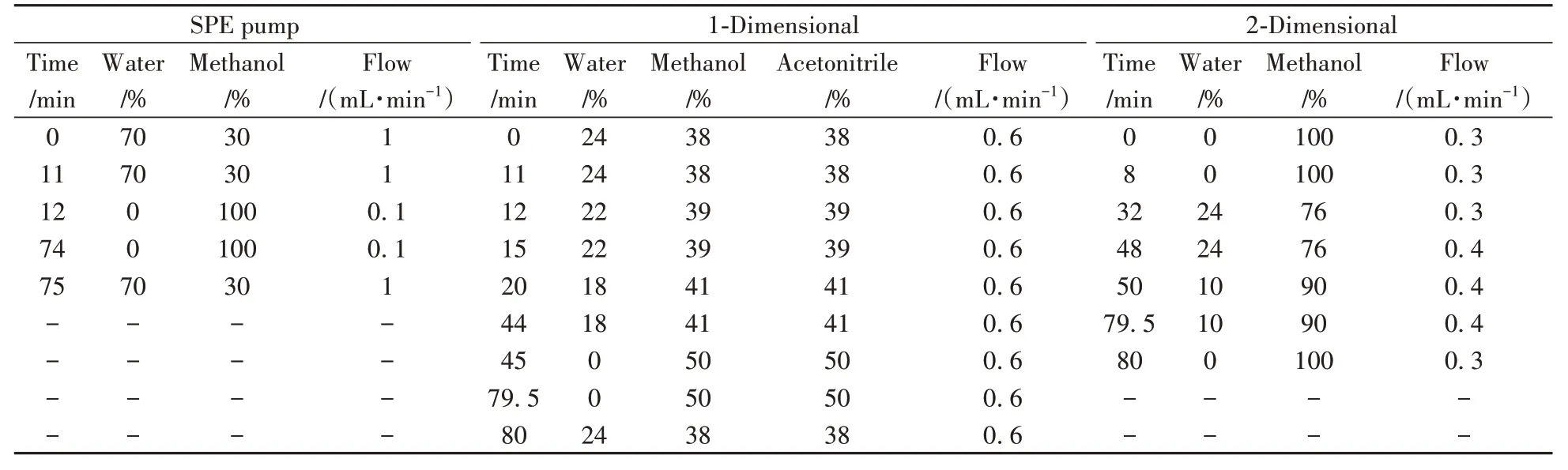
表1 在线SPE、一维与二维色谱条件Table 1 Online SPE,1D and 2D detection reference conditions
样品进样量为500 μL,进样温度为10 ℃,SPE柱切割时间为8.0~8.8 min,一维PFP柱的总视黄醇切割时间为13.0~14.0 min,生育酚的一维切割时间为28.0~30.0 min;PDA 检测波长:325、295 nm;荧光检测波长:EX:294 nm,EM:328 nm。PDA通过二维切换阀后与荧光检测器串联。
1.4 样品前处理方法
样品皂化参照GB 5009.82-2016的方法操作[11]。称取1 g样品于50 mL离心管中,加入0.5 g抗坏血酸和8 mL温水溶解,加入11 mL BHT-乙醇溶液(0.2 g/mL),涡旋混匀30 s,再加入6 mL氢氧化钾甲醇溶液(1∶1),涡旋混匀后于(80±2) ℃条件下水浴振荡30 min,立即冷却,用水定质量至30 g,离心5 min后,取上清液过0.22 μm尼龙滤膜至棕色进样瓶中,按“1.3”色谱条件进行检测。
2 结果与讨论
2.1 在线SPE柱的选择与条件优化
在线SPE 的主要目的是去除样品皂化液中的大部分强碱与杂质,并富集目标物。实验对比了Waters Oasis HLB(3.9 mm×20 mm,5 μm)柱和Agilent PLRP-S PS/DVB(12.5 mm×4.6 mm,15~20 μm)柱的效果。结果显示,两柱均可富集和净化皂化液中的视黄醇和生育酚;一维色谱上HLB 柱的干扰成分主要出现在视黄醇前,而PS/DVB 柱主要出现在视黄醇后。相比而言,HLB 柱和杂峰的分离度更优,便于切割至二维柱,因此选择HLB柱为在线SPE柱。
针对HLB进一步优化了甲醇-水比例、SPE净化时间以及切割至一维色谱的时间,结果显示,在甲醇-水体积比为30∶70,净化8 min,8.0~8.8 min切割的条件下,待测物的回收率最高,SPE洗脱液的pH值为中性对一维柱不产生损害,且一维色谱峰形对称。
2.2 一维色谱条件的优化
在一维色谱分析中,需实现对总视黄醇以及4 种生育酚异构体之间的分离,特别是β-生育酚与γ-生育酚之间的完全分离。由于实际样品中β-生育酚的含量较低,使用荧光检测器在EX 为294 nm,EM为328 nm 下检测可获得较高的灵敏度。对比了NanoChrom ChromCore PFP(4.6 mm×150 mm,3 μm)、Agilent Poroshell PFP(4.6 mm×150 mm,2.7 μm)、Alphasil S-PFP(4.6 mm×150 mm,3.5 μm)和ThermoFisher PFP(4.6 mm×150 mm,2.6 μm)4 种一维色谱柱的分离效果(图4)。结果显示,上述色谱柱均实现了满意的分离效果。考虑到实验成本,采用NanoChrom ChromCore PFP 色谱柱。
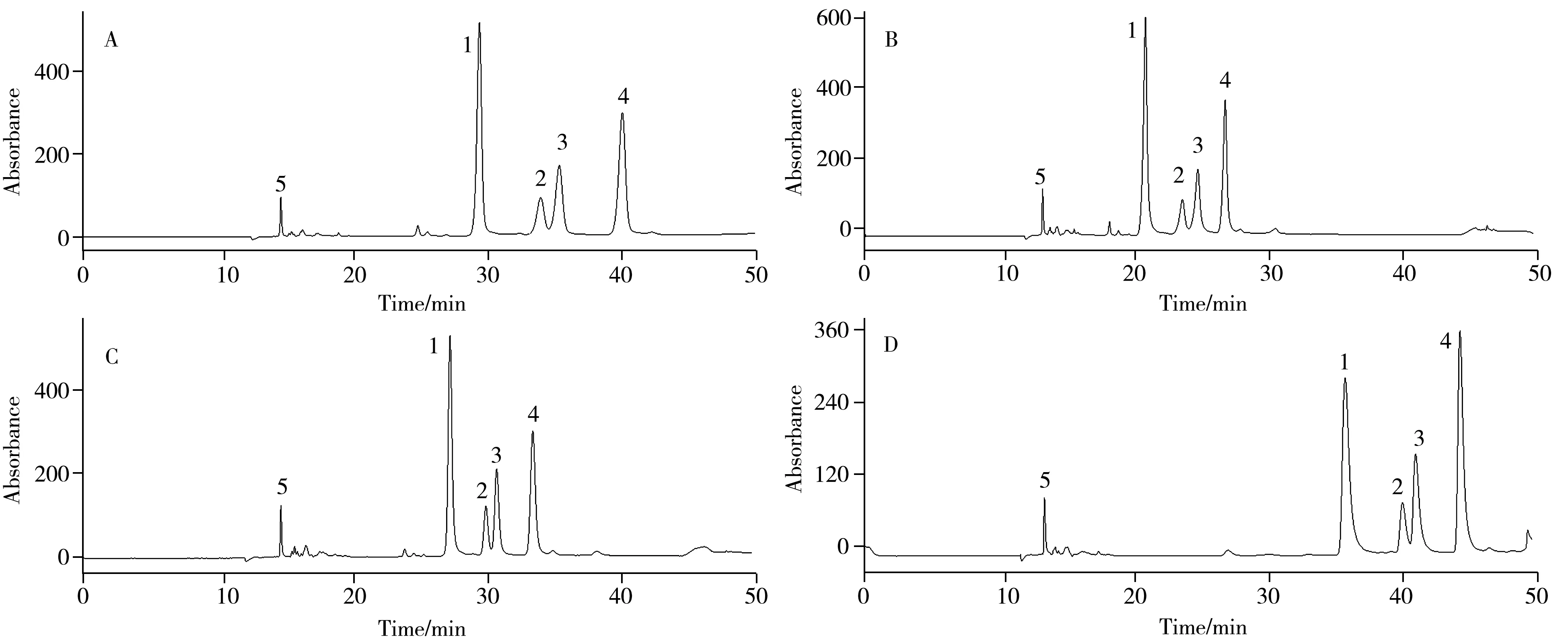
图4 一维色谱柱对样品分离效果的影响Fig.4 Effects of 1D columns on samples seperation A:NanoChrom ChromCore PFP column,B:Agilent Poroshell PFP column,C:Alphasil S-PFP column,D:ThermoFisher PFP column;1:δ-tocopherol,2:β-tocopherol,3:γ-tocopherol,4:α-tocopherol,5:total retinol
2.3 二维色谱条件的优化
2.3.1 视黄醇异构体的分离优化视黄醇异构体通常使用硅胶填料的正相色谱或C30的反相色谱进行分离[17-18],由于流动相和一维兼容的原因,在二维色谱中使用反相色谱系统是优选方案。NanoChrom UniChiral CND 是纤维素型手性色谱柱,由3,5-二甲基苯基氨基甲酸酯涂敷在硅胶填料上获得,该柱可使用水与甲醇混合作为流动相。本实验比较了反相C30柱与CND 手性柱的洗脱效果,结果显示,4种视黄醇在CND 柱上可实现较好分离,视黄醇的主要异构体全反式视黄醇与13-顺式视黄醇完全达到基线分离;C30柱的分离度较差,9-与11-顺式视黄醇不能实现分离。因此选择NanoChrom UniChiral CND柱为二维色谱柱。
2.3.2 α-生育酚手性异构体的分离优化选取合成α-生育酚(全消旋)的醋酸酯原料和天然α-生育酚(从植物油脂中提取)分别进行皂化处理、SPE 净化、一维分离,将一维α-生育酚切割至二维CND 柱优化分离条件。α-生育酚(全消旋)完全被分离成2 个峰,且其峰高与面积均一致;而来源于植物油脂的α-生育酚(d-α-生育酚)标准品进样时,在相同色谱条件下仅出现1个峰。
为进一步证实本方法,选取1849a 国际质控样(只添加天然RRR-α-生育酚)进行检测,二维谱图显示单峰(d-α-生育酚)。由于无法获得l-α-生育酚标准样品,推测合成生育酚中的8 种异构体[2]在二维CND手性柱上分离成2个组分,前者为d型,后者为l型。本文尝试用C30反相柱对α-生育酚进行手性分离,未能实现完全分离。
2.4 方法学验证
2.4.1 线性关系、检出限与定量下限分别准确吸取全反式视黄醇、13-顺式视黄醇、d-α-生育酚和lα-生育酚单标储备液,置于不同的棕色容量瓶中,用90%甲醇水溶液定容配制成不同质量浓度的混合标准系列溶液。取各化合物的标准溶液逐级稀释,分别以信噪比S/N≥3和S/N≥10确定仪器检出限和定量下限,以质量浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得到线性方程。由表2 可知,全反式视黄醇、13-顺式视黄醇的线性范围为0.1 ~ 5.0 mg/L,d-α-生育酚、l-α-生育酚的线性范围为1.0 ~ 30.0 mg/L,相关系数均大于0.999,检出限分别为17 μg/100 g、17 μg/100 g、89 μg/100 g、96 μg/100 g,定量下限分别为53 μg/100 g、56 μg/100 g、290 μg/100 g和340 μg/100 g。
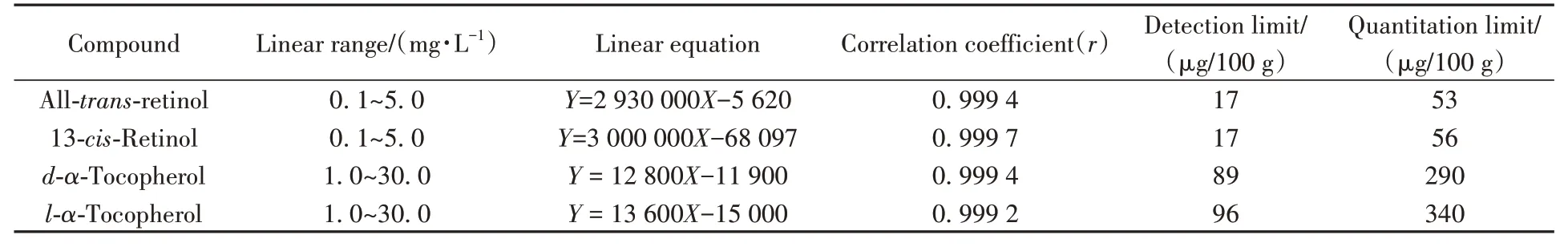
表2 目标物的线性关系、检出限及定量下限Table 2 Linear relations,detection limits and quantitation limits of analytes
2.4.2 回收率与相对标准偏差依据全反式视黄醇和dl-α-生育酚的定量下限确定低、中、高3 个加标浓度,称取不同含量的样品进行3水平加标回收实验,同时做6批次平行测定,考察本方法的重现性(见表3)。结果表明,目标物的平均回收率为90.9% ~ 106%,相对标准偏差(RSD)不大于2.8%。

表3 目标物的回收率及标准标准偏差(n=6)Table 3 Recoveries and relative standard deviations of analytes(n=6)
2.5 实际样品测定
随机选取市售的10 批次不同品牌的婴幼儿配方乳粉(编号1~10),乳粉质控样品1849a(编号为11),采用“1.4”方法处理样品。在最优仪器条件下,按“1.3”色谱条件,同时分析乳粉质控样品1849a和实际样品,结果见表4。结果表明,10款市售婴幼儿配方乳粉的视黄醇含量和α-生育酚含量均高于标识值,且乳粉质控样品1849a测试结果均在控制范围内。
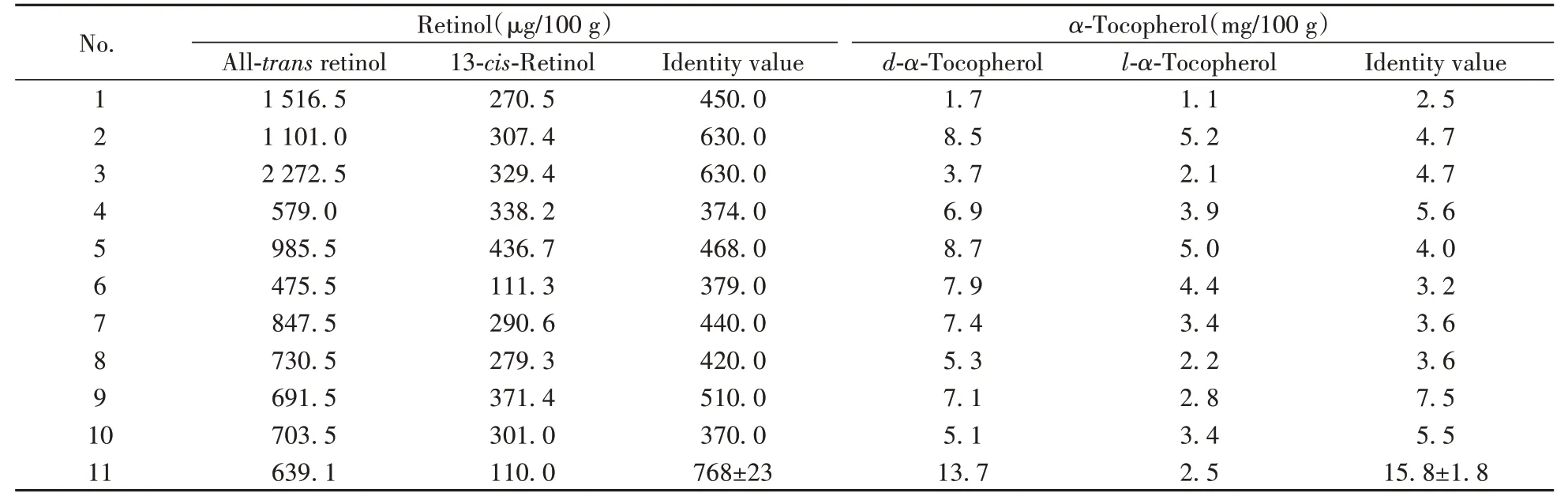
表4 实际样品测定结果Table 4 Determination results of actual samples
3 结 论
本研究建立了在线固相萃取/二维液相色谱分离检测婴幼儿配方食品中全反式视黄醇、13-顺式视黄醇和α-生育酚手性异构体的方法,并对实际样品和国际质控样进行了检测。该方法自动化程度高,实现了主要异构体的分离和定量,为准确评价婴幼儿食品中维生素A 和E 的生物活性提供了新的解决方案。

