生长抑素三硫化物的制备与质谱分析
王 军,邱荣英,成祥旭,李 涛,刘金明,田洪武,李铁健*,张贵民
(1.山东新时代药业有限公司,山东 临沂 273400;2.鲁南制药集团股份有限公司,山东 临沂 276005;3.国家手性制药工程技术研究中心,山东 临沂 276005;4.山东省手性制药技术创新中心,山东 临沂 276005)
生长抑素(结构如图1A)是由下丘脑分泌的一种肽类激素,是由9 种氨基酸组成的环状肽,主要作用于消化道、胰腺、中枢与外周神经系统,临床上用于治疗上消化道出血、急性胰腺炎、肝硬化合并出血等疾病[1-5]。最新研究表明,该药物对肿瘤也有一定治疗效果[6]。
目前大多数多肽药物通过固相合成技术获得,但在合成与存储过程中易形成杂质,包括氨基酸插入、氨基酸丢失、氧化/还原反应、多聚体杂质等,有些杂质不但没有疗效,反而具有毒副作用[7]。2023年2月国家食品药品监督管理局药品审评中心(CDE)发布了《化学合成多肽药物药学研究技术指导原则(试行)》(简称《原则》),为多肽类药物的质量研究提供了依据。该《原则》指出在外界因素下,肽类药物中的半胱氨酸(Cys)可能发生β-消除反应产生降解杂质,需进行深入研究[8]。有研究表明含有二硫键的蛋白类药物发生β-消除反应后,会进一步产生三硫化物杂质[9-10]。目前,生长抑素工艺杂质、异构体杂质与二聚体杂质均有报道[1,11-14],而生长抑素三硫化物(理论结构如图1B)杂质国内外均未见报道。本研究首次对生长抑素三硫化物进行制备纯化并获得纯品,对其进行质谱分析,并确认了精确分子量、肽序列与三硫键连接位点,为生长抑素的质量研究提供了依据,对其他多肽类药物的三硫化物杂质研究也具有重要意义。
1 实验部分
1.1 材料与试剂
生长抑素(批号:504200601,鲁南新时代生物技术有限公司);磷酸、磷酸二氢钠、磷酸二氢铵、乙酸、硫代硫酸钠与三乙胺均为分析纯,购自西陇科学股份有限公司;甲酸为质谱纯,购自TCI 公司;三(2-羧乙基)膦盐酸盐(TCEP·HCl)为分析纯,购自Thermo公司;乙腈为色谱纯,购自Merck 公司;制备级乙腈,购自潍坊中汇化工有限公司;超纯水为实验室自制。
1.2 仪器与设备
Waters Acquity H-Class 型超高效液相色谱系统(Waters 公司);Synapt-XS 高分辨质谱仪(Waters 公司,配Masslynx V4.2 与Unifi Portal 软件);Agilent 1260 HPLC液相色谱系统(美国Agilent公司);NP7000-DAC50mm动态轴向压缩制备液相色谱系统(江苏汉邦科技有限公司);FD8-3a 真空冷冻干燥机(GOLD-SIM 公司);R-220 pro 旋转蒸发仪(BUCHI 公司);XSR105DU/A 型电子天平(十万分之一,梅特勒公司);WXTS3DU 型电子天平(百万分之一,梅特勒公司)。
1.3 HPLC色谱条件
色谱柱为AerisTMWIDEPORE XB-C18(4.6 mm×250 mm,3.6 μm);流动相A 为1.1%磷酸水溶液(三乙胺调至pH 2.3),流动相B 为乙腈;梯度洗脱条件为:0~35 min,18%~40% B;35~36 min,40%~50% B;36~46 min,50% B;46~47 min,50%~18% B;47~55 min,18% B;流速为1.0 mL·min-1;柱温为40 ℃;进样量为5 μL; 检测波长为215 nm。
1.4 高压制备液相色谱条件
1.4.1 一次高压制备液相色谱条件色谱柱填料:Sepax GP C18(250 mm×50 mm,5 μm,孔径12 nm);流动相A 为0.2 mol·L-1磷酸二氢铵溶液(用磷酸调至pH 2.2),流动相B 为乙腈;流速为50 mL·min-1;检测波长为215 nm。梯度洗脱条件为:0~40 min,20%~35% B;40~41 min,35%~60% B;41~45 min,60% B;45~46 min,60%~20% B;46~52 min,20% B。收集保留时间约为27 min的目标峰。
1.4.2 二次高压制备液相色谱条件色谱柱填料、流动相、流速及检测波长与“1.4.1”相同。梯度洗脱条件:0~40 min,30% B。收集保留时间约为18 min的目标峰。
1.4.3 三次高压制备液相色谱条件色谱柱填料:Sepax GP C18(250 mm×50 mm,5 μm,孔径12 nm);流动相A 为0.2 mol·L-1乙酸水,流动相B 为乙腈;流速为50 mL·min-1;检测波长为215 nm。梯度洗脱条件为:0~15 min,8% B;15~16 min,8%~50% B;16~30 min,50% B;30~31 min,50%~8% B;31~40 min,8% B。收集保留时间约为21.5 min的目标峰。
1.5 液质联用(LC-MS)条件
色谱柱:Thermo Hypersil Gold AQ(2.1 mm×150 mm,1.9 μm),流动相A 为0.1%甲酸水溶液,流动相B 为乙腈。梯度洗脱条件为:0~3 min,5% B;3~9 min,5%~40% B;9~15 min,40% B;15~16 min,40%~5% B;16~20 min,5% B。柱温:40 ℃;流速:0.3 mL·min-1;进样量:1 μL(还原前供试品溶液)或10 μL(还原后供试品溶液);检测波长为215 nm。
离子源:电喷雾电离(ESI);扫描模式:正模式;扫描范围:m/z25~2 000;雾化气流速:800 L·h-1;离子源温度:100 ℃;毛细管电压:2.5 kV;锥孔电压:40 V;碰撞能量:30~60 eV。
1.6 溶液制备
1.6.1 生长抑素三硫化物粗品溶液制备取适量生长抑素溶于水中,加入Na2S2O3,生长抑素与Na2S2O3的摩尔比为1∶2,60 ℃水浴反应1 h后备用。
1.6.2 质谱分析样品溶液配制还原前供试品溶液:冻干后样品经水溶解,配制成质量浓度约为1.0 mg·mL-1的溶液。该溶液用于目标物精确分子量的测定。
还原后供试品溶液:量取上述还原前供试品溶液10 μL,加入80 μL 水和10 μL 0.1 mol·L-1TCEP·HCl溶液,混匀后室温下反应5 min,用于目标物肽序列与三硫键连接位点的测定。
2 结果与讨论
2.1 生长抑素三硫化物粗品的合成
文献报道,使用硫化氢气体[15]或硫代硫酸盐[16]与蛋白质类药物反应可生成三硫化物。由于硫化氢气体有毒性且易燃易爆,不易操作,从安全角度出发,本研究首先加入硫化钠与生长抑素反应,未获得目标物。然后改用Na2S2O3与生长抑素反应,发现生长抑素与Na2S2O3的摩尔比为1∶2,60 ℃水浴反应1 h 后可获得生长抑素三硫化物,经HPLC 检测目标物的纯度约为10%,能够满足后期的制备纯化要求。
2.2 生长抑素三硫化物的纯化
目前检测生长抑素三硫化物的HPLC 方法中流动相A 含有三乙胺,会与色谱柱填料中的硅醇基结合,对色谱柱填料产生不易逆转的影响,导致柱效下降,因此未采用其作为高压制备液相色谱的流动相。本研究采用pH 2.2 的磷酸二氢铵溶液作为流动相A,乙腈作为流动相B,经优化梯度,第一次制备纯化的色谱图见图2A,可将生长抑素三硫化物(图中保留时间为27.1 min 的峰)与其他干扰物分开。然后对该目标物进行收集与浓缩,HPLC 检测其纯度大于70%,作为二次制备纯化的供试品溶液。第二次制备纯化采用等度洗脱方法,其色谱图见图2B,对保留时间约为18.0 min 的峰进行收集浓缩,HPLC 检测其纯度大于95%,作为三次制备纯化的供试品溶液。第三次制备纯化采用易挥发的乙酸水作为流动相A,乙腈作为流动相B,优化梯度后,对目标化合物进行收集浓缩,即可将二次制备样品中的磷酸盐转为乙酸,而乙酸在浓缩与冻干步骤中可挥发去除,因此不影响下一步的质谱分析。经过冻干后,HPLC 检测其纯度大于95%,其色谱图见图3。
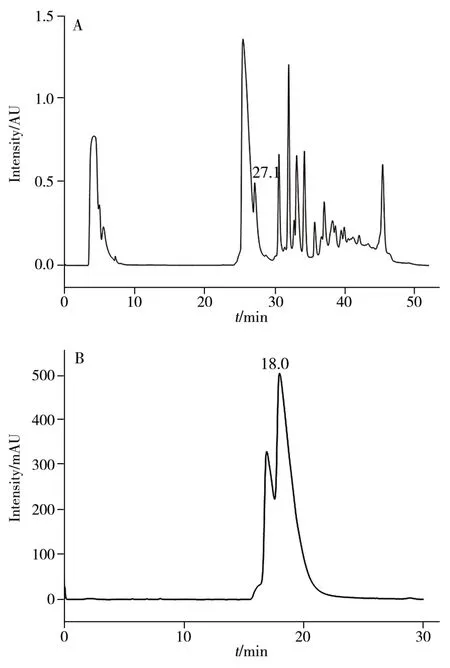
图2 生长抑素三硫化物的一次制备(A)与二次制备(B)色谱图Fig.2 The first preparation(A) and second preparation(B) chromatograms of somatostatin trisulfide

图3 生长抑素三硫化物冻干后的色谱图Fig.3 Chromatogram of somatostatin trisulfide after freeze-dried
2.3 生长抑素三硫化物的质谱分析
多肽分子由于分子量较大,通过紫外光谱、红外光谱、核磁共振波谱等进行结构解析存在困难[8],目前多采用LC-MS 法进行分析[17-18]。本研究采用LC-MS 法对生长抑素三硫化物的精确分子量、肽序列与三硫键连接位点进行了分析,具体结果如下。
2.3.1 精确分子量的测定由图1 可知,生长抑素三硫化物的分子式为C76H104N18O19S3,精确的单同位素分子量为1 668.688 7。还原前供试品溶液的一级质谱图见图4,其加合离子[M+2H]2+的质荷比(m/z)为835.353 9、[M+3H]3+的m/z为557.236 9,与生长抑素三硫化物理论计算值([M+2H]2+的m/z为835.351 6、[M+3H]3+的m/z为557.236 9)的质量误差均小于10×10-6,表明与目标物的理论分子量相符。
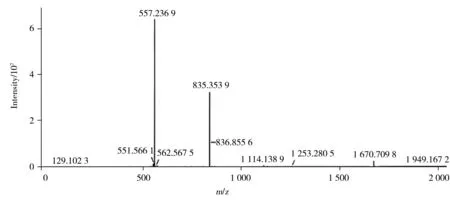
图4 生长抑素三硫化物的一级质谱图Fig.4 MS spectrum of somatostatin trisulfide
2.3.2 肽序列分析多肽药物离子化后进入质谱质量分析器和离子碰撞池,施加适当的电压和碰撞气体后,其骨架发生断裂,在ESI 源下诱导碰撞解离(CID)后形成一系列b 离子和y 离子,再通过软件进行拼接,可得到肽段的序列[19-20]。在CID 下,一般优先引起肽骨架断裂,但不会导致二硫键断裂[21],目前常用还原剂对二硫键还原后再进行测序[22]。有报道显示抗体药物中的三硫键在TCEP 还原下,可生成二硫键与游离巯基,其机理见图5[23]。因此,本研究使用TCEP 对生长抑素三硫化物还原后再进行肽序列测定。
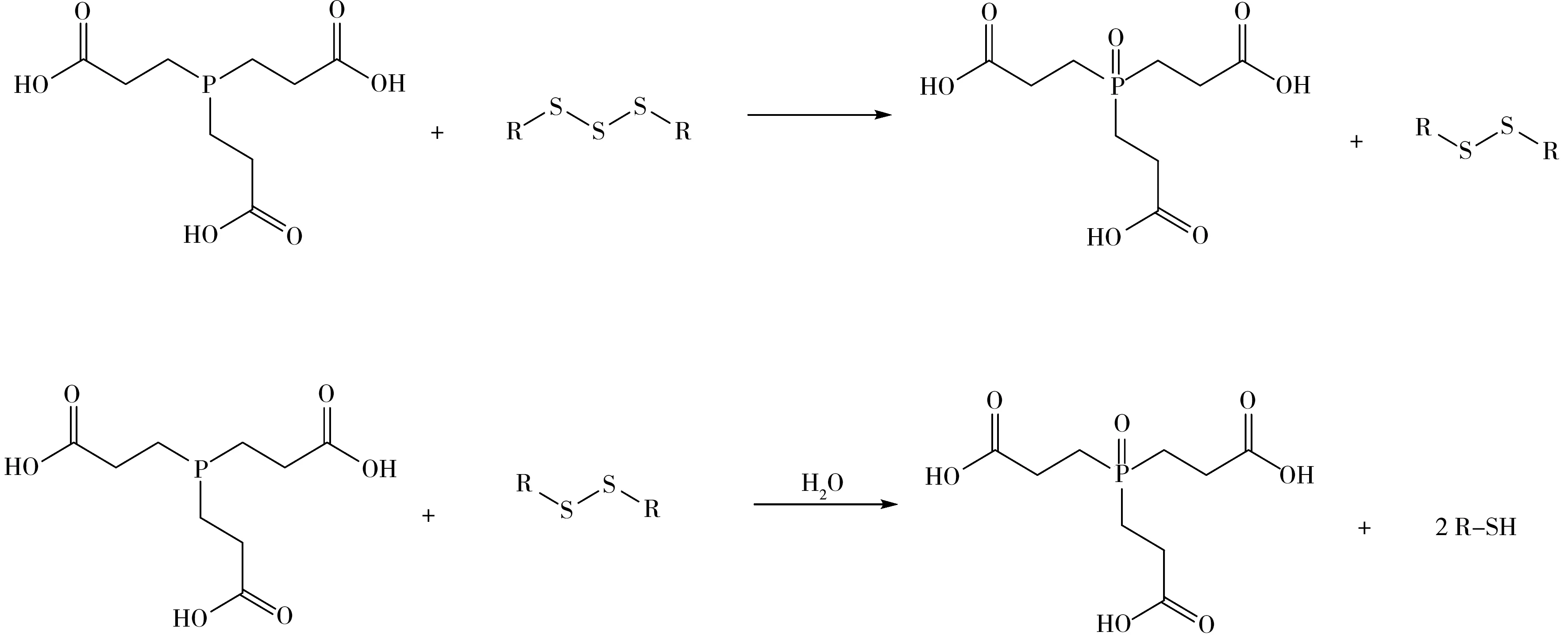
图5 三硫化物与TCEP还原反应机理Fig.5 The mechanism of trisulfide reduction with TCEP
还原后供试品溶液经质谱分析的总离子流图(TIC)如图6 所示,主要生成了化合物1(保留时间为9.74 min)与化合物2(保留时间为9.52 min)。

图6 生长抑素三硫化物还原后的总离子流图Fig.6 Total ion chromatogram of reduced somatostatin trisulfide
其中化合物1 的质谱图见图7A,其加合离子[M+2H]2+的m/z为819.367 0、[M+3H]3+的m/z为546.579 1,均与生长抑素的理论计算值([M+2H]2+819.365 6、[M+3H]3+546.579 5)吻合,质量误差小于10×10-6。化合物2 的质谱图见图7B,其加合离子[M+2H]2+的m/z为820.375 4、[M+3H]3+的m/z为547.251 6,与生长抑素相比,该化合物的相对分子质量增加2 Da,可初步判断为生长抑素线性肽(C76H106N18O19S2),质量误差小于10×10-6。结合图5 所示反应机理,初步判断生长抑素三硫化物与TCEP反应后生成了生长抑素(化合物1)与生长抑素线性肽(化合物2)。其中生长抑素线性肽可用于肽序列的测定,经检索后的匹配图见图8,具体b/y 离子匹配表见表1,表中加粗部分为匹配上的离子,匹配度较高,可知样品序列为:A-G-C-K-N-F-F-W-K-T-F-T-S-C,与生长抑素三硫化物的理论肽序列信息相符。

表1 生长抑素三硫化物(还原后)肽序列匹配表Table 1 Peptide sequence matching table of reduced somatostatin trisulfide

图7 化合物1(A)与化合物2(B)的一级质谱图Fig.7 MS spectra of compound 1(A) and compound 2(B)
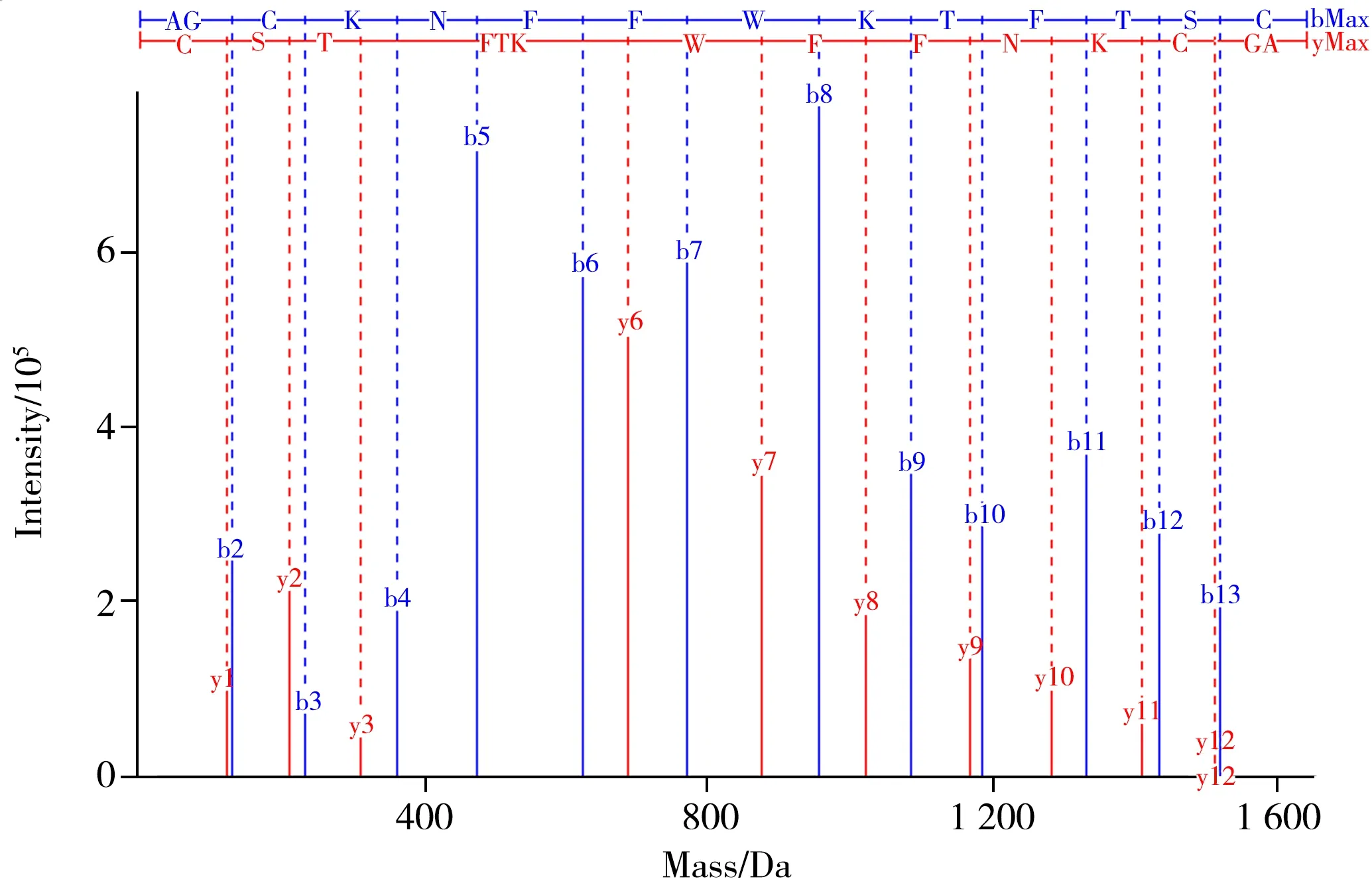
图 8 生长抑素三硫化物(还原后)的肽序列匹配图Fig.8 Peptide sequence matching map of reduced somatostatin trisulfide
2.3.3 三硫键连接位点确认目前关于二硫键的鉴定方法报道较多,包括柱后在线还原法[24]、离子源内部分还原法[25]、化学裂解法[26-27]与溶液中的试剂还原法[28],而三硫键的鉴定多集中在抗体类药物[15,23,29],多肽类药物中的三硫键定位未见报道。本研究建立了多肽类药物中三硫键的定位方法。通过优化TCEP 与生长抑素三硫化物的反应时间,发现在室温下反应5 min,可将其还原为生长抑素与生长抑素线性肽。与上述文献方法相比,本方法反应时间短,无需烷基化且易于操作。通过“2.3.2”的肽序列可知,该结构中存在2 个半胱氨酸,理论上只存在1 对三硫键。生长抑素三硫化物与生长抑素线性肽序列的结构如图9 所示,由于三硫键在CID下不易碎裂,因此生长抑素三硫化物理论上不会产生y9、y10、y11等碎片离子,而通过比较二者特征离子y12的质量差可判断三硫键连接位点。经检测,生长抑素三硫化物的y12离子m/z为1 541.649 0,生长抑素线性肽的y12离子m/z为1 511.684 5,前者比后者多30 Da,由此确证三硫键连接位点为Cys(3)-Cys(14),与生长抑素三硫化物的理论结构相符。
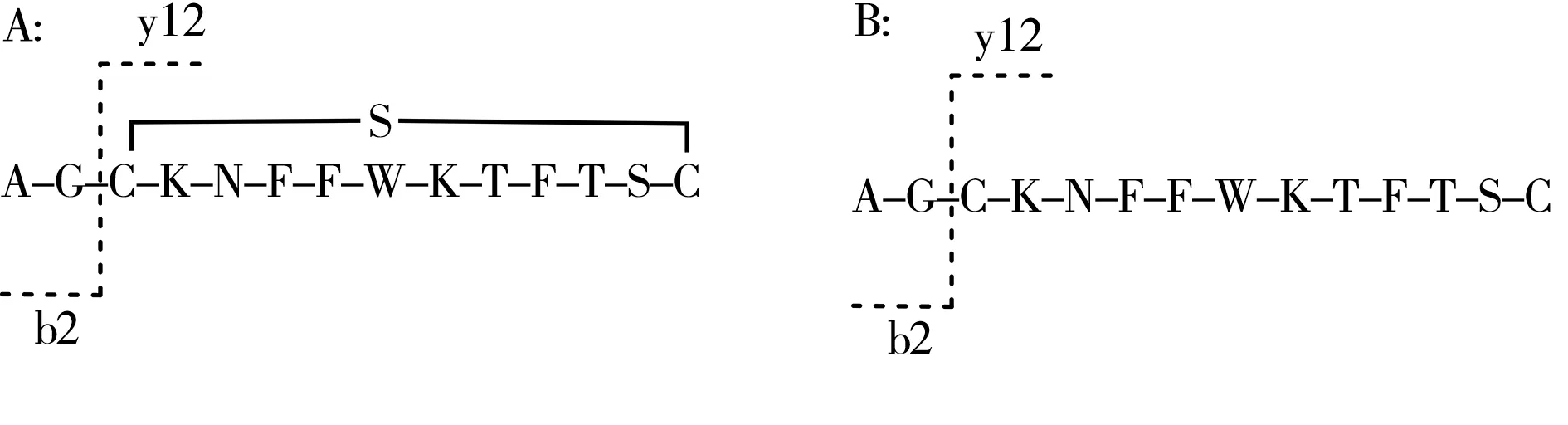
图9 生长抑素三硫化物(A)与生长抑素线性肽(B)的结构Fig.9 The structures of somatostatin trisulfide(A) and somatostatin linear peptide(B)
3 结 论
本研究将生长抑素与Na2S2O3以摩尔比1∶2 在60 ℃水浴下反应1 h后,制得的生长抑素三硫化物的纯度约10%,此反应液经3次制备纯化后冻干,获得了纯度大于95%的目标物。经过质谱分析,其精确分子量、肽序列与三硫键连接位点均与理论结构一致。目前未见该化合物的相关报道,该研究为进一步开展生长抑素的质量研究提供了参考,对其他多肽类药物的三硫化物杂质研究也具有重要意义。

