核黄素参与水稻非生物胁迫的响应分析
夏清珊,周正琨,谭炎宁,刘选明,秦迪岚,林建中*
(1 湖南大学 生物学院 植物功能基因组学和发育调控湖南省重点实验室/国家耐盐碱水稻技术创新中心,长沙 410082;2 湖南杂交水稻研究中心,长沙,410125;3 湖南省生态环境监测中心 国家环境保护重金属污染监测重点实验室,长沙 410019)
水稻是中国的第一大粮食作物,随着人口的增加和耕地面积的减少,提高粮食的产量是现代水稻研究的重中之重[1]。水稻在生长过程中,常会受到自然界各种不利环境的影响,如高温、干旱、高盐、低温、氧化胁迫、大气污染等非生物因素,病原微生物、害虫等生物因素[2-3]。
这些逆境胁迫会引起水稻一系列形态和生理生化上的变化,影响水稻的正常生长发育,尤其会对产量和品质带来损失,严重时甚至可导致死亡[4-5]。水稻在生长过程中不能主动避开逆境胁迫带来的危害,但在漫长的进化过程中已经形成了一系列复杂且有序的机制来感知环境的变化、抵御环境带来的不利影响[6-7]。
核黄素(riboflavin)又称维生素B2(VB2),因其结构中含有核糖且呈黄色,故取名核黄素[8-9]。核黄素是酶辅因子黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的前体,FAD和FMN是许多氧化还原酶的辅基,参与许多生物过程,如生物钟调节[10]、固氮[11]和激素代谢[12-13]。所有的植物和真菌以及大多数细菌都能产生核黄素[14],核黄素的基本功能就是以FMN或FAD的形式作黄素酶的辅基,与黄素蛋白或金属黄素蛋白组成复酶,参与动植物、微生物以氧化还原反应为特征(包括氨基酸去氨基化作用、嘌呤降解、醛类物质的降解、呼吸电子传递链等)的50多个生理生化过程,与机体的糖、脂类及蛋白质的生物氧化有密切关系。植物体外施用核黄素可以促进许多生理代谢过程、减轻病害;同时,核黄素在植物体内可以与各种多糖结合,形成糖基化核黄素。这些研究结果表明,植物可能有一种机制对核黄素在体内进行重新分配,调控环境胁迫反应[15-17]。已有研究发现,核黄素能够增加植物的抗病性。例如,董汉松等[18]发现核黄素能作为植物抗病性激发子而激活免疫信号转导通路,诱导植物对多种病害产生抗性。
最近,Hu等[19]发现核黄素影响水稻体内活性氧的代谢平衡和叶绿体的发育。Tian等[20]在玉米中发现,核黄素通过协同线粒体能量代谢和细胞周期来调控胚乳发育;异源过表达核黄素合成酶基因ZmRIBA1能显著提高拟南芥的渗透胁迫耐受性。尽管有迹象显示核黄素参与了植物非生物胁迫响应,但关于核黄素缓解非生物胁迫伤害的机制仍知之甚少。
因此,在高温、盐、碱、干旱等非生物逆境胁迫条件下,本研究测定了粳稻品种Kitaake和籼稻品种T98B的核黄素含量及其合成相关基因的转录水平,并分析了施加外源核黄素后水稻对不同逆境胁迫的响应特征,以证实核黄素是否参与了调控植物非生物逆境响应的调控,为后续分子机制研究提供重要线索和启示。
1 材料和方法
1.1 试验材料
选择粳稻品种Kitaake(Oryzasativassp.japonicavar. Kitaake)和籼稻品种T98B(Oryzasativassp.indicavar. T98B)进行模拟逆境处理、核黄素含量测定、RNA提取、生理指标测定等。水稻种子保存于4 ℃冰箱,而幼苗均在人工气候箱(Conviron,加拿大)中培养。
1.2 水稻逆境处理
选用在水培溶液[21]中正常生长14 d的Kitaake和T98B幼苗进行逆境胁迫处理。其中,逆境胁迫处理参考本课题组方法[22],包括:(1)盐胁迫处理,140 mmol/L NaCl的水培营养液培养幼苗;(2)渗透胁迫处理(模拟干旱胁迫),20% PEG的水培营养液培养幼苗;(3)氧化胁迫处理,4 μmol/L甲基紫精(MV) 的水培营养液培养幼苗;(4)碱胁迫处理,50 mmol/L 的NaHCO3+Na2CO3水培营养液处理幼苗;(5)高温胁迫处理,将生长于正常水培溶液中的幼苗置于45 ℃的高温培养箱中培养。另外,在各逆境胁迫处理培养溶液中添加核黄素[15](10 μmol/L)作为平行处理,用于考察施加外源核黄素对逆境胁迫响应的影响。处理时间为6~12 d,直至出现明显的逆境胁迫表型为止,然后进行相关指标观测。
1.3 观测指标及方法
1.3.1 表型和生长指标
胁迫处理结束后,观察植株表型、测量株高和鲜重并统计存活率[21]。(1)株高:分别取胁迫处理前后的水稻幼苗(选取时间与逆境处理时间保持一致),测量从根部到茎叶顶部的高度。(2)鲜重:分别取胁迫处理前后的水稻幼苗(选取时间与逆境处理时间一致),擦干根和叶表面水分,称取单株幼苗重量。
1.3.2 核黄素含量
参照Hiltunen等[23]的方法并加以改进,进行核黄素含量测定。主要步骤如下:称取0.1 g植物材料,用液氮研磨,然后悬浮于0.5 mL甲醇/二氯甲烷(9∶10)中,在4 ℃温和搅拌下孵育2 h,离心取上清待测。样品在高效液相色谱系统1100(安捷伦,美国)上进行分析,使用Agilent HC-C18柱(高250 mm,直径4.6 mm),以1 mL/min的速度在27 min内以水和甲醇(5%~90%)的线性梯度洗脱。用荧光法(λex= 265 nm,λem= 530 nm)检测核黄素并用正品标准确认。
1.3.3 实时荧光定量PCR (QRT-PCR)分析
按照引物设计原则,利用软件Premier 5.0设计核黄素合成相关基因的特异性引物(表1)。采用Trizol试剂(No.9109,TaKaRa)提取水稻幼苗的总RNA,并逆转录为cDNA,然后参照文献[24]采用qRT-PCR分析核黄素合成相关基因的转录水平。

表1 PCR引物序列
1.3.4 生理指标
生长14 d的水稻幼苗用盐和高温胁迫处理0,3,5,7 d,取幼苗地上部分用于后续生理指标检测。其中,参照 Cao等[25]的电导仪法测定水稻叶片相对电导率;采用丙二醛(MDA)含量检测试剂盒 (BC0025;Solarbio)、过氧化氢(H2O2)含量检测试剂盒(BC3590;Solarbio)和过氧化氢酶检测试剂盒(S0051;Beyotime)分别测定盐和高温胁迫处理幼苗中的MDA和H2O2含量,以及过氧化氢酶活性。
1.4 数据分析
所有数据用平均值±标准差表示,采用SPSS23.0统计分析软件,显著性水平为0.05,采用GraphPad Prism 8计算机软件作图。
2 结果与分析
2.1 外源核黄素对水稻非生物胁迫响应的影响
Kitaake 和T98B水稻幼苗在盐、高温、渗透、碱和氧化等5种非生物胁迫处理6~12 d后的生长情况如图1所示。其中,在盐胁迫处理8 d后,Kitaake和T98B均表现出了生长受到抑制和叶片坏死等明显的胁迫表型;施加外源核黄素(10 μmol/L)则显著提高了T98B的耐盐性,其幼苗存活率、高度和鲜重比盐胁迫分别显著提升了约75%、9%和11%,而Kitaake的改善效果不明显(图1,A、F);在高温(45 ℃)处理8 d后,Kitaake 和T98B均表现出了叶片卷曲和干枯的胁迫表型,而施加外源核黄素则小幅度提高了Kitaake的高温耐受性,而对T98B的改善效果不明显,但是Kitaake 和T98B幼苗的鲜重均显著增加(图1,B、F)。在渗透胁迫处理6 d后,Kitaake 和T98B均表现出了明显的胁迫表型,且Kitaake受伤害更严重;施加外源核黄素则使T98B则对渗透胁迫更敏感,尤其是幼苗存活率和鲜重显著降低,而对Kitaake的渗透胁迫响应没有明显影响(图 1,C、F)。
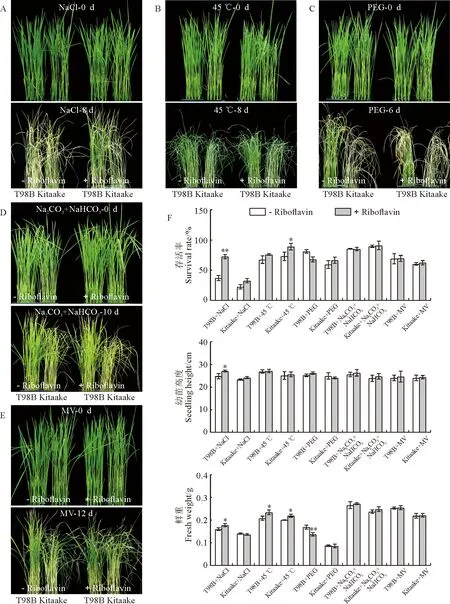
A~E. 生长14 d的粳稻Kitaake和籼稻T98B施加或不施加外源核黄素时分别进行盐(140 mmol/L的NaCl处理8 d)、高温(45 ℃处理8 d)、渗透(20% PEG处理6 d)、碱(50 mmol/L的NaHCO3+Na2CO3处理10 d)和氧化胁迫处理(4 μmol/L甲基紫精处理12 d)的表型分析;F. 籼稻和粳稻幼苗在不同胁迫处理下的存活率、幼苗高度和鲜重,其中的数值代表平均值±标准方差(n=40,t检验,*和**分别表示施加与不施加外源核黄素处理间在0.05和0.01水平存在显著性差异)。
在碱胁迫处理10 d后,Kitaake 和T98B均表现出胁迫表型,且施加外源核黄素对胁迫表型均没有影响(图1,D、F)。在氧化胁迫处理12 d后,Kitaake和T98B才表现出胁迫表型,且Kitaake受伤害更严重;施加外源核黄素对2个材料幼苗的胁迫表型均没有明显影响(图1,E、F)。这些结果说明,核黄素能明显改善水稻对盐和高温的耐受性,而对氧化和碱胁迫响应没有影响,反而提高了水稻对渗透胁迫的敏感性;同时,在逆境胁迫响应和外源核黄素作用效果方面,籼稻和粳稻亚种之间也存在一定程度的差异。总之,核黄素不同程度地参与了水稻非生物胁迫响应的调控。
2.2 非生物胁迫处理下水稻幼苗核黄素含量的变化
Kitaake和T98B水稻幼苗在盐、渗透、高温、氧化和碱等5种非生物胁迫处理后,分别在处理0,3,7 d取样检测各胁迫处理前后幼苗中核黄素的含量。检测结果表明在遭受5种非生物逆境胁迫后,粳稻Kitaake幼苗体内的核黄素含量均不同程度升高,尤其是在盐、渗透和高温胁迫下核黄素含量升高最为明显,在处理7 d时分别为未处理时的9,5,7倍(图2)。同样,籼稻品种T98B在遭受5种非生物胁迫后体内核黄素含量也呈不同程度的升高,但是在渗透和碱胁迫下的升高不显著(图 3)。以上结果说明,盐、高温和氧化等非生物胁迫均能显著促进水稻体内核黄素的合成和积累,渗透和碱胁迫也能不同程度促进核黄素的合成和积累,但是在籼稻和粳稻亚种间存在较大差异。值得说明的是,粳稻Kitaake的核黄素合成受逆境胁迫促进程度较籼稻T98B更为显著。因此,笔者猜测核黄素参与了水稻对这些非生物胁迫响应的调控。为了进一步研究核黄素参与胁迫响应的调控,后续研究主要聚焦于对促进核黄素合成最为显著的盐和高温胁迫。
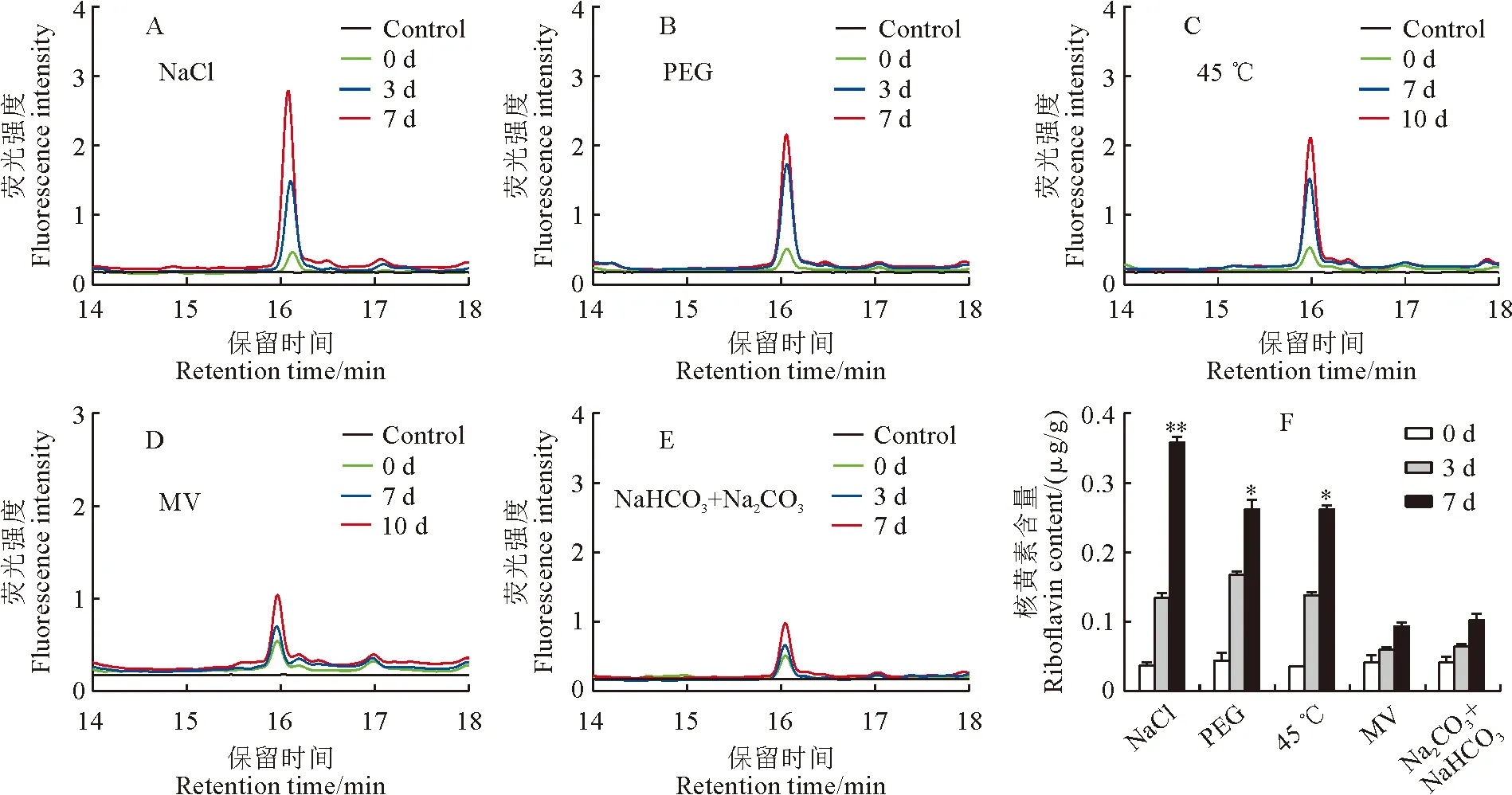
A~E. 盐(140 mmol/L的NaCl)、渗透(20% PEG)、高温(45 ℃)、氧化胁迫处理(4 μmol/L甲基紫精)和碱(50 mmol/L的NaHCO3+Na2CO3)处理下水稻幼苗体内核黄素荧光强度;F. 各个胁迫处理前后幼苗核黄素含量,其中的数值代表平均值±标准方差(n=3,t检验,* P <0.05,** P <0.01)。下同。
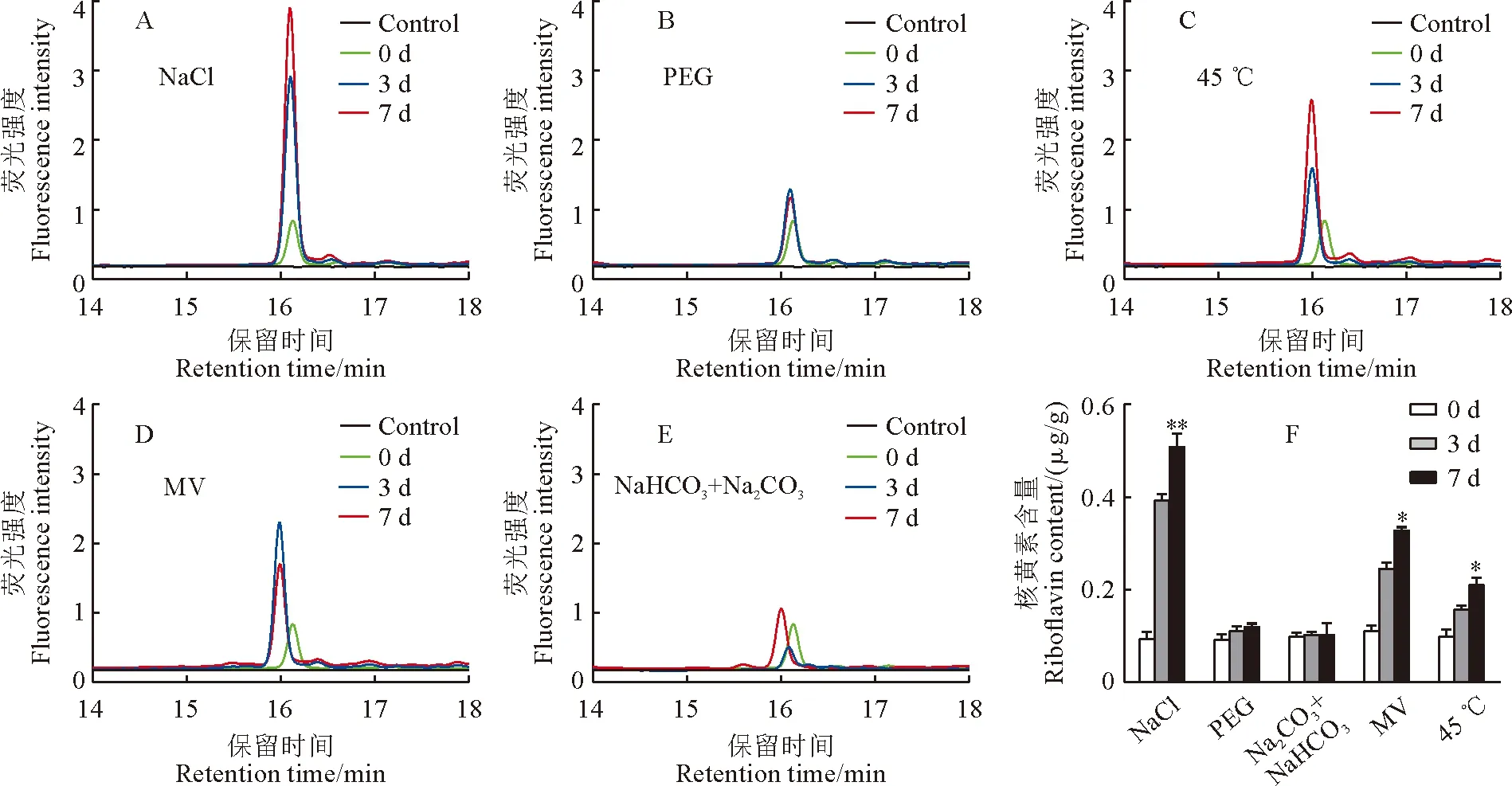
图3 籼稻T98B幼苗在不同非生物胁迫下核黄素荧光强度和含量变化
2.3 盐和高温胁迫对水稻核黄素合成相关基因表达的影响
通过生物信息学和序列同源性分析,笔者从水稻基因组中找到与核黄素合成代谢相关的8个基因(Os05g0460600、Os02g0572400、Os08g0481950、Os03g0117200、Os04g0177400、Os12g0541000、Os04g0497400、Os03g0801700)。其中,Os05g0460600、Os02g0572400和Os08g0481950编码ribA(鸟苷三磷酸合成酶);Os03g0117200和Os04g0177400编码ribD(5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮);Os12g0541000编码ribE(5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮-5′-磷酸);Os04g0497400编码ribH(6,7二甲基-8-核糖二羟基蝶啶);Os03g0801700编码FADs(FAD合成酶)。将Kitaake和T98B幼苗进行盐和高温处理7 d,然后测定8个核黄素合成相关基因在胁迫处理前后的转录水平。qRT-PCR结果表明,在盐和高温胁迫下水稻大部分核黄素合成相关基因的表达量均不同程度上调(图4)。
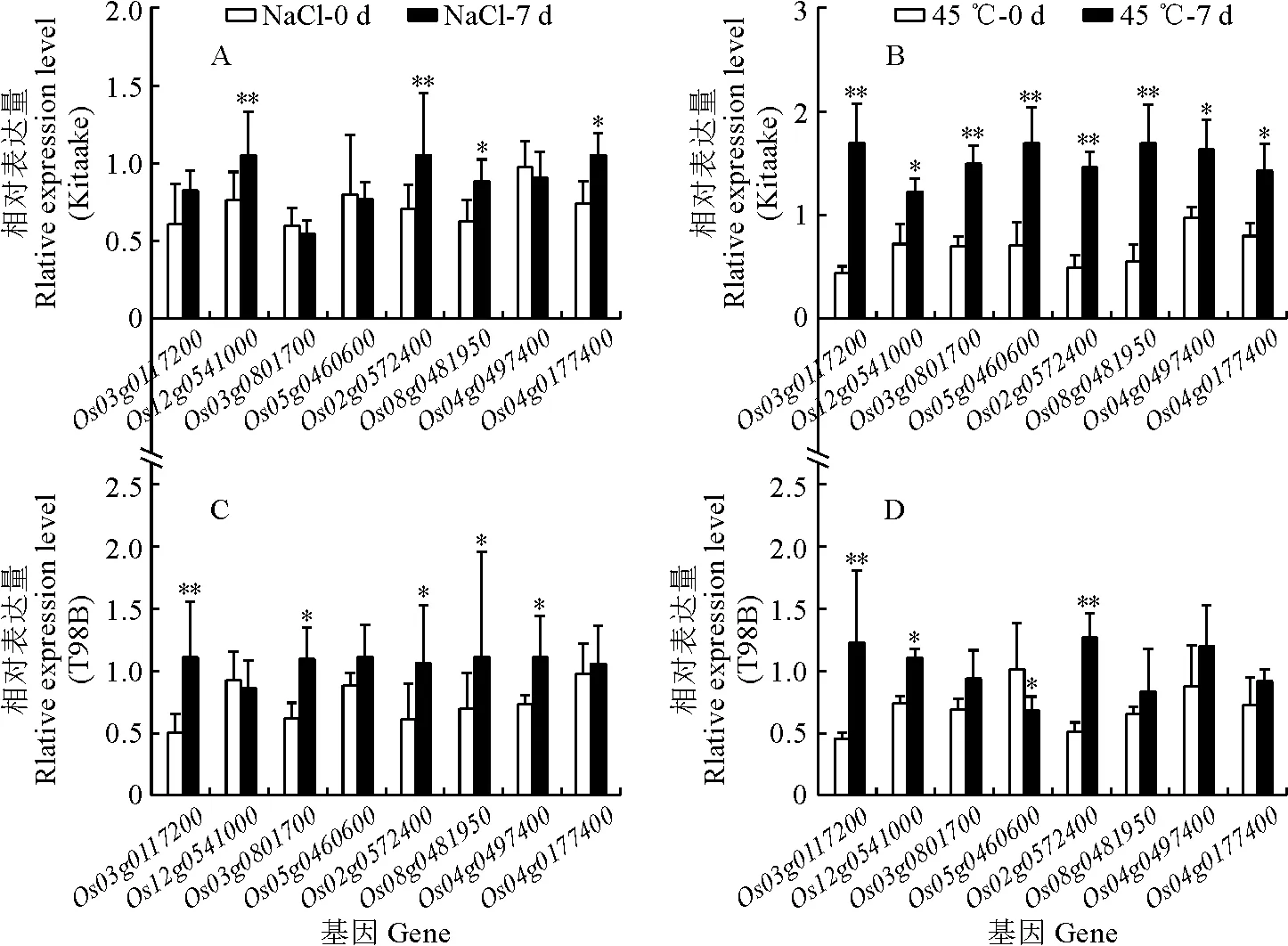
*和**分别表示处理前后在0.05和0.01水平有显著性差异。
其中,在高温胁迫下,Kitaake中8个基因均显著上调,而T98B中仅3个基因显著上调;在盐胁迫下,Kitaake和T98B中的上述基因表达变化趋势基本类似。这些结果说明,盐和高温胁迫能诱导核黄素合成基因的表达,从而促进核黄素在水稻体内的合成和积累。同时也可以看出,籼稻和粳稻在响应高温胁迫时,其核黄素合成基因的表达有明显差别,粳稻的上调幅度更大,说明粳稻对高温胁迫较籼稻更敏感。
2.4 核黄素对盐和高温胁迫下水稻幼苗生理变化的影响
水稻受到非生物胁迫后,体内一些基本的生理指标如相对电导率、MDA、H2O2含量以及过氧化氢酶(CAT)的活性等会出现紊乱,并能反映出植物体所受的伤害程度。Kitaake和T98B幼苗在盐和高温胁迫下这些生理指标测定结果(图5)表明,在未进行盐和高温处理时,水稻幼苗的相对电导率没有明显的差异;施加外源核黄素后,除了在T98B的高温胁迫中没有效果外,均能有效降低其余处理、水稻幼苗相对电导率(图 5,A、B)。同样,核黄素除了在T98B的盐胁迫中没有明显效果外,均能有效降低其余处理、材料幼苗的MDA含量(图 5,C、D)。这些结果说明,核黄素能有效降低盐和高温胁迫对细胞膜的伤害,提高水稻的逆境耐受性,且该结果与前面的幼苗存活率测定结果(图1,A、B和F)一致。
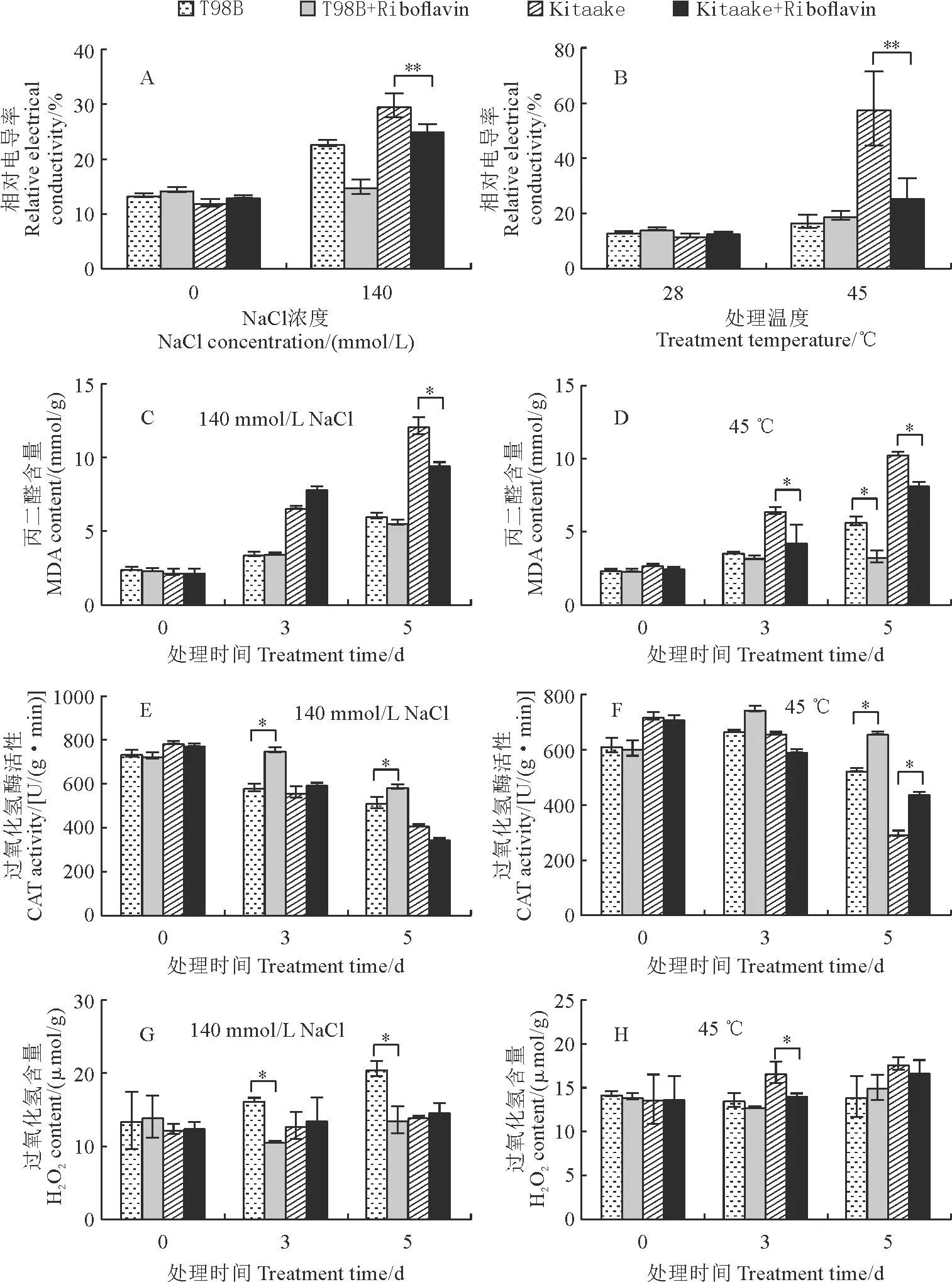
图5 水稻幼苗在140 mmol/L NaCl(C,E,G)和45 ℃高温(D,F,H)胁迫下生理指标的变化
另外,植物在逆境下会积累活性氧如H2O2,若不及时清除会导致严重的氧化损伤。过氧化氢酶在逆境H2O2的清除中起着重要作用。Kitaake和T98B幼苗过氧化氢酶活性和H2O2含量测定显示,核黄素能有效提高盐和高温胁迫下水稻体内的过氧化氢酶活性,并降低其体内H2O2含量(图 5,E~H)。
该结果说明,核黄素能提高水稻体内活性氧清除酶的活性,降低体内活性氧的积累,减轻或消除因盐和高温胁迫而导致的氧化损伤。总之,在盐和高温等逆境胁迫下,水稻通过促进体内核黄素的合成和积累来改善逆境胁迫的耐受性。
3 讨 论
植物本身可以合成核黄素,且主要以酶辅因子FMN和FAD的形式参与许多体内的生化过程[12-13]。Ouyang等[26]和Hedtke等[27]发现核黄素缺乏会导致拟南芥的叶色异常。最近,Hu等[19]发现核黄素影响水稻细胞分裂素的稳态和叶绿素的合成,进而调控叶绿体和叶色的形成。Tian等[20]发现核黄素通过协同线粒体能量代谢和细胞周期来调控玉米胚乳发育。本研究分析了外源核黄素对籼稻和粳稻响应盐、渗透、高温、氧化和碱等5种非生物胁迫的影响,同时分析了这些逆境胁迫对水稻体内核黄素合成的影响。研究发现,施加外源核黄素能够提高水稻对盐和高温胁迫的耐受性,且5种逆境胁迫均能不同程度地促进核黄素在水稻中的积累,尤其盐和高温胁迫的促进效果最明显。随后的qRT-PCR分析发现,盐和高温胁迫能显著诱导水稻幼苗中大部分核黄素合成相关基因的表达,进一步证实盐和高温胁迫能促进核黄素在水稻体内的合成和积累。值得指出的是,高温胁迫下核黄素合成基因的表达在粳稻中上调幅度更大,说明粳稻对高温胁迫较籼稻更敏感。在生产中,粳稻适于在北方温带地区栽培,而籼稻适于南方热带和亚热带地区栽培,就已说明粳稻较籼稻对高温更敏感,这与本研究结果高度一致。进一步的生理指标检测发现,核黄素能提高盐和高温胁迫下水稻体内的过氧化氢酶活性,并降低其体内H2O2含量。Hu等[19]最近也发现核黄素合成关键酶之一的二氧四氢喋啶合成酶的缺失,会导致水稻体内核黄素合成下降和活性氧积累。这些结果均说明,核黄素能通过促进体内活性氧的清除,消除氧化损伤,提高植物的逆境胁迫耐受性。
同时,核黄素对植物胁迫响应的影响存在较大差异。在研究中发现,核黄素能显著提高水稻的耐盐性,而对耐碱性没有影响。虽然在粳稻Kitaake中,碱胁迫也能一定程度提高核黄素合成基因的表达,但是外源核黄素并没有改良其耐碱性。笔者认为可能的原因与核黄素自身的理化性质有关。核黄素微溶于水且溶液易变质[28],在碱性溶液中或遇光变质,在盐溶液中溶解性提高。在盐胁迫下,由于核黄素溶解度提高,使其能充分参与调控盐胁迫响应,提高水稻耐盐性。在碱胁迫条件下,由于溶解度低或结构被破坏,从而无法参与调控碱胁迫响应。另外,笔者也推测在氧化胁迫条件下,可能造成了核黄素的结构破坏,使其无法在氧化胁迫响应中发挥作用。本研究中核黄素除了在盐胁迫下能改善T98B的幼苗高度外,对于其余处理幼苗高度的影响不明显,可能是核黄素的浓度还没有达到促进幼苗生长的程度。当然,这些猜测还有待进一步研究和证实。虽然渗透胁迫(模拟干旱)能促进核黄素在水稻体内的合成,但是外源施加核黄素却提高了水稻对渗透胁迫的敏感性,意味着核黄素负调控水稻的渗透或干旱胁迫耐受性。最近,Tian等[20]将玉米核黄素合成酶基因ZmRIBA1异源过表达于拟南芥,发现核黄素合成增加,并改善了转基因植株的渗透胁迫耐受性。这些结果说明,核黄素参与渗透或干旱胁迫响应的机制与其他非生物胁迫响应不同,而且在不同物种间还存在差异,但其背后的分子机制尚不清楚,仍需要进一步研究。
总之,本研究初步证实核黄素在水稻的非生物胁迫响应中发挥着重要作用。特别是发现,核黄素正调控水稻盐和高温胁迫的耐受性,而负调控渗透或干旱胁迫耐受性。该研究结果为进一步探究核黄素参与非生物胁迫响应的分子机制提供了线索,也为耐逆水稻的培育提供了启示。

