基于流式细胞术和SNP分型的猕猴桃倍性鉴定分析
吴 栋,王 瑀,周希希,杜佳宝,蒋景龙,张 羽*
(1 陕西理工大学 生物科学与工程学院,陕西省资源生物重点实验室,陕南秦巴山区生物资源综合开发协同创新中心,陕西理工大学 秦巴生物资源与生态环境省部共建国家重点实验室[培育],陕西汉中 723000;2 西北大学 生命科学学院,西安 710000)
猕猴桃属于猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl),全世界猕猴桃属植物共有54种21变种,约75个分类单元。中国分布有52种,其中中国特有44种[1]。猕猴桃营养丰富,果实富含膳食纤维、维生素、蛋白质和矿物质等,具有显著的经济效益[2],其维生素C含量极为丰富,被誉为“Vc之王”。
研究发现,高倍性猕猴桃果实中的Vc含量更高[3]。多倍体猕猴桃具有果实更大、产量更高、抗逆性更强等优点,被广泛用于育种和栽培[4]。秦巴地区是中国猕猴桃的最佳适生区之一,不仅野生资源丰富而且还是中国猕猴桃最有利用价值两大野生品系——中华猕猴桃变种和美味猕猴桃变种的交汇区,这里孕育了遗传基础极其丰富的野生猕猴桃资源。
当前野生资源的利用多集中于驯化选育,其结果造成大多数栽培品种同质化严重、丰产性抗病性一般、耐贮性差等。猕猴桃倍性育种技术可以提高育种效率和品种改良水平,改善品种质量,提升经济效益,为猕猴桃产业发展注入新动力[5]。
染色体是细胞遗传的物质基础,染色体数目的整倍和非整倍数变异是生物分类及育种的基础,通常用染色体压片技术来判断植物的倍性。刘昱希等[6]利用染色体压片技术对葫芦科植物幼嫩子房壁进行染色体倍性鉴定。
但利用压片技术只能判断低倍性的物种[7],对于染色体数目多、形态小、多酚多糖次生代谢物质多、属内不同物种倍性复杂的植物,通过染色体压片技术也难以鉴定其倍性。如猕猴桃属内不同物种倍性包括偶数和奇数倍从二倍体到十倍体都有[8-12],导致其分类结果也多种多样[13],且由于其染色体基数多(x=29),其倍性的准确鉴定严重制约了相关生物学问题的发展。
流式细胞术被广泛用在免疫荧光检测、细胞周期检测及细胞分选等领域,在动物和微生物中应用较多[14]。由于植物组织和细胞的特殊性,难以获得适合流式细胞仪的完整细胞核悬浮液,流式细胞术在植物上的利用明显少于动物和微生物,尤其是多倍化明显的植物,容易造成细胞核悬浮液中核黏连、细胞核易破裂、杂质多等问题,甚至导致只有杂质峰出现,目标峰不易出现的现象。
1983年Galbraith等[15]率先将流式细胞术应用于植物细胞核DNA含量检测和植物倍性鉴定,其荧光信号的强弱可以代表细胞核中的DNA含量,用估计DNA含量而间接判断植物倍性。随后该技术被大家所接受[16-17]。施春晖等[18]通过流式细胞仪对不同倍性猕猴桃核DNA含量进行测定,不同品种间DNA含量有一定的差别,但对于同一猕猴桃品种其倍性鉴定有争议[19-20]。
SNP位点杂合子等位基因深度比率分布利用不同倍性物种全基因组SNP位点杂合子等位基因深度比率分布峰的数目和比率值范围判断被测样本的倍性。
如二倍体的SNP位点杂合子比率为0.5,三倍体为0.33和0.67,四倍体为0.25、0.5和0.75,五倍体为0.2、0.4、0.6和0.8,六倍体为0.17、0.33、0.5、0.67和0.83,七倍体为0.14、0.29、0.43、0.57、0.71和0.86,八倍体为0.13、0.25、0.38、0.5、0.63、0.75和0.88,它们依次在比率值范围处有1、2、3、4、5、6和7个峰。
随着二代测序的广泛利用,利用GBS(genotyping-by-sequencing)方法即可获得一套数目不多的全基因组SNP[21],但多倍体植物的基因组组装一直是科研人员研究的难点。目前为止,公共数据库只有二倍体的猕猴桃雌株有参考基因组。陈广凤等[22]以猕猴桃雌株组装的模拟基因组为参考,对不同基因型的SNP杂合子等位基因深度比率分布作图来判断倍性。
本研究通过对流式细胞术和全基因组SNP位点杂合子等位基因深度比率分布鉴定倍性方法的探索,分析适合猕猴桃的倍性鉴定方法,为相关生物学问题研究提供参考。
1 材料和方法
1.1 流式细胞术倍性鉴定
1.1.1 植物材料
猕猴桃幼嫩叶片于2022年4月22日取自陕西果业集团有限公司汉中猕猴桃研发中心(N33°10′15″,E106°43′16″),用湿润的滤纸包裹叶片置于冰盒中带回,放入4 ℃冰箱保存,保存时间最好不超过3 d。
1.1.2 裂解液配制
(1)裂解缓冲液A:10 mmol/L MgSO4,50 mmol/L KCl,3.5 mmol/L HEPES(2%、5%、7%),聚乙烯吡咯烷酮30(2%、5%、7%),3%(V/V) Triton X-100,用1 mol/L NaOH调至pH 8.0,4 ℃冰箱预冷。(2)缓冲液B:10 mmol/L MgSO4,50 mmol/L KCl,3.5 mmol/L HEPES,5%(V/V)聚乙烯吡咯烷酮,3%(V/V)Triton X-100,0.04 mg/mL RNA酶,用1 mol/L NaOH调至pH 8.0,4 ℃冰箱预冷(表1)。
1.1.3 荧光染料
植物中常使用非特异性PI(碘化丙啶)染料,用PBS缓冲液溶解PI(0.4 mg/mL)。由于PI可使DNA和RNA同时发出荧光,因此,可以加入适量的RNA酶排除RNA干扰[23-25]。
1.1.4 准备制备液
取1 g左右的幼嫩叶片,置于盛有清水的培养皿中清洗表面的尘土,吸去叶片表面多余水分。
将叶片放入另一个预冷的培养皿中,加入提前预冷的裂解液A浸没叶片。立即用干净的锋利刀片切碎叶片组织,将叶片切成非常小的碎片,操作中可适当倾斜培养皿,使叶片组织始终处于集中状态,静置5 min使细胞核游散出来。用过滤网过滤几次裂解的细胞液,以除去细胞碎片和大碎片组织,至1 mL离心管中,1 000 r/min转速离心5 min后去除上清,加入缓冲液B重新悬浮细胞核。
1.1.5 观察制备液效果
用PI避光染色制备液15 min后,倒置在荧光相差显微镜(德国Leica,型号DFC450C)下观察,根据观察结果优化试验影响因素。
1.1.6 流式细胞术鉴定
PI染色的制备液在24 h之内都可采用流式细胞仪(BD FACSVerse)进行倍性检测,以‘红阳’品种(2n=2x=58)为对照,将采集的数据用FIowJO软件可视化判断倍性。
1.2 基于SNP位点杂合子等位基因深度比率鉴定倍性
共51个猕猴桃样本(25雌株,26雄株)用于GBS(genotyping-by-sequencing)测序,测序由北京诺禾致源生物有限公司Illumina2000测序平台承担(表2)。
利用GBS-SNP-CROPv4.1软件[26-31](https://github.com/halelab/GBS-SNP-CROP)提供的脚本构建模拟基因组和51个不同基因型个体的SNPs分型,SNP位点杂合子等位基因深度比率分布用R可视化作图。
2 结果与分析
2.1 基于流式细胞术的倍性鉴定
2.1.1 不同生长状态的叶片试验结果
研究表明,完整植物游离细胞核的获取主要取决于叶片的生长状态,图1显示老叶(直径约5 cm)、中等大小叶片(直径约3 cm)和未展开幼嫩叶片提取的细胞核,结果表明足够幼嫩的叶片提取的完整游离细胞核数目较多。

A.直径约5 cm叶片;B.直径约3 cm叶片;C.未展开幼嫩叶片。
2.1.2 不同PVP浓度试验分析
猕猴桃叶片中存在大量的酚类、糖类等次生代谢物质,生长时间越长的叶片越多,导致样品提取液的粘性较高,加入适量浓度的PVP(聚乙烯吡咯烷酮)可以减少细胞核黏连,促进核染料进入细胞核,图2,A显示虽然已经获得较多数量的完整细胞核,但粘性物质太多阻止了核染料进入细胞核(图2,B)。用2%、5%和7%浓度PVP在500目下过滤3次,结果(图3)表明5%的PVP即可达到流式细胞仪判断倍性时上样的要求,PVP浓度增加到7%时效果与5%的相比并不明显。

A.未染色(白光);B. PI染色后(荧光)。
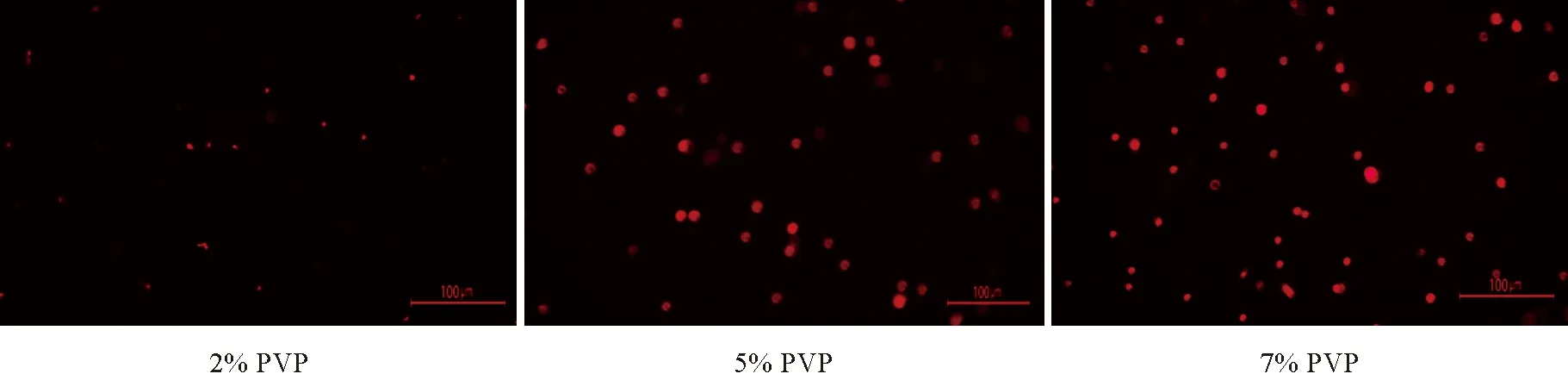
图3 使用不同浓度PVP准备的核制备液
2.1.3 不同滤网目数及过目次数试验结果
流式细胞仪使用过程中,要尽量减少杂质的影响因素,探究滤网目数可以过滤掉碎片和黏连较严重的细胞核群。经过荧光染料染色后,在5% PVP过滤3次的同等条件下使用200目、300目和500目的滤网过滤待测液。
结果表明:200目和300目相对于500目的滤网过滤后的滤液中含有较多杂质,500目滤网过滤后含有较少的杂质,游离的完整的细胞核数目较多(图4)。

图4 不同目数的滤网过滤的制备液
由于是用物理方法切碎叶片获取制备液,会产生较多的碎片,容易造成流式细胞仪的上样管堵塞及杂质峰以主峰形式出现,不利于结果的分析。在5% PVP+500目的滤网的同等条件的情况下对比过目3次、4次和5次,结果表明:过目3次后增加过目次数效果并不明显(图5)。

图5 不同过滤次数过滤的制备液
2.1.4 倍性鉴定结果
以已知倍性的二倍体‘红阳’品种为对照(标准化可以是外部的,也可以是内部的,本研究采用内标法),调整电压,使其相对荧光强度值的目标峰出现在约50 K处,而疑似四倍体DNA含量的峰值相对值约为100 K,疑似六倍体DNA含量的峰值相对值约为150 K(图6)。‘翠香’品种经过60Co-γ照射峰值对应的横坐标为150 K,与对照样本的比值为3.00,估计为六倍体。
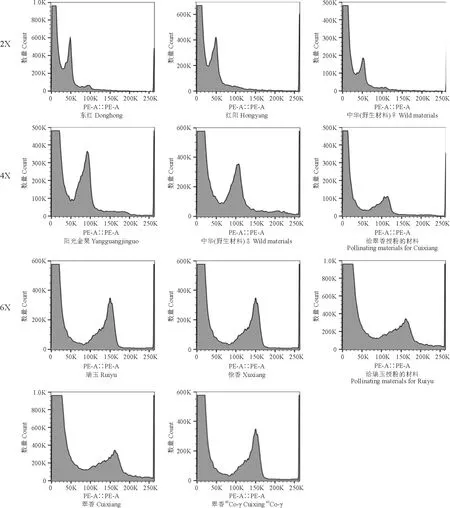
图6 流式细胞术鉴定的部分猕猴桃染色体倍性直方图
2.2 基于全基因组SNPs杂合子频率分布的倍性鉴定
SNP的分型主要与模拟基因组的组装质量(如其中每个核苷酸一致性取值参数选用)和过滤识别SNP的参数设置有关,本试验中使用GBS-SNP-CROP流程组装模拟参考基因组(Mock Reference,MR),然后用建立好的MR进行序列比对,生成变异体矩阵文件,过滤SNP。对该命令的参数进行调节(perl./soft/GBS-SNP-CROP-v.4.1/GBS-SNP-CROP-4.pl-in MasterMatrix.txt-out GenoMatrix.txt-indel-mnHoDepth0 5-mnHoDepth1 20-mnHetDepth 3-altStrength 0.8-mnAlleleRatio 0.25-mnCall 0.75-mnAvgDepth 3-mxAvgDepth200),其中-mnHoDepth参数含义是当替代等位基因深度等于0 时调用纯合子所需的最小深度,对于二倍体物种该参数设置为5,四倍体物种设置为11,六倍体物种设置为17,八倍体物种设置为23;-mnHoDepth1参数含义为当替代等位基因深度等于1时调用纯合子所需的最小深度,二倍体时参数为20,四倍体时参数为48,六倍体时参数为76,八倍体时参数为104,-mnHetDepth参数含义是调用杂合子时每个等位基因所需的最小深度,二倍体时参数为0.25,四倍体时参数为0.1,六倍体时参数为0.063,八倍体时参数为0.045;-altStrength参数含义是对于给定的推定双等位基因变体,在整个群体中,该替代等位基因强度参数是作为次要等位基因的非主要等位基因读数的最小比例,二倍体时参数为0.962,四倍体时参数为0.969,六倍体时参数为0.862,八倍体时参数为0.860。
根据不同倍性材料生成下游分析文件[29]。理论上Reads在模拟基因组上的覆盖率越大,其组装的基因组质量可信度越高,根据GBS-SNP-CROP提供的构建模拟基因组的方法,即全部雌株样本、随机挑选5个雌株样本和Reads数最多的雌株样本构建,生成的所有杂合子基因座的等位基因深度频率矩阵(GSC.HetFreq.txt)可以使用R脚本进行可视化,生成等位基因深度分布图,可以深入了解单个基因型的倍性水平。
最后利用GBS-SNP-CROP提供的R脚本PloidyVisualizer.R(R V3.6.2)进行可视化展示,研究发现调整参数只是影响了SNP位点杂合子等位基因深度比率分布峰图的形状,但峰值范围没有受到影响(图7)。

图7 不同倍性猕猴桃全基因组SNP位点杂合子等位基因深度比率分布
3 讨 论
本研究对具有染色体数目多、形态小、细胞质浓、次生代谢产物多、倍性复杂的猕猴桃植物,在利用常规压片技术判断倍性难度较大的情况下,优化了一套适合流式细胞术倍性鉴定和全基因组SNP位点杂合子等位基因深度比率分布的方法。从理论上讲,细胞、原生质体和细胞核都可以用估算DNA含量的方法判断倍性,但因为植物的完整细胞或原生质体的大小可能接近或超过流式细胞仪的流动室孔的直径[32],且质膜对大多数DNA荧光色素的渗透性低等其他因素的影响,导致利用细胞核估算DNA含量成为了较为合理的方法,其关键技术在于完整的足够数量的游离细胞核的制备,研究发现足够幼嫩的叶片才是获得完整而数目多细胞核悬浮液的基础,且充分切碎成糊状样以保证有足够多的细胞核游离出来。其次,去除多酚多糖等粘性物质是保证细胞核不黏连和染料能充分进入细胞核DNA的前提,这样才能客观反映不同倍性的个体其DNA含量的变化。再次,根据植物细胞核的大小范围选择合适的滤网和过滤次数,减少杂质含量保证制备液中细胞核的浓度,上样前最好用显微镜观察以便优化试验影响因素。最后,最好将二倍体对照样本的目标峰的荧光通道值大小调整到成倍数的数值处,以利于多倍体倍数的判断。虽然不同的植物组织需要探索不同的解离液配方,没有某种解离液能完全适应所有植物[33],但只有了解解离液的主要目的和各种物质在其中发挥的作用,如解离液主要起破碎细胞的作用、PVP防止植物酚类物质带来的细胞核黏连、且维持一定的渗透压防止细胞核破裂而游离出完整的细胞核[34-35],才能针对试验中出现的各种现象进行方法改良。
随着高通量测序技术的发展,全基因组SNP数据的应用越来越广泛,利用GBS技术即可达到研究目的。本研究不需要以染色体水平组装全基因组,避免了多倍体植物基因组组装的不易,只需利用GBS技术产生的全部Reads组装成1个模拟参考基因组,通过对SNP分型即可计算SNP位点杂合子等位基因深度比率分布,然后根据不同倍性的植物其SNP具有不同的分布峰个数和峰值范围来判断倍性。在调整SNP calling过程中的参数研究发现,合适的参数范围只是影响了不同倍性SNP位点杂合子等位基因深度比率分布峰的性状,但比率分布对应的范围值和峰的数目没有变化。本研究建立的2种方法可以运用在属内倍性复杂及叶片次生代谢产物多的其他植物的染色体倍性鉴定上。其中,流式细胞术简单、成本低,但对样本制备要求相对严格。全基因组SNP分型成本高,但同时可以研究许多生物学问题,如演化、分类、群体结构和遗传多样性分析、遗传图谱构建等。本研究鉴定的中华猕猴桃变种多为二倍体和四倍体,其中红心猕猴桃为二倍体,黄肉猕猴桃为四倍体。美味猕猴桃变种多为六倍体,与前人研究结果[36-38]一致,也许倍性差异与其果肉颜色变化有一定关联。对六倍体猕猴桃植物经过60Co-γ照射前后倍性研究表明,辐射没有引起猕猴桃染色体倍性的改变。
全基因组SNP分型进行倍性鉴定可以与流式细胞术倍性鉴定结果相互验证,提高倍性判断的准确性,为植物学基础研究和育种工作提供参考。

