水杨酸对干旱胁迫下西洋参不定根生化指标和药用成分含量及相关基因表达的影响
卢 超,陈景鲜,王国霞,邓培渊,2,李春阁,孙晓童
(1 郑州师范学院 生命科学学院,郑州 450000;2 郑州市生物物种资源研究中心,郑州 450000)
西洋参(PanaxquinquefoliusL.)为五加科人参属多年生草本植物,中医临床上常用于气虚阴亏、虚热烦倦等症,具有补气养阴、清热生津等功效[1]。西洋参中有多种具有生物活性的化学成分类型,包括多糖类、皂苷类、有机酸类、黄酮类和挥发油类等[1]。自1975年在北京等地引种成功以来,西洋参在中国多个省份已有大面积种植,中国已成为全球西洋参三大主产国之一[2]。干旱胁迫是制约大多数药用植物产量和品质的一个重要逆境因素[3-4]。在面对干旱胁迫时,这些植物往往会通过渗透调节物质的积累、提高抗氧化酶类活性和改变次生代谢产物合成等应答机制来减轻伤害,从而增强植物自身的抗旱性[5]。如西洋参幼苗在遭受水分胁迫时,能通过提高体内脯氨酸含量,增强植株的抗氧化酶活性及抗氧化物含量共同来提高其抗胁迫能力[6]。燕麦在重度干旱胁迫下,叶片中的丙二醛(MDA)含量以及超氧化物歧化酶(SOD)等抗氧化酶活性显著提高,叶片的总抗氧化能力增强[7]。
邻羟基苯甲酸又称水杨酸(SA)是高等植物体内广泛存在的一类小分子酚类化合物,在植物生长过程中广泛参与相关生理代谢过程[8]。作为一种内源性信号分子,许多研究表明SA在植物相应逆境信号胁迫和次生代谢产物生物合成过程中也发挥着重要作用[8-10]。在干旱胁迫下,外源SA处理桔梗幼苗叶片中的抗氧化酶活性明显提高,MDA含量增加,说明外源SA能有效提高桔梗的抗旱能力[4]。人参在春季和秋季喷施SA可以增加人参皂苷含量和植株的净光合速率,起到提高人参质量的目的[11]。此外,添加外源水杨酸会导致西洋参发状根中抗氧化酶活性发生明显变化,多个与人参皂苷合成的关键酶基因表达量上升,最终使得人参皂苷合成上调[12]。但SA是否在参与西洋参调节抵御干旱胁迫的同时,会参与次生代谢产物积累和功能基因的调控,目前尚不清楚。结合本实验室前期已克隆的多个参与人参皂苷生物合成的关键酶基因,及可能参与次生代谢产物调控的转录因子,本研究用10%的PEG-6000模拟干旱胁迫,培养7 d后添加不同浓度的外源水杨酸处理,对不同处理下西洋参不定根中渗透调节物质的含量和保护酶活性进行比较,检测有效成分黄酮和皂苷类化合物的积累以及参与人参皂苷合成途径的关键酶基因和转录因子的基因表达量变化,为解析外源SA响应西洋参干旱胁迫调节的分子机制提供理论依据。
1 材料和方法
1.1 试验材料和试剂
西洋参不定根为本实验室所诱导并传代[13]。植物RNA提取试剂盒(9769)、反转录试剂盒(6210A)购自宝生物工程(大连)有限公司,荧光实时定量试剂盒(PC3302)购自北京艾德莱生物科技有限公司,PEG-6000和SA购于生工生物工程(上海)股份有限公司,人参皂苷Re(J10N11A130576)、人参皂苷Rb1(G01O11Y126429)单体对照品购于上海源叶生物科技有限公司,纯度大于98%。乙腈、甲醇为色谱纯,水为超纯水,其他试剂为国产分析纯。
1.2 材料培养与处理
选取在23 ℃、110 r/min液体培养下生长良好的西洋参不定根,振荡培养生长21 d后按每100 mL液体培养基10 g的比例添加PEG-6000(质量分数为10%)并培养7 d。添加过滤除菌的SA使其终浓度分别为0(S0),10(S10),40(S40),80(S80)μmol/L,每个浓度处理3瓶并重复3次,分别在SA处理0,2,4,6,8 d取不定根样品进行相关指标测定。处理结束后样品用无菌水冲洗并分为3份:一份吸干水分后进行脯氨酸、丙二醛(MDA)含量以及过氧化氢酶(CAT)、过氧化物酶(POD)活性检测;一份在55 ℃条件下烘干至恒重进行黄酮和皂苷含量的测定;剩余一份用于qRT-PCR检测。
1.3 观测指标及方法
1.3.1 生理指标
取0.5 g不定根样品置于预冷研钵,加入pH 7.0磷酸盐缓冲液匀浆并用缓冲液定容到5 mL,离心取上清为待测粗酶液。CAT活性以1 min内A240值下降0.1记为1个酶活性单位(U)。POD活性用愈创木酚法进行测定,以1 min内A470值改变0.01为1个酶活单位(U)。MDA含量采用硫代巴比妥酸法进行测定。脯氨酸含量采用磺基水杨酸提取,用酸性茚三酮法进行测定。每个样本重复测定3次。
1.3.2 药用成分含量
将烘干的不定根粉碎经60目筛网过滤,脱脂脱色后,使用硝酸铝-亚硝酸钠-氢氧化钠法进行总黄酮含量测定[14]。样品中总黄酮以芦丁当量(rutin equivalent,RE)表示,单位为mg RE/g DW。取0.5 g左右脱脂脱色后的不定根粉末,按1∶20的比例加入水饱和正丁醇超声提取1 h,蒸干滤液后用甲醇回溶,定容至2 mL进行皂苷含量测定。采用单体皂苷Re为标准品,使用香草醛-高氯酸-浓硫酸法进行样品中总皂苷的测定。采用高效液相法分析样品中单体皂苷Re、Rb1含量,色谱柱使用Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm),流动相使用0.005%甲酸水和0.005%甲酸乙腈,洗脱程序参加前期摸索方法[13],检测波长为203 nm,柱温为30 ℃,流速为1.0 mL/min,每个样品重复测定3次。
1.3.3 qRT-PCR检测基因表达量
提取不定根总RNA并通过1%琼脂糖凝胶电泳检测完整性,用微量核酸定量分析仪检测浓度。合成cDNA,对内参GAPDH、6个西洋参中人参皂苷合成途径关键酶基因(Pq-3-O-UGT2、Pq-3-O-UGT1、Pq-D12H、Pq-HMGR、Pq-DS、Pq-CYP6H)和2个西洋参bHLH转录因子(Pq-bHLH24和Pq-bHLH25)进行qRT-PCR扩增。采用20 μL扩增体系,具体引物序列见表1。反应程序采用3步法,进行40个循环,PCR扩增结束后利用1%琼脂糖凝胶电泳检测PCR产物。以GAPDH为内参,采用2-ΔΔCT法计算转录因子的相对表达量,每个样本重复测定3次。

表1 试验用到的引物
1.4 数据处理
使用Excel 2019进行数据整理,利用SPSS 22.0对数据进行统计与显著性分析,后期使用Photoshop CC进行图片排版处理。
2 结果与分析
2.1 外源SA对PFG-6000胁迫下西洋参不定根抗氧化酶活性的影响
首先,在PFG-6000模拟的干旱胁迫下,随着处理时间的延长,西洋参不定根中的CAT活性在S0处理下呈缓慢上升趋势,在第8天时约为0 d时的1.37倍,而在不同浓度的SA处理(S10、S40、S80)后总体均呈现先上升后下降的趋势,并均在SA处理第4天时达到最大值(图1,A)。其中,在SA处理第4天时,西洋参不定根中CAT活性随着SA处理浓度的升高而增加(S80>S40>S10>S0),S80分别是S40、S10、S0的1.12,1.74,2.79倍。以上结果说明西洋参不定根中的CAT活性在各浓度外源SA处理第4天时均能得到明显提高,并以80 μmol/L SA处理效果最佳。
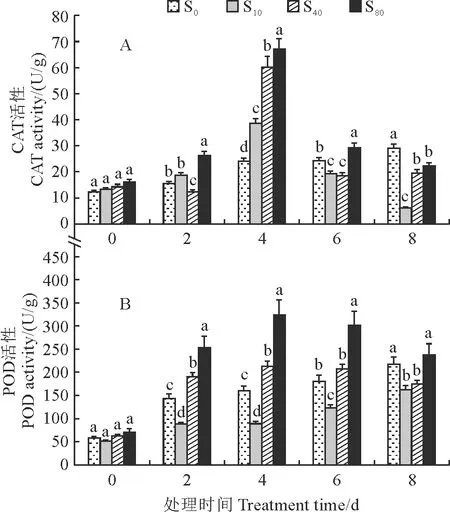
S0、S10、S40、S80 分别表示0,10,40,80 μmol/L的SA处理。同期不同小写字母表示处理之间在0.05水平存在显著性差异。下同。
其次,在PFG-6000模拟的干旱胁迫下,随着处理时间的延长,西洋参不定根POD活性在S0、S10处理下均逐渐上升,而在S80和S40处理下均呈现先上升后下降的趋势,并均在处理第4天时达到最大值(图1,B)。其中,不定根POD活性在SA处理6 d内始终表现为S80>S40>S0>S10,在处理第8天时则表现为S80>S0>S40>S10处理,即S80处理始终最高,S10处理始终最低;在处理 4 d时,S80处理分别是S40、S0、S10处理的1.52倍、2.03倍和3.64倍。这说明较高浓度的外源SA有利于增强干旱胁迫下西洋参不定根中的POD活性,但较低水平的外源SA反而有抑制作用。
2.2 外源SA对PFG-6000胁迫下西洋参不定根中MDA和游离脯氨酸含量的影响
由图2,A可知,随着干旱胁迫时间的增长,西洋参不定根中的游离脯氨酸含量在S0处理中呈现缓慢上升趋势,而在S80和S40处理中始终高于同期S10和S0处理,S10处理除第8天外也均高于同期S0;S80处理游离脯氨酸含量在第6天时达到峰值(29.08 μg/g),分别是S40、S10和S0处理的1.16倍、1.49倍和2.45倍。而在处理第8天时,3个外源SA处理的游离脯氨酸含量都低于相应的第6天检测值,结果说明在0~8 d内添加10~80 μmol/L的外源SA都可以增加西洋参不定根中的游离脯氨酸含量。
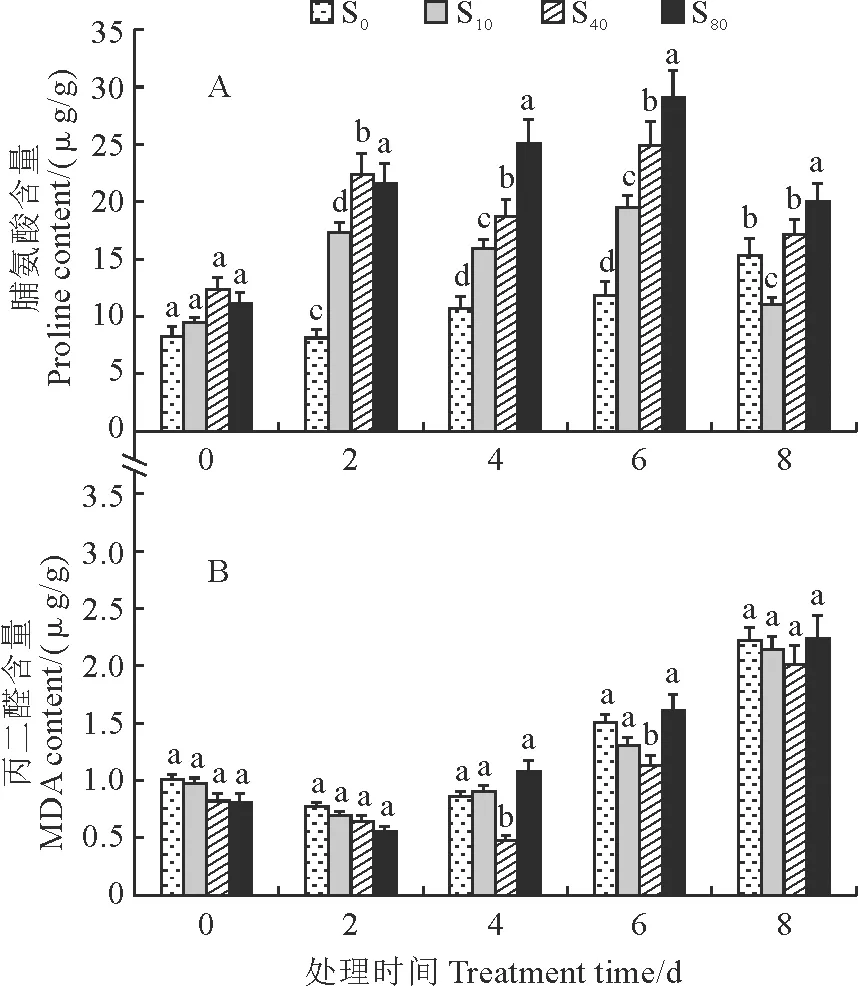
图2 外源SA处理对PFG-6000胁迫下西洋参不定根中MDA和游离脯氨酸的影响
同时,图2,B显示,当不同浓度的外源SA处理后,西洋参不定根中的MDA含量均随着处理时间延长呈现先下降后上升的趋势,且同期处理之间大多比较接近。其中,在SA处理第4天时,不定根中的MDA含量在S40处理中达到最低点(0.65 μg/g),且与其余处理均存在显著差异;在SA处理第4天以后,各处理组MDA含量均呈现上升趋势,而S80与S10和S0处理之间始终无显著差异。这一检测结果表明外源40 μmol/L SA能有效降低干旱胁迫下西洋参不定根中膜脂过氧化物的积累,减少细胞氧化损伤。
2.3 外源SA对PFG-6000胁迫下西洋参不定根中黄酮和皂苷类物质的影响
首先,黄酮类化合物是植物中分布较广的一类重要次生代谢产物。在不同浓度的外源SA处理后,西洋参不定根中的黄酮含量总体都呈现上升趋势,并在处理4~8 d多与S0差异显著(图3,A)。其中,在处理到第6天时,西洋参不定根中黄酮含量表现为S80>S40>S10>S0,各SA处理均与S0差异显著,S80处理不定根中黄酮含量达到峰值(1.22 mg/g),分别是同期S40、S10、S0处理的1.03倍、1.22倍和1.32倍,而S80与S40之间无显著差异。这说明外源40,80 μmol/L SA处理第6天时能有效提高西洋参不定根中黄酮类物质的含量。
其次,人参皂苷是西洋参等人参属植物重要的药理活性物质。由图3,B可知,经过40 μmol/L的外源SA处理后,S40、S10、S0处理西洋参不定根中的总皂苷含量均随着处理时间延长呈现逐渐上升趋势,在处理第8天达到最大值,而S80处理则在第6天达到最大值,第8天时有所降低;各浓度SA处理不定根中的总皂苷含量在第4~8天均显著高于同期S0(P<0.05),并表现为S40>S80> S10>S0。其中,S40处理总皂苷含量在第8天时达到最高点(33.16 mg/g),并显著高于其余处理,是此时S0的1.25倍。以上结果说明添加外源SA可显著提高西洋参不定根中总皂苷含量,但80 μmol/L的外源SA长时间处理时促进效应降低。
再次,单体皂苷Rb1和Re分别是西洋参中原人参二醇和原人参三醇型皂苷含量的代表。由图3,C可知,西洋参不定根中单体皂苷Rb1含量在S40处理到第4~8天时均显著高于同期S0和其余处理,并于第6天时达到最大值(25.42 mg/g),此时比S0(17.21 mg/g)显著提高47.70%(P<0.05);S80处理仅在第8天时显著高于S0,S10处理则始终与S0无显著差异。说明适量添加外源SA能够提高西洋参不定根中Rb1皂苷生物合成途径的能量流走向。而在第8天时,S40处理不定根的单体皂苷Rb1含量(23.44 mg/g)反而比第6天明显降低。这可能是由于Rb1皂苷继续参与西洋参中其他原人参二醇型单体皂苷的生物代谢,因此并不能持续积累Rb1单体皂苷。不定根中单体皂苷Re含量在S40处理到第6~8天显著高于同期S0和其他处理,在第8天时达到最大值(10.62 mg/g);S80处理在第4~6天时显著高于S0(P<0.05),而S10处理始终与S0无显著差异(图3,D)。
2.4 外源SA对PFG-6000胁迫下西洋参不定根中皂苷代谢相关基因表达的影响
利用软件设计内参基因GAPDH,6个西洋参中人参皂苷合成途径关键酶基因(Pq-3-O-UGT2、Pq-3-O-UGT1、Pq-D12H、Pq-HMGR、Pq-DS、Pq-CYP6H)和2个西洋参bHLH转录因子(Pq-bHLH24和Pq-bHLH25)的开放阅读框进行qRT-PCR扩增。结果表明,扩增片段在100~300 bp之间,且引物扩增特异性良好;抽取S80处理单次扩增结果进行核酸电泳检测,电泳结果也显示各引物的扩增效率良好,条带单一清晰(图4)。

M. DL2000 分子量标准;1. Pq-bHLH24;2. Pq-bHLH25;3. Pq-3-O-UGT2;4. Pq-3-O-UGT1;5. Pq-D12H;6. Pq-HMGR;7. Pq-DS;8. Pq-CYP6H;9. GAPDH。
表2显示,3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是植物体内萜类化合物生物合成过程中的重要关键酶,而达玛烯二醇合成酶(DS)是控制人参皂苷环化的关键酶。Pq-HMGR基因相对表达量在S10处理第2,4天以及S40和S80处理第2天都比S0组显著升高,并在S40处理第2天达到最大值,是S0组的3.11倍,且与其余处理组和处理时间存在显著差异(P<0.05)。Pq-DS基因相对表达量在S10处理第2天和及S40处理第2、4天都比S0组显著升高,并在S40处理第2天达到最大值,是对照组的3.74倍,且与其余处理组和处理时间存在显著差异(P<0.05)。HMGR和DS基因表达量的显著升高,说明代谢流的明显增加,进而促进了人参皂苷的生物合成。同时,Pq-CYP6H和Pq-D12H是CYP450基因家族控制羟基化反应的关键酶基因。Pq-CYP6H基因相对表达量在S10和S80处理第2天以及S40处理第2天都比S0组显著升高,并在S40处理第2天达到最大值,是S0组的1.55倍;Pq-D12H基因表达量仅在S40处理第2天都比S0组显著升高,是对照组的1.78倍,都与其处理组合处理时间存在显著差异(P<0.05)。另外,糖基转移酶Pq-3-O-UGT1基因的转录水平在S10、S40和S80处理第2天都比S0组显著升高,并在S80处理到第2天时达到最大值,是S0组的1.64倍,说明Pq-3-O-UGT1基因收到SA信号时存在应答影响;而Pq-3-O-UGT2基因在受到SA刺激时,并未表现出明显的转录水平升高。

表2 外源SA处理对6个关键酶基因和2个转录因子基因表达量的影响
此外,外源添加SA后,转录因子Pq-bHLH25存在应答响应,在S10和S40处理诱导到第2天时达到最大值,是S0组的1.71倍,显著高于其余处理组合处理时间;而Pq-bHLH24基因的转录水平虽然在S40处理诱导到第2天时有最大值,但变化并不显著(P>0.05)。西洋参不定根中皂苷代谢相关基因表达量在不添加SA条件下(S0)始终无显著变化。可见,西洋参不定根中皂苷代谢相关基因Pq-HMGR、Pq-DS、Pq-CYP6H、Pq-D12H、Pq-3-O-UGT1Pq-bHLH25相对表达量大多在外源40 μmol/L SA处理第2天时达到最大值,显著高于其余处理组合处理时间,Pq-3-O-UGT2、Pq-bHLH24表达量则无显著变化。
3 讨 论
许多研究表明,水分、温度、光照和激素等非生物信号在人参属植物的生长发育和药用成分的生物合成过程中发挥着重要作用[15-16]。在本研究不加SA的对照组实验数据中显示,低浓度的PEG模拟干旱会导致西洋参不定根中的抗氧化酶POD和CAT活性缓慢上升。这是由于植物体内的抗氧化酶类活性在植物受到胁迫情况下受到诱导增强,通过清除自由基等方式来保护膜系统,从而缓解胁迫作用。这与高岩等用PEG模拟干旱胁迫处理人参愈伤组织时,愈伤组织鲜重随干旱胁迫的加剧而明显抑制结论相一致,说明干旱胁迫会对西洋参正常生长产生不利影响[17]。SA是植物体内广泛存在并在多种植物中参与逆境胁迫调节和次生代谢产物的生物合成过程[18]。在桔梗幼苗遭遇干旱胁迫时,外源SA可以显著提高幼苗叶片和根中的抗氧化酶活性,以减轻干旱对桔梗幼苗的危害[4]。本研究也发现经过80 μmol/L的SA处理西洋参不定根第4天时,其CAT和POD活性分别是未经SA处理对照的2.79倍和2.03倍。除了抗氧化酶活性有明显变化,西洋参不定根中的渗透调节物质也对SA信号产生响应。本试验在添加不同浓度SA后,不定根中MDA的含量出现了先下降后上升的趋势,而脯氨酸的含量呈现了先上升后下降的趋势;在40 μmol/L SA处理到第4天时,MDA的含量达到检测值的最低点,说明40 μmol/L的SA可以减少细胞的损伤。这与其他研究中低浓度外源SA可缓解干旱胁迫造成的伤害的结论[5]相一致。
任春林等发现SA能提高白桦悬浮细胞中齐墩果酸的含量[19],梁莹在西洋参发状根培养过程中添加0.001 mg/L SA,培养5 d时人参皂苷含量是对照组的1.2倍[12]。在本试验中,西洋参不定根中的总黄酮、总皂苷、单体皂苷Rb1和Re含量在SA处理后都出现了最大值,说明SA在调节不定根内抗氧化酶和渗透调节物质的同时,也会参与调节体内次生代谢产物的积累。王晨等研究发现非生物信号刺激下,北柴胡根内JA等信号物质含量增加,促进调节基因BcMYC2的表达,进而提高柴胡皂苷生物合成途径中关键酶基因的表达,最终显著增加柴胡皂苷的含量[20]。本研究中qRT-PCR实验结果也显示HMGR和DS等关键酶基因的表达量在外源40 μmol/L SA处理第2天均显著上升,这与梁莹等的研究结果[12]相一致。由此推测,次级代谢产物的积累量增加可能是由于SA调控这些化合物生物合成中的关键酶基因表达量、转录因子及启动子活性等方式,继而影响到西洋参不定根体内代谢流的走向。在笔者其他在研项目中还发现这些编码基因上游存在着SA响应元件,暗示它们之间可能存在相互影响和促进,在植物激素诱导时进行协同交互响应,但具体的调控通路和机制仍需进一步研究。
综上所述,在干旱胁迫条件下,外源SA处理可有效提高西洋参不定根中抗氧化酶CAT和POD的活性,有利于游离脯氨酸的积累和MDA含量的降低,缓解干旱胁迫对西洋参不定根的伤害。40 μmol/L的外源SA处理有利于西洋参不定根中有效成分总黄酮、总皂苷和单体皂苷Rb1和Re含量的积累,并促使参与人参皂苷合成途径的HMGR等关键酶基因的表达量显著升高。因此,适宜浓度的外源SA可以改善西洋参不定根在干旱胁迫环境下的生长状态,缓解干旱胁迫,促进药用有效成分积累。

