儿童肺炎支原体肺炎急性期高分辨率CT特征与血清炎症因子、病情严重程度及预后的相关性
苏布德格日乐, 刘伟民, 斯琴格日勒, 吉木斯古楞, 宝高娃, 吴春霞
肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)是由肺炎支原体(mycoplasma pneumonia,MP)引起的一种常见的儿童呼吸道疾病[1]。MP多通过呼吸道飞沫传播,全年散发感染[2]。近年来,MPP的发病率呈逐年上升趋势,有数据显示MPP在儿童社区获得性肺炎中占10%~40%,高峰发病年龄为4~6岁[3]。MPP起病缓慢,潜伏期通常为2~3周,在潜伏期内多数患儿无症状,随着潜伏期的结束,患儿会出现发热、乏力、恶心、头痛等症状,并可能伴随阵发性刺激性咳嗽、胸骨下疼痛、浓痰等症状[4]。然而,MPP的临床表现并不典型,因此误诊和漏诊的可能性较大。如果诊治不及时,可能会导致坏死性肺炎、闭塞性细支气管炎、心肌炎、脑膜炎等并发症的发生,严重危害患儿的生命健康[5]。近年来的研究显示,高分辨率CT(high resolution CT,HRCT)在MPP诊断中具有较好的应用价值[4]。本研究进一步分析了MPP患儿HRCT特征与血清炎症因子水平、病情严重程度和预后的相关性,以期基于影像学思路为疾病的早期诊治提供参考依据。
材料与方法
1.病例资料
选取2020年6月至2021年6月于我院就诊及治疗的130例急性期MPP患儿作为研究对象,其中男78例,女52例,平均年龄(7.24±1.43)周岁。病例纳入标准:①依据《诸福棠实用儿科学》中的诊断标准确诊为MPP,即具有发热、咳嗽、气促、呼吸困难肺部啰音等临床表现,影像学有间质性肺炎、肺实变等改变,MP 特异性IgM抗体阳性;②年龄不超过12周岁;③在本院接受HRCT检查,且图像质量良好;④未应用糖皮质激素、干扰素、大环内酯类抗生素及含有免疫增强剂的药物进行治疗。病例排除标准:①合并严重心、脑、肝、肾功能不全;②患有其他感染性疾病;③具有免疫系统疾病或其他肺部疾病及病史;④有胸部手术史。本研究得到了医院伦理委员会批准(批号:NM-LL-2022-04-05-16),所有患儿家属均自愿参与研究,并签署了知情同意书。
2.研究方法
采用飞利浦Brilliance 64排螺旋CT对所有MPP患儿进行HRCT检查,扫描范围为患儿横膈至肺尖区域,扫描参数:电压120 kV,电流80~140 mA,厚层5 mm。由2位副主任医师及以上职称影像医师对患儿的肺部病变形态及分布、胸膜、胸腔积液、淋巴结等情况采用双盲法进行分析,经商讨后确定最终结果。
于所有患儿入院当天采集3 mL外周静脉血,置于EDTA抗凝管中,经离心后分离得到血清,采用酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)对血清肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和白细胞介素-10(interleukin-10,IL-10)的水平进行测定,采用免疫比浊法对血清C反应蛋白(C reactive protein,CRP)水平进行测定。
根据临床肺部感染评分(clinical pulmonary infection score,CPIS)对MPP患儿的病情进行评估,若CPIS评分>6分,则被评级为重症,如CPIS评分≤6分,则纳入轻症组。所有患儿好转出院后进行为期1年的定期门诊随访,随访时进行各项检查,评估有无肺部后遗症发生。
3.统计学分析
采用SPSS 22.0软件进行统计学分析。符合正态分布的定量资料以均值±标准差表示,采用t检验进行两组间比较,采用方差分析进行多组间比较,方差齐时采用SNK-q检验进行多组间的两两比较,方差不齐时采用“塔姆黑泥T2”检验。定性资料以频数表示,组间比较采用χ2检验。采用二元Logistic回归分析多因素对MPP患儿预后的影响。以P<0.05为差异有统计学意义。
结 果
1.MPP患儿的HRCT特征
本组MPP患儿的HRCT特征(图1~3)见表1,主要表现为不均匀性肺实变影(82.31%)、支气管壁增厚(70.77%)、支气管充气征(51.54%)、淋巴结肿大(22.31%)和胸腔积液(20.00%)。

表1 MPP患儿的HRCT特征
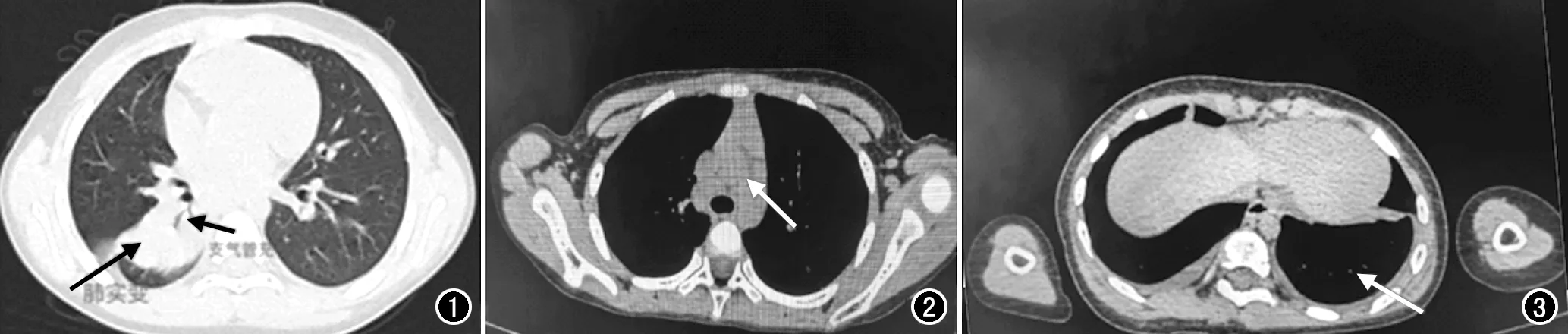
图1 MPP患儿,男,7岁,HRCT显示肺部实变(长箭)及支气管充气征(短箭)。 图2 MPP患儿,男,10岁,HRCT显示纵隔淋巴结肿大(箭)。 图3 MPP患儿,男,10岁,HRCT显示胸腔积液(箭)。
2.不同实变影MPP患儿的血清炎症因子水平比较
不同实变影MPP患儿的血清CRP、TNF-α和IL-10水平比较差异均有统计学意义(P<0.05);大叶性实变影患儿的血清CRP、TNF-α和IL-10水平显著高于节段性实变影和小叶性实变影患儿,差异均有统计学意义(P均<0.05);节段性实变影患儿的血清CRP、TNF-α和IL-10水平显著高于小叶性实变影患儿,差异均有统计学意义(P均<0.05,表2)。

表2 不同实变影MPP患儿的血清炎症因子水平比较
3.MPP患儿不同实变影与病情严重程度的关系
MPP患儿不同实变影与病情严重程度显著相关(P<0.05),重症组中大叶性实变影的比例显著高于节段性实变影和小叶性实变影患儿所占比例,差异有统计学意义(P<0.05,表3)。

表3 MPP患儿不同实变影与病情严重程度的关系 (例)
4.MPP患儿HRCT影像特征与预后的关系130例患儿中,有18例失访或退出研究,最终共112例完成全程随访,其中17例存在肺部后遗症,主要表现为闭塞性细支气管炎、局限性肺气肿、支气管扩张等症状。对有肺部后遗症组与无后遗症组的HRCT影像特征进行比较,结果显示有无淋巴结肿大、有无支气管充气征及肺实变影类型在两组间分布的差异有统计学意义(P<0.05,表4)。

表4 MPP患儿HRCT影像特征与预后的关系 (例)
5.MPP患儿HRCT影像特征预测患儿预后的Logistic回归分析
对MPP患儿的HRCT影像特征进行赋值(表5)。以MPP患儿预后情况作为因变量(无后遗症=0;有后遗症=1),将单因素分析结果中有统计学意义的变量作为自变量,进行多因素二元Logistic回归分析。结果显示,出现支气管充气征和实变影范围增大是MPP患儿有肺部后遗症的独立危险因素(P<0.05,表6)。

表5 HRCT影像特征赋值表

表6 MPP患儿HRCT影像特征预测患儿预后的Logistic回归分析结果
讨 论
相关研究显示,MPP占住院儿童社区获得性肺炎病例的10%~40%,且多发生在5岁以上儿童中[6]。近年来,越来越多的肺炎支原体感染病例表现为难治性肺炎支原体肺炎,随之而来的是肺栓塞、塑型性支气管炎、坏死性肺炎、肺脓肿等肺外并发症,造成不良预后,严重影响患儿的生命健康和生活质量[7]。多项研究表明在MPP的发生、发展过程中,炎症反应扮演着重要角色[8,9],病原菌感染导致患儿炎症水平升高,炎症因子的过度表达也进一步促进了疾病的发生和发展。HRCT可清楚显示肺组织的病理解剖结构,重建图象清晰,定位准确,空间分辨率较高,可直接评估小气道病变、管壁增厚等情况,已被广泛应用于呼吸系统疾病发生、发展的评估中[10]。本研究旨在探讨MPP患儿HRCT特征与血清炎症因子水平、病情严重程度和预后的相关性,以期为疾病的早期诊治提供参考依据。
MP最早累及气道纤毛呼吸上皮,引起支气管壁水肿、溃疡形成,炎症浸润,表现为气管-支气管炎、毛细支气管炎;之后再引起小叶、肺泡间隔间质浸润,进一步累及肺泡时导致肺泡内渗出,表现为间质性肺炎、支气管肺炎甚至大叶性肺炎[10]。本研究结果显示,MPP患儿的肺部实变影范围与血清炎症因子水平和疾病严重程度相关。不同实变影患儿的血清CRP、TNF-α和IL-10水平比较差异有统计学意义,随着实变影范围的增加,患儿的血清炎症因子水平逐渐增高,且病情也逐渐加重。CRP是反映机体炎症状态的一项重要指标,已被证实检测其水平对于评估小儿MPP病情有重要价值[11]。TNF-α是一种与MPP 发生和发展有关的促炎因子,可以介导体内炎症反应的病理和生理过程[12]。IL-10是一种抑炎因子,具有抑制炎症因子分泌和释放的作用,随着CRP、TNF-α等炎症因子水平的增加,为平衡体内炎症反应,IL-10等抑炎因子的水平也随之增加[13]。之前的研究表明,肺实变影范围与MPP患儿的病情严重程度有关[4],当病情较轻时,实变影多表现为小叶受累,若病变严重则将引发肺间质、实质广泛受累,并表现为节段性或大叶性实变影。本研究结果提示,随着MPP患儿肺部实变影的范围增大,病情逐渐进展,炎症因子释放水平升高。此外,笔者还探究了HRCT特征与MPP患儿预后的关系,结果显示,有肺部后遗症组与无后遗症组在淋巴结肿大、支气管充气征及肺实变影分布等方面差异有统计学意义,进一步的多因素Logistic回归分析结果表明,出现支气管充气征和实变影范围增大是MPP患儿有肺部后遗症的独立危险因素。支气管充气征的形成是由于炎性物质在肺泡内大量的渗出、充血、水肿,肺泡内的气体减少,密度增高,导致病变肺组织含有大量的气体而形成的征象。之前的研究表明,高危细菌性肺炎患儿的支气管充气征发生率显著高于中低危患儿[14]。张巨才等[15]的研究也表明HRCT特征表现为大叶性肺炎的患儿病情恶化,炎症反应程度高,预后较差。
综上所述,MPP患儿的HRCT特征与血清炎症因子水平、病情严重程度和预后具有一定相关性,可为临床诊治提供参考依据。

