MRI多参数联合评分对腮腺肿瘤的定性诊断价值
李治群, 孙笑芬, 徐钐, 万江花, 施玉森, 李蕊蕊, 刘旭东, 张业雨
腮腺肿瘤是临床上比较常见的一组头颈部肿瘤,其病理类型非常繁杂,临床症状和体征较为相似,术前较难判断其性质。细针穿刺活检术(fine needle aspiration biopsy,FNAB)是腮腺肿瘤术前定性诊断最主要的检查方法,但FNAB易受肿瘤位置、大小及操作人员的熟练程度等因素的影响,而且恶性肿瘤还存在针道种植转移的风险[1,2]。超声是腮腺肿瘤的筛查手段,但MRI凭借其高软组织分辨力和多序列、多方位成像已广泛应用于涎腺肿瘤的术前诊断,已成为超声检查的有力补充。近年来MR功能成像技术的不断开发和应用,MRI在腮腺肿瘤术前诊断中发挥的作用也越来越大。本研究回顾性分析116例腮腺肿瘤患者的多模态MRI图像,旨在探讨MRI多参数联合评分对腮腺肿瘤的定性诊断价值。
材料与方法
1.研究对象
回顾性搜集2017年1月-2022年10月间在我院经病理证实的腮腺肿瘤患者的临床和影像资料。病例纳入标准:①经手术或穿刺活检病理证实为腮腺肿瘤;②术前接受过多模态MRI检查,包括MRI平扫、扩散加权成像(diffusion weighted imaging,DWI)及动态增强(dynamic contrast-enhanced,DCE)扫描;③病灶直径>1.5 cm;④图像清晰,无伪影,信噪比较高。
2.MRI检查方法
MRI检查采用美国GE公司Signal Discovery MR 750w 3.0T磁共振扫描仪,16通道相控阵头颈联合线圈,患者取仰卧位,平静呼吸。检查序列包括常规平扫、DWI及DCE扫描。MRI平扫:轴面T1WI序列采用快速自旋回波(fast spin echo,FSE),TR 467 ms,TE18 ms。轴面和冠状面T2WI脂肪饱和序列采用快速恢复快速自旋回波(fast recovery fast spin echo,FRFSE),TR 4000 ms,TE 98 ms,层厚/层间距 4 mm/0.4 mm,视野24 cm×24 cm。DWI扫描采用自旋回波单次激发-平面回波加权成像(spin-echo single-shot echoplanar imaging,SS SE-EPI)序列,扫描参数:TR 4200 ms,TE 90 ms,层厚/层间距4 mm/0.4 mm,扩散敏感系数(b值)取0和1000 s/mm2。DCE扫描采用快速扰相梯度回波(fast spoiled gradient echo,FSPGR)序列,扫描参数:TR 320 ms,TE 1.8 ms,层厚/层间距1.2 mm/0.6 mm,矩阵192×128,视野24 cm×24 cm。对比剂采用钆双胺注射液(上海通用电气药业有限公司,15 mL/瓶),经肘静脉团注,剂量0.2 mL/kg体重。扫描范围包含肿块完整病灶,共扫描8个时相(含蒙片1个时相),每一时相采集时间为15~25 s。
3.图像分析
MRI平扫图像:由2位有10年以上工作经验的MR诊断医师在不知病理结果的情况下根据肿瘤的大小、形态、边界、位置、内部纹理、信号强度等影像特征判断肿瘤的性质。当意见不一致时由两人协商达成一致。DWI图像:将图像上传至ADW 4.6工作站,采用function tool软件包进行后处理。参考平扫及增强图像,选取肿瘤的实质部分测量ADC值,采用手动勾画兴趣区(region of interest,ROI),先勾画1个,再复制粘贴2个,单个ROI的面积为60~70 mm2,在肿瘤不同层面的实性部分测量,尽量避开囊变坏死区,取3次测量的平均值作为最后测量结果。
DCE图像:在工作站上通过functional tool软件包进行后处理,在瘤体内勾画ROI,ROI大小为30~40 mm2,尽量避开囊变区和血管,自动生成动态增强曲线,即时间-信号强度曲线(time-intensity curve,TIC),根据其曲线测出峰值时间(time to peak,TTP)及180 s时的相对廓清率(washout ratio,WR)。WR计算公式为:WR=(SI峰值-SI180s)/(SI峰值-SI增强前)×100%,其中SI为信号强度(signal intensity,SI)。根据曲线形态将TIC曲线分为4型:A型为持续型,TTP>120 s;B型为廓清型,TTP≤120 s,WR>30%;C型为平台型,TTP≤120 s,WR≤30%;D型为平坦型,提示病灶无强化[3]。
以上所有肿瘤ROI的勾画均由同1位有8年MRI诊断经验的医师完成。根据统计结果选择多模态参数设置分值,各参数中倾向恶性的结果分值高于倾向良性的结果分值。将各参数评分相加得到的总分称为MR多参数联合评分(multi-parameter combined score,MPCS)。
4.统计学分析
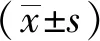
结 果
1.临床资料
本研究共搜集符合纳入标准的腮腺肿瘤患者116例,其中男73例(62.9%),女43例(37.1%),年龄3~77岁,平均年龄(49.2±16.6)岁。良性肿瘤患者的平均年龄为(48.8±16.9)岁,恶性肿瘤患者的平均年龄为(49.9±16.3)岁,两者之间差异无统计学意义(P>0.05)。
116例肿瘤中良性肿瘤75例(64.7%),恶性肿瘤41例(35.3%)。良性肿瘤中以多形性腺瘤(pleomorphic adenoma,PA)最多(29例),占良性肿瘤的38.7%,腺淋巴瘤(Warthin’s tumor,WT)次之(27例),占良性肿瘤的36.0%。恶性肿瘤中黏液表皮样癌(mucoepidermoid carcinoma,MC)10例,占恶性肿瘤的24.4%,腺样囊性癌和腺泡细胞癌分别为7例和6例,分别占恶性肿瘤的17.1%和14.6%(表1)。

表1 116例腮腺肿瘤的主要构成
2.腮腺良、恶性肿瘤的形态学特征
本组75例良性肿瘤中有64例(85.3%)表现为形态规则,70例边界清楚(93.3%),与恶性肿瘤(分别为24.4%和36.6%)之间差异有统计学意义(P<0.05);良、恶性肿瘤的信号均匀性和病灶位置差异均无统计学意义(P>0.05,表2)。
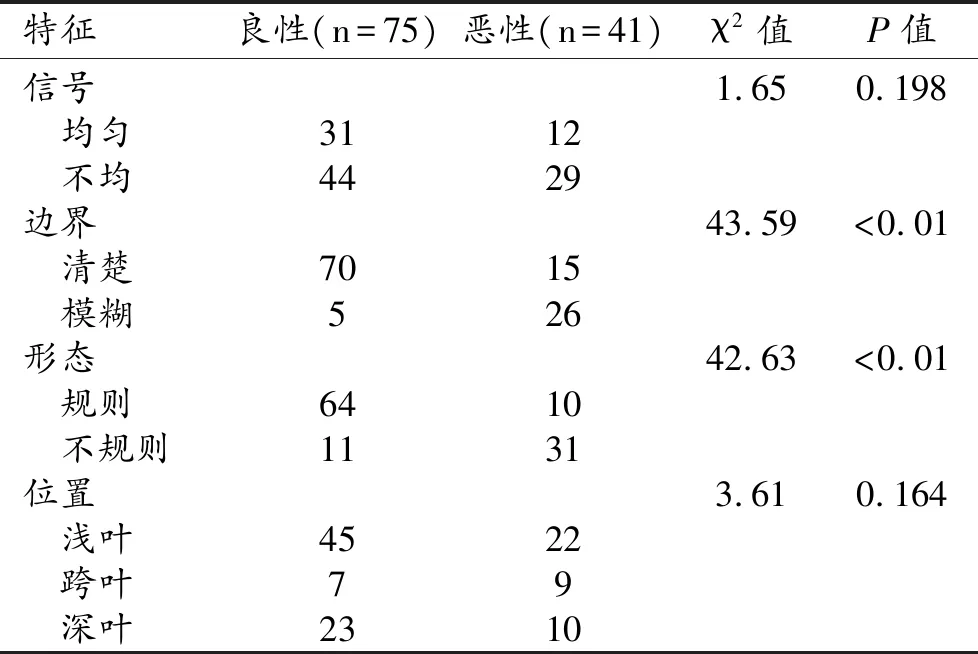
表2 良、恶性腮腺肿瘤的形态学特征比较 (例)
3.腮腺肿瘤的DWI特征
本组良性肿瘤的平均ADC值为(1.15±0.22)×10-3mm2/s,恶性肿瘤的平均ADC值为(0.95±0.17)×10-3mm2/s,良、恶性肿瘤的ADC值差异有统计学意义(t=4.93,P<0.01)。良性肿瘤中,WT的DWI图像多表现为高信号(24/27,88.9%),ADC图显示扩散受限,平均ADC值为(0.87±0.15)×10-3mm2/s,与恶性肿瘤的ADC值范围有重叠;而其它良性肿瘤的平均ADC值为(1.27±0.15)×10-3mm2/s。
ROC曲线分析结果显示,ADC值鉴别诊断良、恶性肿瘤的AUC为0.75(95%CI:0.66~0.83)。以ADC值=1.18×10-3mm2/s为截断值时诊断效能最高,其鉴别良、恶性肿瘤的敏感度为90.2%,特异度54.7%,阳性预测值为51.1%,阴性预测值为91.1%,准确率为67.2%,约登指数为0.45。
4.腮腺肿瘤的DCE特征
在良性肿瘤中,43例(57.3%)患者TIC曲线为A型,22例(29.3%)为B型(图1、2),C型和D型分别为9例(12.0%)和1例(1.3%);而恶性肿瘤以C型曲线最多(29例,70.7%)(图3),其次分别为B型8例(19.5%),A型4例(9.8%),无D型曲线(表4),良、恶性肿瘤之间的TIC曲线类型差异具有统计学意义(χ2值=44.2,P<0.01)。本组资料中唯一表现为D型曲线的是脂肪瘤。

图1 患者,男,33岁,发现右腮腺区肿物10年,术后病理证实为多形性腺瘤。a)横轴面T1WI示病灶呈略不均匀稍高信号,边界清楚,形态欠规则(箭);b)横轴面T2WI抑脂序列示病灶呈不均匀高信号(箭);c)DWI序列示病灶呈高信号;d)ADC图示病灶呈高信号 ,ADC值为1.37×10-3mm2/s ;e)DCE扫描图像;f)TIC曲线呈A型。
如果将C型曲线诊断为恶性肿瘤,A型、B型、D型曲线诊断为良性肿瘤,TIC曲线类型鉴别诊断良、恶性肿瘤的ROC曲线下面积为0.84(95%CI:0.76~0.90),敏感度和特异度分别为70.7%和85.3%,阳性预测值为72.5%,阴性预测值为53.4%,准确率为80.2%,约登指数为0.57。
5.多模态MRI对腮腺肿瘤的诊断效能
将MRI平扫、DWI和DCE图像中的主要参数分别赋值。MRI平扫图像中,将肿瘤边界清楚者设为0分,不清楚者设为1分;形态规则者设为0分,不规则者设为1分。DWI检查中,将ADC值>1.18×10-3mm2/s设为0分,ADC值≤1.18×10-3mm2/s设为1分。TIC曲线为A型者设为1分,B型者为2分,C型者为3分,D型为0分(表3)。将以上各参数评分相加的总分即为MR多参数联合评分。
结果显示良性肿瘤的平均分值为(2.23±1.23)分,恶性肿瘤的平均分值为(5.00±1.05)分,两者之间差异具有统计学意义(P<0.05)。多模态联合参数评分鉴别诊断良、恶性肿瘤的AUC为0.94(95%CI:0.88~0.97),高于ADC值(0.75)和TIC曲线分型(0.84),差异具有统计学意义(P<0.01,图4)。

图4 MRI多参数联合评分鉴别诊断良、恶性肿瘤的ROC曲线。
截断值为3分时鉴别诊断效能最高,AUC为0.88,其鉴别良、恶性肿瘤的敏感度和特异度分别为87.8%和88.0%,阳性预测值和阴性预测值分别为80.0%和93.0%,准确率为87.9%,约登指数为0.76(表4)。

表4 多模态联合参数评分对腮腺肿瘤的定性诊断效能
讨 论
腮腺肿瘤中80%为良性肿瘤,20%为恶性肿瘤,其中绝大多数是上皮性肿瘤,间叶组织来源的肿瘤较少见(约5%)。良性肿瘤以PA最为常见,其次为WT;恶性肿瘤以黏液表皮样癌最为常见,其次为腺样囊性癌[4]。绝大多数腮腺肿瘤临床上仅表现为腮腺区无痛性肿块,逐渐增大,较少有其它不适感,因此就诊时病程较长,包块较明显,临床上对其性质较难判别。本研究中良性肿瘤占比64.7%,其中PA与WT占比相近,恶性肿瘤占比35.3%,与文献报道略有出入,最主要的原因可能是因为WT和恶性肿瘤患者一般年龄较大,WT可有多个病灶,甚至双侧发病,大部分恶性肿瘤边界不清,形态不规则,临床上更为谨慎,因此在超声检查后会进一步通过MRI检查获取更多的诊断信息。
目前,超声是腮腺肿瘤术前首选的筛查方法,而MRI由于其软组织分辨能力强,且有多种功能成像技术,已成为超声检查的有力补充手段。多项研究表明多模态MRI对于腮腺肿瘤的术前定性诊断具有重要价值,尤其是DWI和DCE技术[5-7]。近年来,扩散峰度成像(diffusion kurtosis imaging,DKI)和动脉自旋标记(arterial spin labeling,ASL)等其它MRI功能成像技术也被证明在腮腺肿瘤的鉴别诊断方面具有一定价值[8,9]。但由于成像设备的差异和成像参数的标准化不足,各研究结果之间存在一定差异[10-12],因此多模态MRI对于腮腺肿瘤术前定性诊断价值仍存在一定争议。
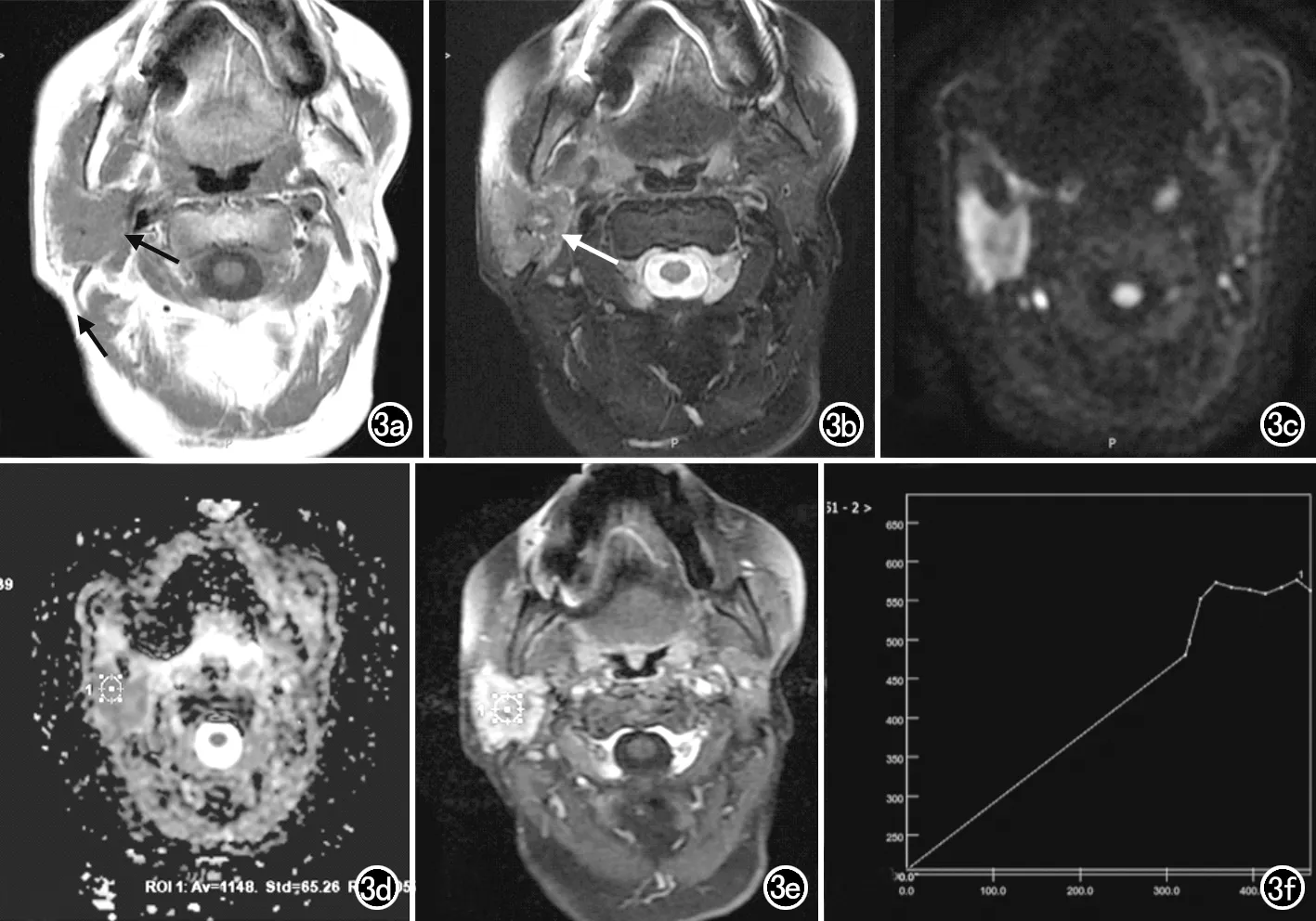
图3 患者,女,76岁,发现右耳下肿物并逐渐增大6个月,右面部麻痛1个月,手术病理证实为低分化腺样囊性癌。a)横轴面T1WI示病灶呈等信号,形态不规则,边界模糊(箭);b)横轴面T2WI抑脂序列示病灶呈不均匀稍高信号(箭);c)DWI序列示病灶呈不均匀高信号;d)ADC图示病灶呈稍低信号,ADC值为1.15×10-3mm2/s ;e)DCE扫描图像;f)TIC曲线呈C型。
MRI平扫图像上腮腺肿瘤的某些形态特征可以鉴别腮腺肿瘤的良恶性,如肿瘤的边界、T2信号强度、是否侵犯邻近组织及有无颈部淋巴结转移等都是鉴别良恶性的重要征象[13],但也有学者认为肿瘤的T2WI信号强度并不足以鉴别肿瘤良恶性[14]。本研究仅针对肿瘤病灶本身的一些影像特征如肿瘤的位置、边界、形态以及信号均匀性等进行了统计学分析,结果显示良、恶性肿瘤的边界和形态差异具有统计学意义,与文献报道相符。良、恶性肿瘤的病灶位置差异无统计学意义,都是以浅叶最为多见。在信号均匀性方面良、恶性肿瘤之间差异亦无统计学意义,可能是因为良性肿瘤中最常见的多形性腺瘤病理成分的多样性导致信号不均匀,而恶性肿瘤如腺癌、腺泡细胞癌、鳞癌等容易发生出血、坏死、囊变,也常导致肿瘤信号不均匀。但近年来有研究表明,通过影像组学、机器学习等人工智能方法分析腮腺肿瘤的信号强度、均匀性的纹理信息可以有效鉴别良、恶性肿瘤[15-17]。
DWI可以区分良恶性肿瘤,绝大部分恶性肿瘤的ADC值低于良性肿瘤,这一观点已经被大量研究证实并应用于临床,DWI也成为腮腺肿瘤术前MRI检查中常规序列的重要补充。本研究结果显示恶性肿瘤的平均ADC值为(0.95±0.17)×10-3mm2/s,明显低于良性肿瘤[(1.15±0.22)×10-3mm2/s)]。但也有部分研究认为ADC值并不能有效鉴别良、恶性肿瘤[18,19]。本研究结果显示ADC值可以鉴别腮腺良、恶性肿瘤,但特异度较低(54.7%),可能会导致出现较多的假阳性结果,这与Yuan等[20]的研究结果一致。导致这一结果的最主要原因是WT的ADC值范围与恶性肿瘤有一定重叠,其病理基础是由于WT病灶内含有高浓度的黏液,从而导致其内水分子扩散速度较低[21],与恶性肿瘤接近。
DCE-MRI可以监测对比剂随时间进出肿瘤病灶的情况。良恶性肿瘤由于新生血管密度、细胞外间隙、细胞间质成分和比例等方面的差异而呈现出不同的强化曲线,因此可通过TIC曲线类型来区分良、恶性肿瘤。但由于WT与恶性肿瘤的TIC曲线有部分重叠,仅仅以120 s的TTP为参数可以区分PA与恶性肿瘤,但不能区分WT与恶性肿瘤,必须结合30%的WR才能区分WT与恶性肿瘤[3]。 本研究结果也表明结合TTP(120 s)和WR(30%)的TIC曲线分型能够有效区分腮腺良、恶性肿瘤,恶性肿瘤多表现为C型曲线,9例WT也表现为C型曲线。
在设置多模态参数分值时,本研究参照Yuan等[20]的设计理念,倾向于恶性的结果分值高于倾向于良性的结果。在本研究中,腮腺良恶性肿瘤的边界和形态差异具有统计学意义,因此在设置多模态参数评分时,我们选择肿瘤的边界和形态作为MRI平扫的参数,并将倾向于良性肿瘤的结果设为0分,倾向于恶性肿瘤的结果设为1分。对于DWI图像,我们也将倾向于良性的结果(>截止值)设为0分,倾向于恶性的结果(≤截止值)设为1分。对于TIC曲线分型,根据本研究结果,C型曲线更倾向于恶性肿瘤,其次是B型曲线,A型曲线更倾向于良性,D型曲线为良性,因此将TIC曲线的4型根据恶性倾向的高低依次设为0~3分。
本研究结果显示良性肿瘤的多参数联合评分的分值低于恶性肿瘤,两者之间差异具有统计学意义。ROC曲线分析结果显示,截断值为3分时具有最佳的诊断效能,其敏感度和特异度分别为87.8%和88.0%,准确率为87.9%(95%CI:80.6%~93.2%)。这为腮腺肿瘤术前多模态MRI检查的影像报告和评分系统(reporting and data system,RADS)提出了可能,未来我们可以进一步优化多模态参数,如加入吸烟史、病灶是否位于腮腺浅叶后下极、是否区域淋巴结肿大等参数,以提高WT与恶性肿瘤的鉴别诊断能力,并通过多中心、大样本的前瞻性研究进一步证实多参数联合评分系统的科学性和可靠性。
本研究存在以下局限性:首先,本研究为单中心的回顾性研究,样本的选择有一定局限性,并不能真实反映人群中腮腺肿瘤的构成分布;其次,本研究的样本量偏小,部分腮腺肿瘤的病理亚型病例数极少,甚至还有一些病理亚型没有出现在本研究中,这可能会导致一些偏倚;最后,在计算MRI多参数联合评分时,我们只是将各参数分值简单相加,没有充分考虑到各参数之间的权重。
综上所述,多模态MRI是腮腺肿瘤术前定性评估的重要影像检查手段。本研究结果表明MR平扫、DWI和DCE的联合评分可以有效区分腮腺良、恶性肿瘤,其诊断效能优于MRI平扫或DWI、DCE等单独的功能性成像。同时,本研究结果也表明未来腮腺肿瘤术前MRI检查实施RADS评分存在一定的可能性,这值得我们进一步去深入研究。

