WHAMM在食管鳞状细胞癌组织中的表达及对EC109和KYSE510细胞生物学行为的影响
韩 娜,张 芳,刘小小,杨笑天,赵文超
1)郑州大学第二附属医院肿瘤科 郑州 450014 2)郑州大学河南医学院 郑州 450052 3)郑州大学基础医学院生理学与神经生物学系 郑州 450001
食管癌是世界上常见的恶性肿瘤之一,病理类型包括食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和腺癌[1-2]。在我国,90%以上的食管癌为ESCC[3-4]。ESCC患者的早期临床症状并不典型,确诊时往往处于中晚期,预后较差,5 a生存率较低[5-6]。维斯科特-奥尔德里奇综合征蛋白(Wiskott-Aldrich syndrome protein,WASP)是一类肌动蛋白调节蛋白,可协助肌动蛋白相关蛋白2/3复合物(actin-related protein2/3 complex,Arp2/3)促进微丝的聚合,参与肌动蛋白细胞骨架的维持[7-8],调控细胞的吞噬、胞质分裂、胞内膜转运和迁移等[9-10]。研究[11-12]表明,WASP家族的多个成员参与了宫颈癌、结直肠癌、乳腺癌以及前列腺癌等多种肿瘤的发生发展。肌动蛋白、细胞膜和微管相关的WASP同源物(WASP homolog associated with actin,membranes and microtubules,WHAMM)是WASP家族成员之一,在肿瘤中的作用尚未阐明。本研究观察WHAMM在ESCC组织中的表达及对ESCC细胞生物学行为和患者预后的影响,探讨WHAMM对ESCC发生发展的影响。
1 材料与方法
1.1 组织标本的获取选择2020年11月1日至2021年12月30日于郑州大学第二附属医院进行手术治疗的ESCC患者22例,收集切除的ESCC组织以及配对的癌旁正常食管黏膜组织(距离肿瘤边缘≥5 cm)标本。患者术前均未进行抗肿瘤治疗。TNM分期按照国际抗癌联盟/美国癌症联合会食管癌分期标准(2017年第8版):Ⅰ期4例,Ⅱ期11例,Ⅲ期6例,Ⅳ期1例。患者中男16例,女6例,年龄47~76岁,中位年龄65.5岁。本研究经该院伦理委员会审查后批准,患者或家属知情同意。
1.2 细胞和主要试剂人ESCC细胞系EC109和KYSE510购自上海中科院细胞库。RPMI 1640培养基购自美国HyClone公司。携带WHAMM过表达载体的慢病毒及携带空载体的对照病毒购自中国吉玛基因公司。胎牛血清购自美国Gibco公司。Trizol试剂购自美国Invitrogen公司。PrimeScript RT reagent反转录试剂盒购自日本TaKaRa公司。引物由生工生物工程(上海)股份有限公司合成。WHAMM一抗购自中国百远生物公司,二抗购自美国Proteintech公司,CCK-8试剂购自中国索莱宝公司。Transwell小室购自美国康宁公司。
1.3 ESCC和癌旁正常食管黏膜组织中WHAMM mRNA的表达
1.3.1数据库信息 收集基因表达综合数据库相关数据集(GSE67269和GSE161533)中ESCC组织和癌旁正常食管黏膜组织WHAMM mRNA表达的数据(n=75和28)并分析两种组织中WHAMM mRNA表达的差异。收集癌症基因组图谱(The Cancer Genome Atlas,TCGA)中的有生存状况的84例ESCC患者的相关数据,分析WHAMM mRNA的表达与ESCC患者预后的关系。
1.3.2ESCC和癌旁正常食管黏膜组织中WHAMM mRNA表达的qRT-PCR检测 ESCC和癌旁正常食管黏膜组织研磨后采用Trizol裂解,加入氯仿放置3 min后离心取上清,异丙醇沉淀RNA,体积分数75%的乙醇洗涤RNA沉淀两次,无酶水溶解RNA后采用miScript Ⅱ RT试剂盒反转录获取cDNA。采用qRT-PCR检测组织中WHAMM mRNA的表达。WHAMM上游引物序列5’-TATTGCAGCCATT TAGGGCTATG-3’,下游引物序列5’-GGCAACTAC CCTTCTAGGACC-3’。GAPDH上游引物序列5’-GGAGCGAGATCCCTCCAAAAT-3’,下游引物序列5’-GGCTGTTGTCATACTTCTCATGG-3’。反应体系:10 μL荧光染料,终浓度为0.4 μmol/L的上、下游引物各4 μL,cDNA 0.4 μL,添加无酶水至总体积20 μL。反应条件:94 ℃预变性10 min;94 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,40个循环。以GAPDH为内参,计算2-ΔΔCt,作为基因的表达水平。
1.4 细胞实验
1.4.1细胞分组 取对数生长期的EC109和KYSE510细胞接种至24孔板(5×104个/孔),当细胞融合至80%时分两组:过表达组细胞加入携带WHAMM过表达的慢病毒,阴性对照组加入携带空载体的对照病毒。继续培养72 h后加入嘌呤霉素(1 mg/L)筛选,采用荧光显微镜观察细胞荧光。当感染效率达到80%以上时,用于以下实验。
1.4.2WHAMM蛋白的Western blot检测 PBS清洗各组细胞后加入含有蛋白酶抑制剂的RIPA裂解液,冰上放置30 min后12 000 ×g离心10 min,提取上清后二喹啉甲酸法测定蛋白浓度,加入5×上样缓冲液后煮沸5 min备用。制备浓缩胶和分离胶(80 g/L的SDS-PAGE),蛋白上样后于150 mV电泳1.5 h,230 mV转膜1.5 h,50 g/L脱脂牛奶封闭1 h后加入一抗4 ℃孵育过夜,清洗后50 g/L脱脂牛奶封闭1 h,加入二抗孵育1 h,加入增强型化学发光液后上机显影。Image J分析各条带灰度,以WHAMM和β-actin条带的灰度值比值代表WHAMM蛋白表达水平。实验重复3次。
1.4.3细胞增殖的CCK-8法检测 取对数生长期的EC109和KYSE510细胞消化后重悬,接种于96孔板(4×103个/孔),于培养箱中培养。分别于第1、2、3和4天弃去旧培养基,加入CCK-8试剂与无血清培养基(体积比为1∶9),培养箱中放置1.5 h后采用酶标仪测定450 nm处的吸光度。实验重复3次。
1.4.4细胞迁移和侵袭能力检测 处于对数生长期的EC109和KYSE510细胞消化后采用不含FBS的培养基重悬,取200 μL细胞悬液(含5×104个细胞)加入Transwell上室,在Transwell下室加入600 μL培养基(体积分数10%FBS)培养,24 h后固定30 min,结晶紫染色30 min,生理盐水清洗后棉签擦拭小室上层,100倍显微镜下观察并拍照。侵袭实验中,Transwell上室加入100 μL的基质胶并放置24 h。采用Image J分析迁移或侵袭细胞数。实验重复3次。
1.5 统计学处理应用SPSS 21.0分析数据。采用配对资料的t检验比较ESCC组织和癌旁正常食管黏膜组织中WHAMM mRNA的表达水平。采用Kaplan-Meier法绘制生存曲线,Log-rank检验分析WHAMM mRNA的表达与患者预后的关系。两组细胞WHAMM mRNA和蛋白的相对表达量,吸光度值、迁移和侵袭细胞数的比较采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1 ESCC组织和癌旁正常食管黏膜组织中WHAMM mRNA的表达GSE67269、GSE161533数据集和本研究收集标本中,ESCC组织中WHAMM mRNA的表达高于癌旁正常食管黏膜组织(表1)。
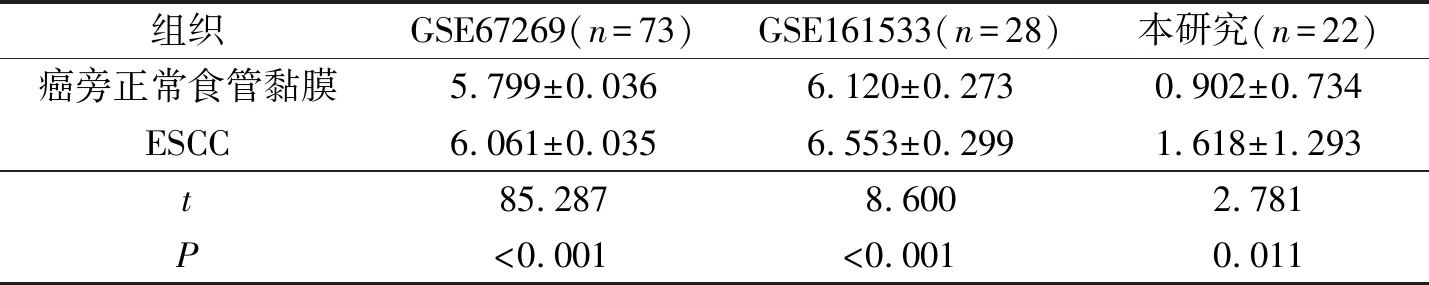
表1 ESCC组织和癌旁正常食管黏膜组织中WHAMM的表达
2.2 WHAMM的表达与ESCC患者生存的关系根据WHAMM mRNA表达的中位数8.964,将TCGA-ESCC数据集中的84例ESCC患者分为WHAMM低表达组(≤8.964)和WHAMM高表达组(>8.964),两组生存曲线比较见图1。WHAMM低表达组的生存状况好于高表达组(χ2=5.155,P=0.023)。

图1 WHAMM低表达组和高表达组患者的生存曲线
2.3 两组EC109和KYSE510细胞中WHAMM蛋白的表达与阴性对照组比较,过表达组EC109和KYSE510细胞中WHAMM蛋白表达增加,见表2。
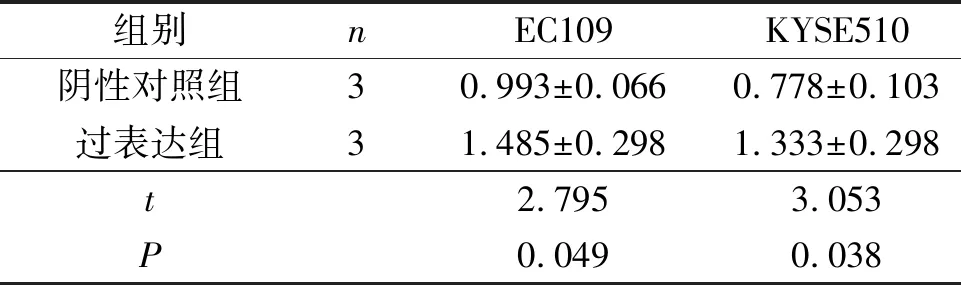
表2 两组EC109和KYSE510细胞中WHAMM蛋白表达的比较
2.4 两组EC109和KYSE510细胞增殖情况与阴性对照组比较,过表达组EC109和KYSE510细胞的增殖能力增加,见表3、4。
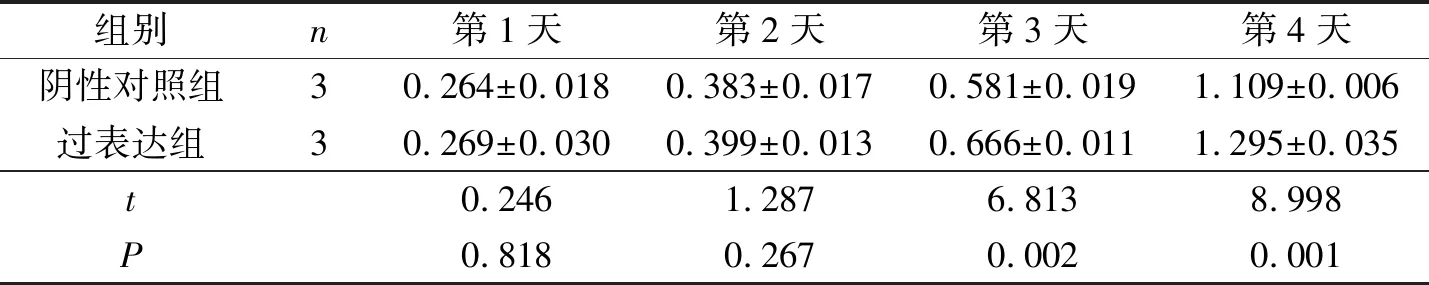
表3 两组EC109细胞的吸光度值比较

表4 两组KYSE510细胞的吸光度值比较
2.5 两组EC109和KYSE510细胞的迁移和侵袭情况与阴性对照组比较,过表达组EC109和KYSE510细胞的迁移和侵袭能力增加,见表5。

表5 两组EC109和KYSE510细胞的迁移细胞数和侵袭细胞数比较
3 讨论
微丝是细胞骨架的主要成分之一,参与细胞器的转运、细胞形态的维持、大分子物质的跨膜转运以及细胞迁移等[13-14]。WASP家族蛋白是一类成核促进因子,其C末端的结构域能够与Arp2/3和肌动蛋白单体结合,促进微丝的成核反应,最终参与细胞的多种生物学功能[7,15]。WASP家族成员包括神经元型WASP(neuronal-WASP,N-WASP)、WASP家族富含脯氨酸同源蛋白1(WASP family verprolin-homologous protein 1,WAVE1)、WAVE2、WAVE3以及WHAMM等[10]。研究发现, N-WASP可促进宫颈癌细胞的迁移和侵袭[11],WAVE1可增加卵巢癌细胞的增殖、迁移和侵袭能力等[16]。
本研究结果显示ESCC组织中WHAMM mRNA表达高于癌旁正常食管黏膜组织,WHAMM高表达患者的生存时间较短,提示WHAMM可能促进了ESCC的发生发展。本研究结果亦显示WHAMM促进了ESCC细胞的增殖、迁移和侵袭。这一作用同WAVE1在卵巢癌的作用类似[16]。WHAMM可促进视网膜上皮细胞内自噬体的形成[17],而自噬可以影响细胞的增殖[18]。作者推测WHAMM可能通过促进自噬来增强ESCC细胞的增殖能力。微丝是组成细胞骨架的重要成分,其动态变化不仅是细胞迁移运动的基础,也具有调节细胞侵袭功能的作用[19-20]。作者推测WHAMM可能通过促进微丝的聚合来促进ESCC细胞的迁移和侵袭,但是这些推测均需要进一步的实验验证。
综上所述,WHAMM促进了ESCC细胞的增殖、迁移和侵袭,与患者的预后相关。

