具核梭杆菌对食管鳞状细胞癌组织CD8+T细胞浸润及预后的影响
张家豪,刘怡文,何珂瑶,张哲源,李若楠,龙情柔,孙 蔚,孔金玉,杨海军,周福有
1)新乡医学院第三附属医院胸外科 河南新乡 453003 2)河南科技大学临床医学院;河南科技大学第一附属医院;河南省肿瘤表观遗传重点实验室;河南省微生态与食管癌防治重点实验室 河南洛阳 471003 3)安阳市肿瘤医院病理科 河南安阳 455000 4)安阳市肿瘤医院胸外科;河南省食管癌精准防治医学重点实验室 河南安阳 455000
食管癌发病率和死亡率极高,我国以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主,ESCC病因至今尚未完全明确[1]。作者所在团队[2-3]已证实,ESCC组织中具核梭杆菌(Fusobacteriumnucleatum,Fn)定植率约为40%,且Fn感染阳性的ESCC患者生存期显著缩短;Fn长期定植不仅可激活癌细胞中炎症相关信号通路,还可重塑免疫微环境,诱导癌细胞免疫逃逸。
吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)为色氨酸分解代谢的关键限速酶,其过表达可导致色氨酸耗竭,使免疫微环境中正向调节的T细胞增殖及活化受阻,导致机体抗肿瘤免疫失能[4-5]。幽门螺杆菌、乙肝病毒及人乳头瘤病毒均可通过激活IDO,抑制具有杀伤功能的CD8+T细胞的增殖及活化,协助癌细胞逃避免疫监视,促进胃癌、肝癌及宫颈癌的恶性增殖及远处转移[6-8]。
本研究初步分析了Fn感染对ESCC细胞中IDO蛋白表达及CD8+T细胞浸润的影响,并分析Fn感染与ESCC预后的关系,为ESCC病因学研究及临床防治策略的制定提供新思路。
1 材料与方法
1.1 主要试剂与仪器ESCC细胞系KYSE140、KYSE150及Fn菌株ATCC 25586为作者所在实验室冻存,健康人外周血来自本实验室志愿者;Ficoll-paque分离液(美国GE公司),磁珠分选试剂盒、hIL-2、hIL-7-Fc、TexMACS培养基(美国Miltenyi公司),细胞内固定与透化缓冲液套件、荧光标记抗体IDO-PE及羧基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein diacetate succinimidyl ester,CFSE)细胞增殖检测试剂盒(美国eBioscienceTM公司),IDO抑制剂(美国Selleckchem公司),RNAscope试剂盒及Fn特异性探针(美国ACD公司),IDO及CD8兔抗人单克隆抗体(英国Abcam公司),免疫组化试剂盒(中国ZSGB-BIO公司),柠檬酸钠抗原修复液、DAB显色液(中国Solarbio公司);厌氧工作站(美国COY公司),流式细胞仪(美国贝克曼公司)。
1.2 Fn感染后ESCC细胞中IDO表达的检测厌氧工作站中常规培养Fn;培养箱中常规培养KYSE140、KYSE150细胞[2-3]。待ESCC细胞生长达70%融合度时,收集细胞,调整细胞密度至1×106个/mL。将对数生长期的Fn加入细胞培养基(感染复数MOI=10),分别感染24、48、72 h。设未感染Fn的细胞为对照。采用细胞内固定与透化缓冲液套件对细胞进行固定及破膜后,加IDO-PE孵育30 min,采用流式细胞仪检测细胞中IDO表达量,以相对荧光强度表示。采用Summit 5.3软件分析数据,具体步骤参考说明书。实验重复3次。
1.3 与ESCC细胞共培养后CD8+T细胞增殖率的检测取健康人外周血于抗凝管,用生理盐水按体积比1∶1稀释后,缓慢铺于适量Ficoll-paque分离液表面。800×g离心20 min,分层后吸取白膜层,800×g离心5 min,沉淀为人外周血单个核细胞。采用磁珠分选试剂盒从中分选出CD8+T细胞,于含hIL-2(50 U/mL)、hIL-7-Fc(70 μg/L)的TexMACS培养基中扩增培养。
常规培养KYSE140及KYSE150细胞,待细胞生长达70%融合度时,用CFSE(浓度为1 μmol/L)标记CD8+T细胞,并按细胞数之比10∶1的比例将标记后的CD8+T细胞加入KYSE140或KYSE150细胞培养基进行共培养。具体步骤参考说明书及本课题组前期研究[3]。KYSE140及KYSE150共培养体系均分为4组:对照组、Fn组、IDO抑制剂组及Fn+IDO抑制剂组。按分组感染Fn(感染复数MOI=10)、加入IDO抑制剂(浓度为1 μmol/L)[9]分别培养24、48及72 h,用流式细胞仪检测共培养体系中CD8+T细胞的增殖情况。采用Summit 5.3软件分析数据,CD8+T细胞增殖率以荧光强度减弱细胞百分比表示,具体步骤参考说明书及本课题组前期研究[3]。实验重复3次。
1.4 ESCC组织Fn感染、IDO表达及CD8+T细胞浸润情况的检测
1.4.1标本来源 选取2015年1月至2017年1月安阳市肿瘤医院手术切除的ESCC患者癌组织石蜡包埋标本为研究对象。纳入标准:术后病理诊断明确为ESCC,未合并其他肿瘤;术前未接受放、化疗和免疫治疗;临床资料齐全。最终纳入243例ESCC患者。243例中男166例,女77例;<60岁78例;146例有吸烟史;142例有饮酒史;低分化61例,中高分化182例;侵及外膜187例,未侵及外膜56例;有淋巴结转移163例;TNM分期Ⅰ/Ⅱ期92例,Ⅲ/Ⅳ期151例。本研究获安阳市肿瘤医院伦理委员会审核批准(2022WZ16K01)。
1.4.2Fn感染的检测 取石蜡包埋的ESCC组织病理切片(片厚2 μm),经脱蜡及水化后,采用RNAscope试剂盒中的靶标修复液修复、双氧水处理及蛋白酶孵育,加Fn特异性探针4 ℃孵育过夜,用RNAscope显色剂显色[3]。结果判定:细胞胞质出现红色颗粒为Fn rRNA阳性;单个细胞中单独的红色颗粒≥8个为Fn阳性细胞;阳性细胞占比≥30%为Fn感染阳性样本。阳性对照、阴性对照及评分细则见本课题组前期研究[2-3]。
1.4.3IDO表达及CD8+T细胞浸润情况的检测 取2张同批常规石蜡包埋的ESCC组织连续切片(片厚2.5 μm),经脱蜡、水化、抗原修复后,采用免疫组化试剂盒中的过氧化物酶阻断剂及山羊血清封闭。分别加入IDO及CD8抗体(按1∶500稀释)4 ℃孵育过夜,经山羊抗兔聚合物及SP孵育后,DAB显色、苏木精复染、梯度乙醇脱水、二甲苯透明、中性树胶封片。结果判读:IDO阳性细胞及CD8+T细胞为胞质及胞膜出现棕黄色颗粒。阳性对照、阴性对照及免疫组化评分标准参照本课题组前期研究[3]及参考文献[10]。
1.5 随访从患者确诊开始随访,截至2022年1月。患者出院后,安阳市肿瘤医院随访中心每1个月电话联系一次患者或家属直至随访结束。以死亡为终点事件。
1.6 统计学处理采用GraphPad 5.0及SPSS 26.0处理数据。采用析因设计的方差分析比较Fn感染与未感染ESCC细胞中IDO表达的差异及各共培养体系中CD8+T细胞增殖率的差异。采用Kappa系数分析ESCC组织中Fn感染与IDO表达的一致性,采用χ2检验分析Fn感染及IDO表达与CD8+T细胞浸润的关联。采用Kaplan-Meier法绘制Fn感染与未感染者的生存曲线并进行Log-rank检验。采用Cox回归分析Fn感染对ESCC患者预后的影响。检验水准α=0.05。
2 结果
2.1 Fn感染对ESCC细胞中IDO表达的影响结果见表1。由表1可知,Fn感染可诱导ESCC细胞中IDO高表达,且具有时间依赖性。

表1 各组ESCC细胞中IDO表达的比较(n=3)
2.2 Fn感染及IDO抑制剂对共培养体系中CD8+T细胞增殖的影响结果见表2。由表2可知,Fn感染可抑制共培养体系中CD8+T细胞增殖,IDO抑制剂则促进增殖,二者联用有拮抗作用,且作用具有时间依赖性。
2.3 ESCC组织中Fn感染、IDO表达及CD8+T细胞浸润的关联性结果见图1,表3、4。ESCC组织中Fn感染及IDO表达具有一致性,而二者均与CD8+T细胞浸润呈负关联。
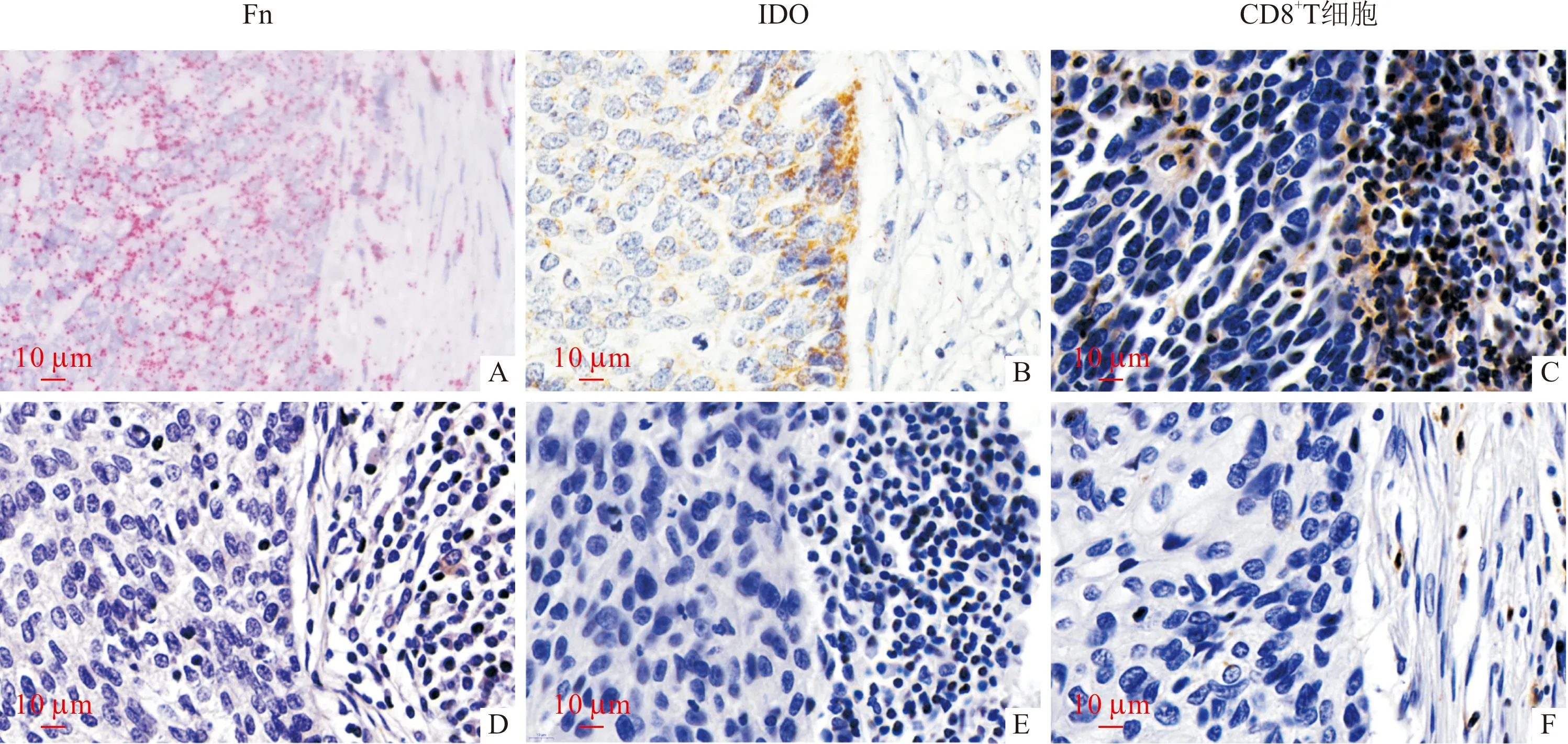
上排:阳性样本;下排:阴性样本;A、D:RNAscope法;B、C、E、F:SP法

表3 ESCC组织中Fn感染与IDO表达的一致性分析 例
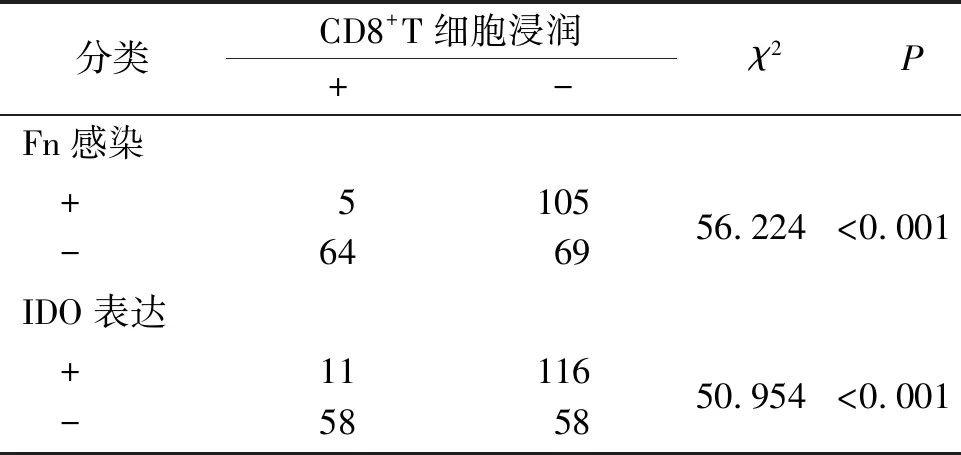
表4 ESCC组织中Fn感染及IDO表达与CD8+T细胞浸润的关联性分析 例
2.4 Fn感染对ESCC患者预后的影响243例随访3~60个月,中位随访时间32个月;截至2022年1月,仍存活59例。
Kaplan-Meier生存曲线分析结果显示Fn感染患者预后较差(χ2=27.500,P<0.001)(图2)。

图2 Fn阳性组与阴性组ESCC患者的Kaplan-Meier生存曲线
以性别(女为对照)、年龄(<60岁为对照)、吸烟、饮酒为调整因素,采用Cox回归分析Fn感染对ESCC患者生存的影响,结果(表5)显示,Fn感染影响ESCC患者的预后。

表5 Fn感染对ESCC患者生存影响的Cox回归分析
3 讨论
资料[11]显示,病原微生物可通过重塑肿瘤免疫微环境,削弱机体抗肿瘤免疫反应。作者所在团队前期研究[2-3]发现,Fn感染与ESCC的发生发展密切相关。IDO是介导肿瘤免疫逃逸的关键检查点分子,为色氨酸代谢过程中的限速酶,其异常激活可引起T细胞活化增殖所必需的色氨酸分解耗竭,抑制T细胞介导的免疫反应,且色氨酸代谢物也可抑制T细胞及NK细胞增殖,进一步加重机体的免疫抑制[12]。人乳头瘤病毒、乙肝病毒及人类疱疹病毒均可诱导癌细胞高表达IDO,招募调节性T细胞并阻碍CD8+T细胞增殖及活化,抑制免疫反应,促进宫颈癌、肝癌及口腔鳞癌发生发展[13-15]。本研究发现,随Fn感染时间的延长,ESCC细胞中IDO表达逐渐增强,表明Fn感染可诱导ESCC细胞中IDO高表达,且具有时间依赖性。我们建立了人CD8+T细胞与ESCC细胞共培养体系模拟肿瘤微环境,结果表明Fn感染可抑制共培养体系中CD8+T细胞增殖,IDO抑制剂则可促进增殖,而Fn+IDO抑制剂组细胞增殖率升高,表明抑制IDO的活性可阻断Fn对CD8+T细胞的负性调控作用,也提示IDO抑制剂使用的情况下,Fn对共培养体系中CD8+T细胞增殖仍有一定抑制作用。
此外,本研究还发现,243例ESCC组织中Fn感染及IDO表达具有一致性,而二者均与CD8+T细胞浸润呈负关联。Fn感染的患者中位生存时间更短,Fn感染增加了ESCC患者死亡的风险,提示有效清除Fn对延长ESCC患者生存期具有重要意义。
综上所述,Fn可能通过诱导IDO表达,抑制CD8+T细胞增殖,削弱机体抗肿瘤免疫反应,促进ESCC恶性演变。由于病原微生物感染与肿瘤的发生发展是一个多因素、多步骤的复杂过程,Fn对ESCC免疫微环境的重塑机制仍有待进一步实验验证。

