高中化学一轮复习中VSEPR理论在键角大小比较中的应用
金敖然
(广西壮族自治区南宁市第三中学)
在一轮复习备考“物质结构与性质”模块的时候,学生经常遇到涉及分子中比较共价键夹角大小的问题.对于此类问题,教材上没有直接的讲解,有些辅导材料上的解释也不够系统和全面.在缺乏理论指导的情况下,学生在解答此类问题时往往无从下手,错误率很高.笔者通过剖析价层电子对互斥(VSEPR)理论,指导学生分析、判断键角的大小,培养学生的空间想象和逻辑思维能力以及分析问题、解决问题的能力,提高高三备考的效率.
1 VSEPR理论
杂化轨道理论可以很好地解释分子的空间构型,但是若想进一步解释采用相同杂化类型的分子,其分子中因结合原子不同而造成结构上的变化,即键角的改变,杂化轨道理论就显得“力不从心”了.高中阶段用VSEPR 理论解释或者预测分子的几何模型简单有效且易懂.VSEPR 理论认为分子的立体构型取决于中心原子周围电子对之间的相互排斥,当排斥力存在时,整个分子的空间构型趋向于电子对排斥力最小的结构,维系体系能量最低.具体表现在两个方面,一方面是看中心原子的价层电子对数目.价层电子对数=成键电子对数+孤电子对数,成键电子对数或者σ键电子对数等于中心原子结合的原子数.中心原子孤电子对数的计算式为,a为中心原子的价电子数,x为结合原子数,b为结合原子所能接受的电子数.例如SO3,其成键电子对数为3,孤电子对数为,价层电子对总数为3.价层电子对总数决定分子的基本空间构型.另一方面,要考虑不同情况下的电子对之间斥力不同,对空间基本构型产生的影响不同,使键角发生改变.
2 依据VSEPR理论判断分子的空间构型
2.1 价层电子对总数对空间构型的影响
前面讲过如何确定一个分子的价层电子对数目.价层电子对数目是影响分子空间构型的主要因素,如表1所示.

表1

图1
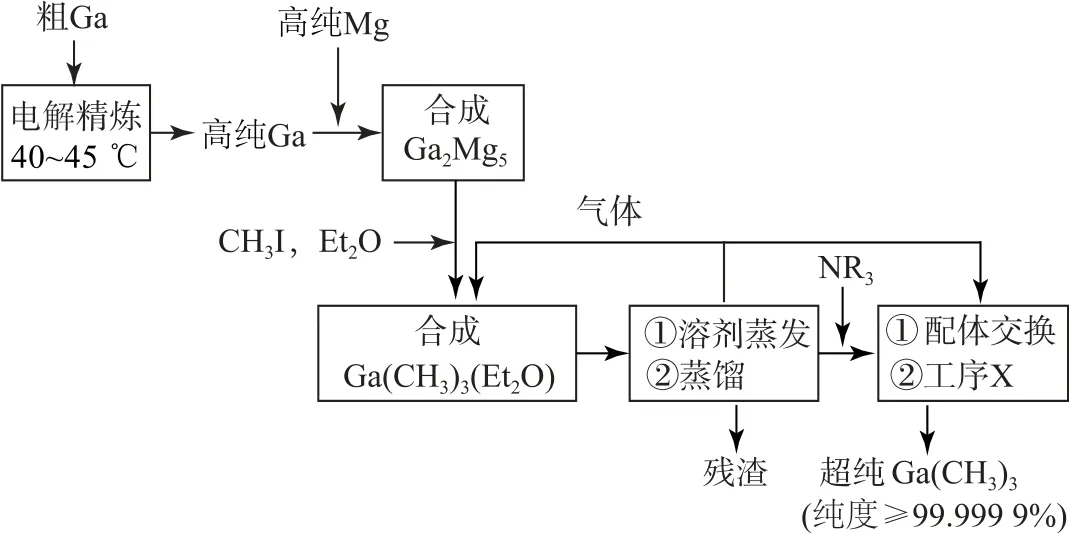
图2
表2
比较分子中的C—Ga—C 键角大小:Ga(CH3)3________Ga(CH3)3(Et2O)(填“>”“<”或“=”),其原因是________.
2.2 孤电子对对空间构型的影响
成键电子对与孤电子对在中心原子周围形成的电子云分布方式不一样,成键电子对由于受到2个原子核的吸引,电子云沿键轴方向“拉长”,而孤电子对只受中心原子吸引,因而电子云更加“聚拢”于中心原子一侧,占据较大空间.这样孤电子对对相邻电子对的排斥力就更大,NH3中成键电子对与孤电子对的电子云分布情况如图3所示.不同电子对之间的排斥力大小顺序为:孤—孤>孤—键>键—键.孤电子对越多,对成键电子对的斥力越大,共价键键角就越小.
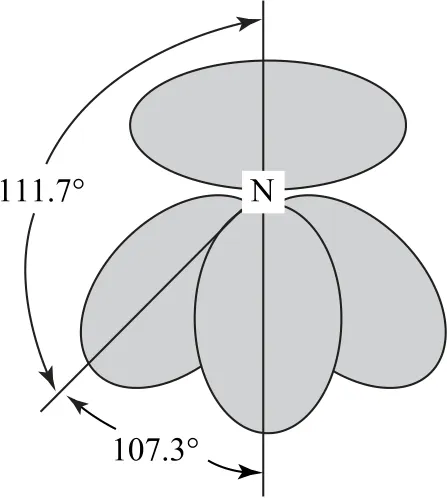
图3
A.CH4和H2O 的VSEPR 模型均为四面体
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
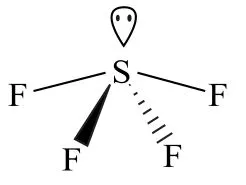
图4 SF4 分子的空间构型
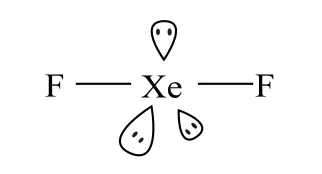
图5 XeF2 分子的空间构型
2.3 多重键对空间构型的影响
共价键包括单键、双键、三键、大π键等.我们通常把含有π键的共价键称作重键.π键不影响分子的骨架,但是π键增多,成键电子占据的空间就越大,对其他电子对的斥力也随之增大,导致键角改变.一般来讲,π键的成分越多斥力越大,包含多重键的键角会变大,而单键之间的键角会变小.
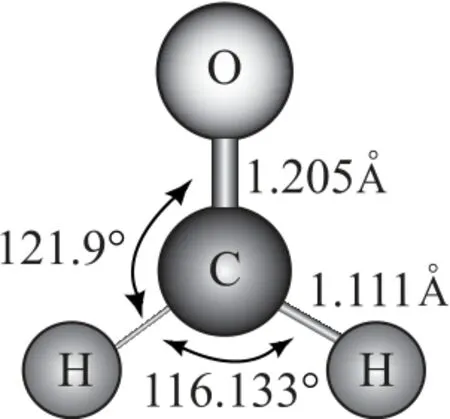
图6 甲醛分子构型
2.4 中心原子相同,配原子不同
当中心原子相同,配原子不同时,由于配原子的电负性不同,配原子的电负性越大成键电子对越靠近配原子,距离中心原子越远,成键电子对的斥力就会越小,其键角也会变小.
2.5 配原子相同,中心原子不同
当配原子相同,中心原子不同时,随着中心原子的电负性增大,中心原子对成键电子对吸引力增强,成键电子对靠近中心原子,造成成键电子对间的斥力增加,键角增大,
3 结束语
学生通过学习,深入理解VSEPR理论,了解影响键角大小的因素,综合运用所学知识,可以准确预测分子结构中的键角大小关系.通过学习这部分知识,可以提升空间想象能力,提高分析问题和运用知识解决问题的能力,同时可以促进对杂化轨道理论、原子核外电子排布规律以及电负性等知识的理解,整体提升高三一轮复习中物质结构知识模块的复习效果.
(完)

