甘薯长喙壳菌的致病机制、毒素合成及防控研究进展
王森 田俊 刘曼
摘要:甘薯长喙壳菌(Ceratocystis fimbriata Ellis & Halsted)是在世界范围内分布广泛、危害严重的食品腐败真菌,尤其会在甘薯采后贮藏过程中造成极大经济损失。此外,在甘薯长喙壳菌侵染过程中可诱导甘薯产生植物抗毒素呋喃萜类毒素,该毒素具有严重的肝毒性和肺毒性,会严重威胁人体健康。因此,控制甘薯长喙壳菌及其造成的甘薯采后贮藏损失刻不容缓。本文主要综述了甘薯长喙壳菌的生物学特性、侵染途径、发病条件、致病机制、呋喃萜类毒素的合成途径及其防控方法,以期为高效防控甘薯长喙壳菌、提升甘薯的贮藏品质提供理论依据。
关键词:甘薯;甘薯长喙壳菌;生物学特性;致病机制;呋喃萜类毒素;防控方法
中图分类号:Q93文献标识码:A文章编号:1000-4440(2023)05-1256-09Research progress on pathogenicity, toxin production, and control measures of Ceratocystis fimbriataWANG Sen,TIAN Jun,LIU Man
(School of Life Sciences, Jiangsu Normal University, Xuzhou 221116, China)
Abstract:Ceratocystis fimbriata Ellis & Halsted is a widely distributed and devastating phytopathogen causing significant losses in post-harvest sweet potatoes. In addition, sweet potato can be induced to produce furanoterpenoids during the infection of Ceratocystis fimbriata Ellis & Halsted. The toxin can cause hepatoxicity, pneumonia, and lung edema and seriously threaten human health. Therefore, it is urgent to control C. fimbriata and the storage loss of sweet potatoes. The current paper mainly reviewed the biological characteristics, infection pathways, pathogenic conditions, pathogenicity mechanism, synthesis pathway of furanoterpenoid toxins, and the control measures of C. fimbriata. The paper aimed to provide an important theoretical basis for the efficient prevention and control of C. fimbriata and the improvement of the storage quality of sweet potatoes.
Key words:sweet potato;Ceratocystis fimbriata;biological characteristics;pathogenicity;furanoterpenoids;control measures
中国是甘薯生产大国,年产量居世界首位,联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO)统计数据显示,2020年中国甘薯总产量4.920×107 t,约占世界总产量的55%(http://www.fao.org/faostat/en/#data/QC)。然而,甘薯采收时节与市场全年供应的需求相矛盾,因此高效贮藏是保障甘薯产业化发展的关键环节[1]。然而甘薯采后保鲜期短,在贮藏过程中容易受到物理、生理和病原菌损伤,其中由真菌侵染引发的采后病害是造成甘薯贮藏损失的最主要因素[2-3]。
由甘薯长喙壳菌(Ceratocystis fimbriata Ellis & Halsted)侵染引起的甘薯黑斑病(又称黑疤病)[4]是世界上甘薯生产过程中最主要的真菌病害之一,在世界各甘薯产区均有发生,如韩国、日本、美国等[5-7]。甘薯长喙壳菌主要对薯苗、薯块有侵染毒害作用,可发生于幼苗期、生长期及采后贮藏期,引起甘薯植株木质部变褐、枯萎、坏死,并造成薯块溃疡、腐烂,从而造成严重损失。此外,甘薯长喙壳菌的侵染还能诱导甘薯中产生呋喃萜类毒素,如甘薯酮(Ipomeamarone) 、甘薯酮醇(Ipomeamaronol)等,人畜食用后均可中毒,從而严重危害人和牲畜的健康。另外,工业生产中将被甘薯黑斑病病菌侵染的甘薯作为工业发酵原料时,会对工业用菌产生毒害作用,从而延缓发酵生产过程,严重降低发酵产量、质量[8],因此,控制甘薯长喙壳菌造成的甘薯腐败并控制毒素产生,对于中国甘薯产业发展和保障人民群众的健康至关重要。本文主要综述了甘薯长喙壳菌的形态结构、生长特性、侵染途径、发病条件、致病机制及相关防控措施,以期为防治甘薯长喙壳菌污染和提升甘薯采后贮藏品质提供理论依据。
1甘薯长喙壳菌概述
1.1生物学分类
甘薯长喙壳菌(Ceratocystis fimbriata Ellis & Halsted)属于真菌门(Eumycophyta)、子囊菌亚门(Ascomycotina)、核菌纲(Pyrenomycetes)、球壳目(Sphaeriales)、长喙壳科(Ceratocystiaceae)、长喙壳属(Ceratocystis)[9-10]。
1.2形态结构
甘薯长喙壳菌的生长阶段分为无性繁殖阶段和有性生殖阶段,其中无性繁殖阶段产生的孢子有分生孢子和厚垣孢子2种[5]。分生孢子呈串珠状,顶生或侧生,多细胞,直行或卷曲状,颜色为半透明至浅褐色[11];厚垣孢子呈球形,厚壁,黑褐色,多为单细胞或多个细胞串生形成短链,在被侵染病薯皮下大量产生,抗逆能力强,萌发一般需要经过一定时间的休眠[12]。该菌在适宜条件下能发生有性生殖,产生子囊孢子。菌落表型大多为暗褐色,边缘不规则,菌丝呈放射状,表面产生大量子囊壳[10]。子囊壳形似一只长颈烧瓶,具有球形底座,拥有极长颈部,故称壳喙[13]。其内子囊为椭圆形,每个子囊内含8个子囊孢子,呈帽状,无色或半透明,单孢子生长,成熟后在喙端呈团状聚生,萌发时不需休眠,对病菌的传播起到重要作用[14]。研究发现,子囊壳的产生与菌株的生理分化和培养基性质相关[15],例如培养基中的维生素B1能促进菌株的三羧酸循环,然后进入各种代谢途径,从而为子囊壳的产生提供必需的代谢分子;维生素B2、B6在存在钙离子的条件下也可促进子囊壳的产生,但是退化型或者异宗配合型菌株在同种条件下均不可产生子囊壳[16]。
1.3生长特性
研究发现,甘薯长喙壳菌适宜的生长条件如下:碳源为乳糖,氮源为酵母膏,pH值为5.0~12.0,最适pH值为9.0,菌丝致死条件为 55 ℃、10 min或58 ℃、5 min,菌丝对光照不敏感,在有/无光照的条件下均能生长,其中在黑暗条件下的生长状态最好,在光暗交替条件下的生长稍慢,但总体差异不明显[17]。也有研究发现,甘薯长喙壳菌在培养基上的生长温度为9~36 ℃,适宜生长温度为25~30 ℃,致死温度为51~53 ℃,病菌对酸碱度的适应性极强,当pH 值为4.0~12.0时均能生长,最适pH值为6.6[4,18]。沈江卫等[18]研究发现,甘薯长喙壳菌的适宜生长条件为番茄培养基、25 ℃、全光照、pH值8.0。此外,甘薯长喙壳菌的产孢量也受到培养基、温度、光照度和pH值的影响[17]。杨绳桃[19]的研究结果表明,最适宜产孢的甘薯汁培养液条件为蔗糖含量1.5%、pH值7.5、温度25 ℃。上述研究结果产生差异的主要原因可能由于甘薯长喙壳菌是一个复杂且庞大的复合菌种,且分布极广,因此不同地域和寄主来源的菌株在生长特性、致病性、产生毒素等方面均存在差异[4,20]。
2侵染途径和发病条件
2.1寄主侵染及专化性
已有研究发现,甘薯长喙壳菌可侵染多种寄主植物,并且不同寄主、不同地理来源的菌株表现出严格的寄主专化性[21],其在木本、草本植物寄主上能引起枯萎病和黑斑病,寄主植物包括猕猴桃(Actinidia spp.)[22]、无花果(Ficus carica)[23]、石榴(Punica granatum)[24]、杧果(Mangifera indica L.)[25]、梧桐(Platanus spp.)[26]、马黛茶(Ilex paraguariensis)[27]、芋头(Colocasia esculenta)[28]和秘鲁胡萝卜(Arracacia xanthorrhiza)[23]等。在不同寄主中,甘薯长喙壳菌菌株的形态不尽相同[29]。此外,甘薯长喙壳菌对其寄主具有专化性,即分离自甘薯的长喙壳菌不具备侵染其他寄主的能力,但分离自石榴、芋头的菌株虽对甘薯没有致病性,却可以相互侵染对方寄主,且形态一致[24],说明以甘薯为寄主的长喙壳菌具有更强的寄主专化性。
有研究分析了从同一地区采集的多种甘薯长喙壳菌菌株,发现其主要表现为3种不同的亲缘关系,即分离自甘薯(Ipomoea batatas)、法国梧桐(Platanus sp.)和可可(Theobroma cacao)的菌株内转录间隔区(ITS)各不相同,但这些菌株之间能够相互进行有性生殖,表明它们均属于同一个种[30]。上述3种不同来源的菌株对各自的寄主表现出严格的寄主专化性,不能交互侵染其他寄主[26]。即使是相同寄主来源的菌株,具有不同地域来源的菌株之间也存在寄主专化性,例如来源于巴西杧果上的菌株不能侵染南美洲的杧果,表现出明显地域性的寄主专化性[31-32]。
2.2侵染途径和影响因素
甘薯长喙壳菌的寄生性不强,虫害及甘薯采收、贮藏过程中造成的创伤是病菌侵染的主要途径[33]。该菌有多种传播途径和较长的感染时间,在甘薯生长的各个阶段及采后贮藏中均能造成新的感染,从而加大甘薯黑斑病的危害程度[8,33]。在薯块贮藏阶段,甘薯长喙壳菌在贮藏的病薯中主要以菌丝体、子囊孢子、厚垣孢子等形态保存,保存的病菌次年会成为主要侵染源[8]。在采后贮藏甘薯的过程中,甘薯长喙壳菌可通过人畜、昆虫和农具等多种媒介广泛传播[34]。甘薯黑斑病大多发生在虫害及裂口创伤处,初发病时呈黑褐色小圆斑,并逐渐延伸,几个大的、不规则的病斑逐渐合并在一起,病斑中央稍凹陷,当温度、湿度适宜时,會产生灰霉(菌丝体和分生孢子)、黑刺(子囊),病菌会迅速生长并广泛繁殖、传播[4]。
影响甘薯长喙壳菌传播的主要因素有孢子含量、孢子残留时间、环境温度和湿度等[27]。Stahr等[34-35]研究甘薯清洗生产线上水温、孢子含量、孢子残留时间及使用杀菌剂对病斑生长的影响,发现含氯杀菌剂可以减少甘薯长喙壳菌的扩散。1 ml 50个孢子及以上的所有试验含量均可增大病斑直径,且当孢子残留时间短于144 h时,病斑直径与残留时间呈正相关,但是随着残留时间进一步延长,病斑不再变化[33]。相比而言,温度的影响并不显著,只是当温度超过45 ℃后,病斑直径显著减小[34]。与此同时,他们还研究了接种孢子含量、湿度和温度对模型稳定性的影响,结果显示,29 ℃、23 ℃是孢子繁殖的最佳温度,湿度只影响孢子萌发的面积,不影响病斑生长,而在1 ml 1×104~1×106个孢子含量范围内,病斑直径和孢子含量呈正相关[27]。分析2个试验中孢子含量相差比较大的原因,可能由于前者是工业生产模型,后者是人工接种模型。
3致病机制
3.1侵染机制
真菌病原体通过不同的机制侵染寄主植物并与其相互作用,营养方式包括生物营养型、坏死营养型和半生物营养型等[36]。甘薯长喙壳菌被认为是一种半生物营养型的真菌病原体,进入甘薯植物组织中后,先启动生物营养阶段,与活细胞和组织共生,随后侵入活细胞和组织中并大量繁殖,然后切换到坏死营养阶段,杀死宿主细胞,并以死亡组织释放的营养物质为营养源[37]。
3.2生物营养阶段
在生物营养阶段,甘薯长喙壳菌的棒状分生孢子不对称地从一侧萌发,形成“T”形萌发管结构。萌发管发育成1个游动的菌丝,附着在甘薯宿主表皮表面。菌丝可伸长至几百微米,在24 h内进入宿主表皮细胞或继续生长,直到到达合适的进入位置。甘薯盾状腺毛是菌丝进入的最佳媒介,这是一种特殊的分泌结构,可以储存和分泌代谢产物,在甘薯感染长喙壳菌初期,由萌发的分生孢子形成的菌丝体能够直接穿透表皮角质层进行初步侵染,并侵入甘薯盾状腺毛[31]。
菌丝穿透表皮角質层后,分化为胞间侵入性菌丝、胞内侵入性菌丝这2种侵入性菌丝,其中胞间侵入性菌丝生长在表皮和组织细胞之间,然后进入表皮细胞或组织细胞内。与正常菌丝相比,胞间侵入性菌丝节段较少、较厚,呈长管状结构,且细胞壁呈棕色。在细胞间持续感染期间,尤其是在维管束周围,胞间侵入性菌丝是侵入性菌丝的主要形式。胞内侵入性菌丝和胞间侵入性菌丝可相互转化,胞间侵入性菌丝进入活的表皮细胞中后,能够转化为不规则、肿胀的椭圆形、结节状的细胞内侵入性菌丝[31]。
3.3坏死营养阶段
在侵染后期,胞间侵入性菌丝经常从气孔中延伸出来,在感染组织上产生分生孢子。随着侵染的发展,胞间侵入性菌丝进一步转化为胞内侵入性菌丝,细胞中积累了大量胞内侵入性菌丝,胞间侵入性菌丝也沿着组织脉络大量生长,使得维管组织持续感染,最终导致组织褐变[38]。大量胞内侵入性菌丝将甘薯组织杀死,然后从中吸取养分,从而破坏甘薯的组织结构和生理生化过程,使植株产生病害,即黑斑病,导致甘薯植株快速萎蔫,大量细胞组织变为暗黑色,继而变为深褐色或黑色,最后坏死腐烂,病菌继续扩散[34]。
4产毒机制
4.1毒素种类
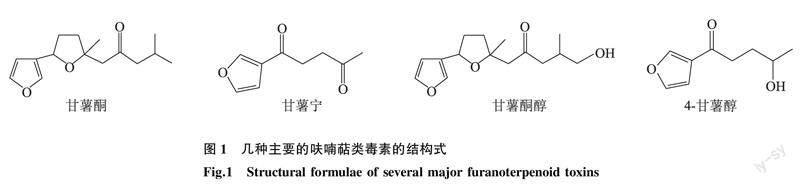
甘薯长喙壳菌侵染甘薯后,诱导甘薯产生对人和牲畜具有毒性的呋喃萜类毒素[38],主要有甘薯酮(Ipomeamarone)、甘薯宁(Ipomeanine)、甘薯酮醇(Ipomeamaronol)、4-甘薯醇(4-Ipomeanol)等,其中甘薯酮为主要的有毒代谢物质[39];甘薯酮、甘薯酮醇都属于肝毒素,主要靶器官为肝脏,可引起肝脏病变;甘薯宁、4-甘薯醇为肺毒素,可致肺水肿,故又称为肺水肿因子或肺毒因子[40]。上述呋喃萜类毒素性质稳定,耐高温,不易被降解或清除,即使经过处理,如高温蒸煮、研磨、粉碎干燥等,仍然具有一定的毒害作用,长期接触或食用含有此类毒素的食品或饮料,会直接影响人体健康[41]。
最初的研究结果显示,甘薯酮只有在病菌侵染部位或腐烂组织中才会产生并积累,不存在于邻近的健康组织中[40]。近年来,科学家研究了邻近健康组织中毒素的分布规律,发现从健康组织中也可以检测出甘薯酮及其前体物质[40]。有研究结果显示,长期食用去除病斑腐烂部分的健康甘薯组织也会对身体造成一定损害[42]。但是呋喃萜类毒素对于甘薯自身而言是很重要的抗病因子,研究结果表明,甘薯酮对甘薯长喙壳菌具有抗菌特性,甘薯组织中甘薯酮的大量合成阻碍了甘薯长喙壳菌的进一步侵入[25]。图1为几种主要的呋喃萜类毒素的结构式。
4.2甘薯酮合成途径
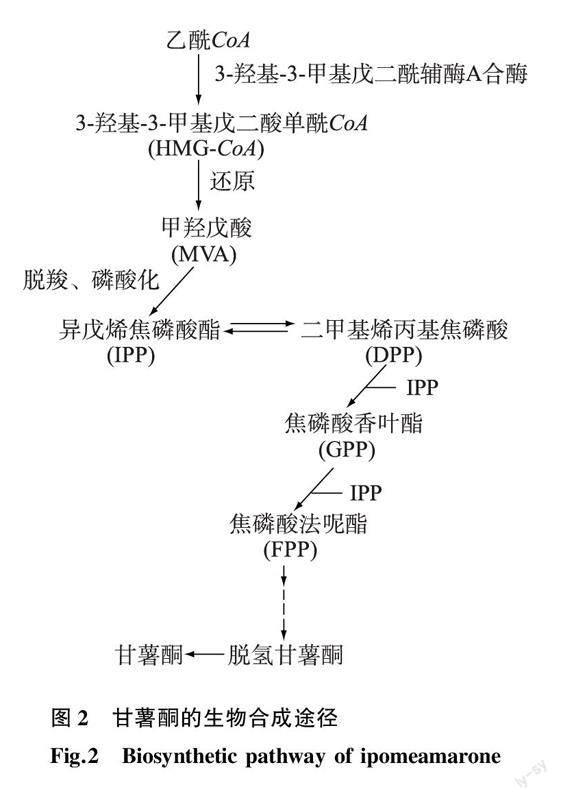
甘薯酮是甘薯长喙壳菌诱导甘薯产生的主要呋喃萜类次级代谢产物之一,也是植物抗病的保护分子之一。甘薯长喙壳菌侵染并诱导甘薯组织中的酚类物质通过酚类酶氧化缩合产生棕色醌类物质,进一步聚合形成黑色素,诱导甘薯病斑部位发生褐变腐败,形成坏死层[25,43],再经过一系列异常代谢,产生多种呋喃萜类物质[40],其中甘薯酮为主要的代谢物,其生成量与病变部位的距离有关,越接近病变部位,其含量越多[44]。放射性同位素示踪试验结果表明,甘薯酮由甲羟戊酸途径(Mevalonate pathway)合成,其中乙酰辅酶A(CoA)、甲羟戊酸(Mevalonic acid, MVA)和焦磷酸异戊烯(Isopentenyl pyrophosphate, IPP)等均参与了甘薯酮的生物合成,此外还发现,甘薯坏死组织中的脱氢甘薯酮(Dehydroipomeamarone)可高效转化为甘薯酮,表明脱氢甘薯酮可作为直接前体转化并合成甘薯酮(图2)[45-46]。
5防控方法
5.1物理防控
甘薯采后贮藏期的病菌主要来源于田间带病薯块,若贮藏期间的温湿度控制不当,会加重病害的发生程度。甘薯贮藏前采用合适的前处理方法可以防止病菌扩散和传播。首先,采用水箱或淋浴系统去除甘薯表面的土壤、碎屑,可以减少病菌数量。然后,分拣受伤严重或感染病菌的甘薯,防止病菌扩散。最后,用45 ℃热水对剩余甘薯进行“冲刷处理”,清除可能存在于甘薯表面的剩余病菌[34]。
在甘薯贮藏前进行愈伤处理也是防控甘薯长喙壳菌传播的有效措施[47]。愈伤处理采用的条件为温度32 ℃、湿度80%~90%处理3~4 d[47],适宜的愈伤处理有利于甘薯采收及贮藏过程中所受机械损伤的愈合,减少因薯块受损伤导致病菌侵入而造成薯块腐烂,从而在愈伤处理、采后贮藏期间降低腐烂率,同时对已感染病菌的薯块也有一定的防病菌扩展作用[38]。此外,贮藏过程中的温湿度控制也是至关重要的。研究发现,贮藏温度较低可抑制病斑发展,但会使产孢量增加;较高的贮藏温度可控制整体病害的发展,然而,在实际大规模贮藏需求下,额外的加温设施不但成本较高而且操作不便,并且可能造成甘薯热损伤,因此应控制贮藏温度在10~14 ℃,控制相对湿度在80%~90%,可降低甘薯长喙壳菌的扩散风险[38]。
5.2化学防控
目前,化学杀菌剂仍是防治甘薯黑斑病的重要手段,在中国除已登记防治该病的代森铵(Amobam)、多菌灵 (Carbendazim)、甲基硫菌灵(Thiophanate-methyl)和乙蒜素(Ethylicin)4种药剂外[48],粉唑醇(Flutriafol)、百菌清(Chlorothalonil)和口恶霉灵(Hymexazol)等也相继被证明对甘薯黑斑病有明显的防治作用[49-50]。此外,甘薯收获后用1.0 μl/L乙烯受体抑制剂1-甲基环丙烯(1-MCP)熏蒸处理24 h,再将其贮藏于15 ℃条件下可降低甘薯失质量率、腐败率[51]。
虽然化学杀菌剂可高效防治甘薯黑斑病,但存在易残留、危害人体健康等不足,且长期使用后存在抗药性风险,因此,寻找高效低毒的天然杀菌剂成为研究的一个热点。近年来,植物精油在谷物、水果、蔬菜等农产品防腐保鲜领域也展现出巨大潜力[52-53]。有研究发现,甘薯藤蔓精油可抑制甘薯长喙壳菌,但是并未对抑菌分子机制进行进一步的探讨[54]。
橙花精油中的活性化合物橙花醇(Nerol)不僅对革兰氏细菌(Gram bacteria)、酵母(Yeast)具有抗菌作用,还能显著抑制甘薯长喙壳菌的菌丝生长和孢子萌发,并呈剂量依赖性。进一步通过转录组测序发现,橙花醇通过调控细胞周期和诱导细胞凋亡从而抑制甘薯长喙壳菌的生长及其造成的甘薯腐败[55]。
紫苏醛是从草本植物紫苏中提取的天然单萜类化合物,具有重要的生物学活性,包括具有抗真菌、抗氧化和抗炎的作用[56]。体内研究结果显示,以人工接种长喙壳菌为食品模型,25 μl/L、50 μl/L和100 μl/L紫苏醛熏蒸处理可显著抑制甘薯病斑直径[56]。体外研究发现,紫苏醛能够抑制长喙壳菌菌丝体生长和孢子萌发,并通过诱导活性氧(ROS)累积、线粒体膜电位下降从而引发真菌凋亡的分子机制来发挥抑菌活性[57-58]。综上所述,植物精油或其主成分可能是控制甘薯长喙壳菌的一种有前景的植物挥发油类杀菌剂[54]。但是植物精油不易溶于水,使用方式存在限制,因此开发出一种高效缓释、控释的药物载体,对于提升植物精油的抗菌活性和扩大植物精油的应用领域具有重要作用。此外,植物精油生物防治剂使用方式的选择也需要确证,诸如喷洒、浸泡、熏蒸的效果仍然具有不确定性。
5.3生物防控
生物防控具有安全、高效、无污染的特点,因此是未来防治甘薯黑斑病的主要方法[51]。目前,关于壳聚糖(Chitosan)、假单胞菌(Pseudomonas adaceae)、芽孢杆菌(Bacillus)及灰霉菌(Botrytis cinerea)的抑菌潜力已有相关报道[59]。壳聚糖表现出对多种食源性微生物的显著抗菌活性,因此在食品工业中应用广泛[60]。近年来,壳聚糖抑制甘薯长喙壳菌的潜力也受到了关注。有研究发现,单独使用壳聚糖可影响甘薯长喙壳菌抗氧化酶系统和细胞膜的完整性,从而抑制长喙壳菌生长及其造成的甘薯腐败[61-62]。相对分子质量更小的壳寡糖单独使用也可通过依赖于半胱氨酸蛋白酶的线粒体途径诱导甘薯长喙壳菌细胞凋亡,从而抑制菌丝生长和孢子萌发,达到抑菌效果[63]。此外,壳聚糖也可作为小分子化学抑菌剂的输送载体,显著提高化学抑菌剂的抑菌效果[60]。
芽孢杆菌对甘薯黑斑病病菌的抑制作用可能归因于该菌释放的抑菌物质,如水解酶,水解酶能够降解细胞壁并抑制脂肽(Lipopeptide,LPP)的产生,从而直接干扰植物病原真菌的菌丝生长,并且芽孢杆菌能够产生坚硬、有抗性的内生孢子,具有较强的稳定性,因此被认为是最具有发展潜力的生物防治剂[64]。杨冬静等[65-66]先后从甘薯根际土壤中分离得到解淀粉芽孢杆菌(Bacillus amyloliquefaciens) XZ-1和YTB1407,并研究其对甘薯长喙壳菌的抑制作用,结果显示,内生解淀粉芽孢杆菌可诱导植物产生次级代谢产物过氧化氢、水杨酸,水杨酸、过氧化氢作为抗病物质和信号能够促进甘薯抗病基因NPR1、PR1的表达,从而诱导甘薯抗病[66]。
有研究结果显示,泛菌属、假单胞菌和根际放线菌等也可发挥抑制甘薯长喙壳菌的作用[51,67-68],其发挥抑菌活性的主要成分为挥发性有机物(如3-甲基-1-丁醇),从而揭示了生防菌用于熏蒸防腐的潜力[3,67,69]。
但是生防菌的配方不稳定,易失活,且配方在田间或贮藏空间的有效性仍然需要验证,另外,生防菌使用方式的选择也需要确证,如喷洒、浸泡、熏蒸的效果仍然具有不确定性。
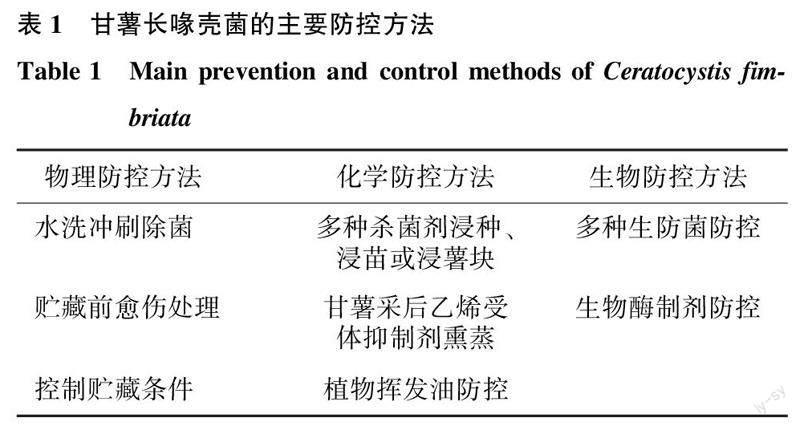
除了上述生防菌外,生物酶制剂也具有较好的抑菌效果。有研究发现,从甘薯中分离的几丁质酶能显著抑制甘薯长喙壳菌菌丝生长,减轻甘薯切片和块根表面的腐败症状,在防治甘薯黑斑病领域也具有较好的应用前景[70]。表1为甘薯长喙壳菌的几种主要防控方法。
6结论与展望
甘薯长喙壳菌侵染引起的甘薯黑斑病已成为全球甘薯主产区面临的主要病害,在甘薯采后贮藏过程中会造成巨大经济损失,因此加紧防控势在必行。但是目前应用于控制甘薯长喙壳菌的杀菌剂对于真菌传播和发展的抑制作用有限,并且与病原菌种群的起源有关,因此在甘薯采后贮藏环节应改变或优化处理管理策略,避免感染的病薯在不同地区之间及不同国家之间传播,防止具有高度侵袭性的真菌分离株的扩散,减少由长喙壳菌侵染造成的损失。
生防试剂、壳聚糖、挥发油等物质已经被证明具有较好的抑菌效果,但是尚未实现商品化,因此需要克服新型杀菌剂商品化途径中的一系列瓶颈,包括生防试剂的成本、稳定性、便捷性、适用性,壳聚糖的水溶性、质量控制,挥发油成分的复杂性、靶标的不确定性,以及使用方式的选择等。
甘薯采后的安全和高效贮藏至关重要,但是国内很少有大型高标准的甘薯贮藏库,因此甘薯贮藏库的建设是另一个挑战。随着甘薯贮藏机制研究的深入,甘薯贮藏也将向着科学化方向发展。在未来,除研究安全保鲜种薯方法外,针对鲜食市场的需求,需切实提高采后甘薯的贮藏条件,从而实现甘薯周年供应,促进薯农增收[71]。
目前国内外有关甘薯病原菌控制的相关研究较多关注甘薯抗病品种的选育,也取得了顯著成果,但是对于甘薯长喙壳菌与寄主的相互作用机制、毒素合成的具体途径及高效绿色的抑菌方法的研究仍然略显贫乏。此外,甘薯长喙壳菌可以诱导甘薯产生呋喃萜类毒素,但是关于其自身是否能够产毒、产生何种毒素等问题均未知。本文基于已有研究结果综述了甘薯长喙壳菌的生物学特性、侵染途径、发病条件、致病机制、呋喃萜类毒素的合成途径及其防控方法等方面的内容,并指出了目前有关研究存在的问题和未来研究的方向,以期为甘薯黑斑病病菌的防治和甘薯采后贮藏品质的提升提供参考。
参考文献:
[1]韦强,黄漫青,满杰. 甘薯绿色高效保鲜库及其保鲜贮藏方法: CN111567234B[P]. 2022-03-18.
[2]RAY R C. Post harvest spoilage of sweetpotato in tropics and control measures[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(7/8): 623-644.
[3]GONG Y, LIU J Q, XU M J, et al. Antifungal volatile organic compounds from Streptomyces setonii WY228 control black spot disease of sweet potato[J]. Applied Environmental Microbiology, 2022, 88(6): e0231721.
[4]李倩,邓吉,杨敏,等. 引起石榴枯萎病和甘薯黑斑病的甘薯长喙壳菌菌株生物学特性的比较研究[J]. 菌物学报, 2009, 28(2): 189-196.
[5]PAUL N C, NAM S S, KACHROO A, et al. Characterization and pathogenicity of sweet potato (Ipomoea batatas) black rot caused by Ceratocystis fimbriata in Korea[J]. European Journal of Plant Pathology, 2018, 152: 833-840.
[6]OKADA Y, KOBAYASHI A, TABUCHI H, et al. Review of major sweet potato pests in Japan, with information on resistance breeding programs[J]. Breeding Science, 2017, 67(1): 73-82.
[7]SCRUGGS A C, BASAIAH T, ADAMS, et al. Genetic diversity, fungicide sensitivity, and host resistance to Ceratocystis fimbriata infecting sweetpotato in North Carolina[J]. Plant Disease, 2017, 101(6): 994-1001.
[8]贾赵东,郭小丁,尹晴红,等. 甘薯黑斑病的研究现状与展望[J]. 江苏农业科学, 2011(1): 144-147.
[9]MARIN-FELIX Y, GROENEWALD J Z, CAI L, et al. Genera of phytopathogenic fungi: GOPHY 1[J]. Studies in Mycology, 2017, 86: 99-216.
[10]STAHR M N, QUESADA-OCAMPO L M. Black rot of sweetpotato: a comprehensive diagnostic guide[J]. Plant Health Progress, 2019, 20(4): 255-260.
[11]李倩,邓吉,李健强. 甘薯长喙壳菌产生芳香性气体物质研究进展[J]. 植物保护, 2009, 35(4): 8-14.
[12]韩永花,李晓,杨俊誉,等. 中国发现甘薯长喙壳菌引起枣子果实腐烂[J]. 植物病理学报, 2015, 45(4): 356-360.
[13]郭亮虎,逯腊虎,王镇,等. 山西省甘薯主要病害及防治技术研究进展[J]. 山西农业科学, 2020, 48(8): 1351-1354.
[14]XU K, ZHANG R, LU H, et al. First report of coffee canker disease caused by Ceratocystis fimbriata in China[J]. Plant Disease, 2022, 106(6): 1756.
[15]PARADA-ROJAS C, PECOTA K, ALMEYDA C, et al. Sweetpotato root development influences susceptibility to black rot caused by the fungal pathogen Ceratocystis fimbriata[J]. Phytopathology, 2021, 111(9): 1660-1669.
[16]BEER Z D, DUONG T A, BARNES I, et al. Redefining Ceratocystis and allied genera[J]. Studies in Mycology, 2014, 79: 187-219.
[17]ZHANG Y, LI X, XING S, et al. First report of a new postharvest disease of pear fruit caused by Ceratocystis fimbriata in Kunming, China[J]. Plant Disease, 2022, 106(12): 3216.
[18]沈江卫,古树江,陈书龙. 培养条件对甘薯黑斑病菌生长与产孢量的影响[J]. 河北农业科学, 2010, 14(9): 68-71.
[19]杨绳桃. 不同培养条件对甘薯黑斑病菌产孢量的影响[J]. 华中农业大学学报, 1995, 14(4): 353-355.
[20]HARRINGTON T C, HUANG Q, FERREIRA M A, et al. Genetic analyses trace the Yunnan, China population of Ceratocystis fimbriata on pomegranate and taro to populations on Eucalyptus in Brazil[J]. Plant Disease, 2015, 99(1): 106-111.
[21]DOS SANTOS A F, FERREIRA M A, AUER C G, et al. First report of Yerba Mate Wilt caused by Ceratocystis fimbriata in Brazil[J]. Plant Disease, 2018, 102(11): 2381.
[22]OLIVEIRA L S S, PIMENTA L V A, GUIMARAES L M S, et al. Resistance of kiwifruit cultivars to Ceratocystis wilt: an approach considering the genetic diversity and variation in aggressiveness of the pathogen[J]. Plant Pathology, 2021, 70(2): 349-357.
[23]MELO M P, PIMENTA L, OLIVEIRA L S S, et al. First report of Ceratocystis fimbriata causing black rot on Arracacia xanthorrhiza in Brazil[J]. Plant Disease, 2016, 100(3): 652-653.
[24]鄒琳,蒋艳红,于磊,等. 石榴、芋头、甘薯寄主的甘薯长喙壳菌形态学研究[J]. 云南大学学报(自然科学版), 2008(增刊1): 81-85.
[25]HARRINGTON T C, THORPE D J, ALFENAS A C. Genetic variation and variation in aggressiveness to native and exotic hosts among Brazilian populations of Ceratocystis fimbriata[J]. Phytopathology, 2011, 101(5): 555-566.
[26]BAKER C J, HARRINGTON T C, KRAUSS U, et al. Genetic variability and host specialization in the Latin American clade of ceratocystis fimbriata[J]. Phytopathology, 2003, 93(10): 1274-1284.
[27]STAHR M, QUESADA-OCAMPO L. Assessing the role of temperature, inoculum density, and wounding on disease progression of the fungal pathogen Ceratocystis fimbriata causing black rot in sweetpotato[J]. Plant Disease, 2020, 104(3): 930-937.
[28]LIU F F, BARNES I, ROUX J, et al. Molecular phylogenetics and microsatellite analysis reveal a new pathogenic Ceratocystis species in the Asian-Australian clade[J]. Plant Pathology, 2018, 67(5): 1097-1113.
[29]AL-ADAWI A O, BARNES I, KHAN I A, et al. Ceratocystis manginecans associated with a serious wilt disease of two native legume trees in Oman and Pakistan[J]. Australasian Plant Pathology, 2013, 42(2): 179-193.
[30]SCHOCH C L, SEIFERT K A, HUHNDORF S, et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for fungi[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(16): 6241-6246.
[31]SUN Y, LI M Q, WANG Y S, et al. Ceratocystis fimbriata employs a unique infection strategy targeting peltate glandular trichomes of sweetpotato (Ipomoea batatas) plants[J]. Phytopathology, 2020, 110(12): 1923-1933.
[32]MONTEZANO FERNANDES F, VIEIRA DE QUEIROZ M, LOPES DA SILVA L, et al. Chromosomal polymorphism of the Ceratocystis fimbriata species complex in Brazil[J], 2022, 162: 103728.
[33]WU J W, PANG L J, ZHANG X Q, et al. Early discrimination and prediction of Ceratocystis fimbriata-infected sweetpotatoes during the asymptomatic period using electronic nose[J]. Foods, 2020, 11(13): 1919.
[34]STAHR M N, QUESADA-OCAMPO L M. Effects of water temperature, inoculum concentration and age, and sanitizer presence on infection of Ceratocystis fimbriata, causal agent of black rot in sweet potato[J]. Plant Disease, 2021, 105(5): 1365-1372.
[35]PARADA-ROJAS C H, PECOTA K, ALMEYDA C, et al. Sweetpotato root development influences susceptibility to black rot caused by the fungal pathogen Ceratocystis fimbriata[J]. Phytopathology, 2021, 111(9): 1660-1669.
[36]LIBERA L P, DANIEL L, GABRIEL S, et al. Fungal effectors and plant susceptibility[J]. Annual Review of Plant Biology, 2015(66): 513-545.
[37]KABBAGE M, YARDEN O, DICKMAN M B. Pathogenic attributes of Sclerotinia sclerotiorum: switching from a biotrophic to necrotrophic lifestyle[J]. Plant Science, 2015, 233: 53-60.
[38]韋强,郑丽静,满杰,等. 甘薯预贮愈伤方法及其对贮藏保鲜效果的影响[J]. 安徽农业科学, 2020, 48(19): 189-193.
[39]赵玉花. 甘薯黑斑病的发生与防治[J]. 农业知识, 2017, 32: 15-16.
[40]WAMALWA L N, CHESETO X, OUNA E, et al. Toxic ipomeamarone accumulation in healthy parts of sweet potato (Ipomoea batatas L. Lam) storage roots upon infection by rhizopus stolonifer[J]. Journal of Agricultural Food Chemistry, 2015, 63(1): 335-342.
[41]高博. 牛霉烂甘薯中毒的病因及诊治[J]. 饲料博览, 2019(1): 75.
[42]申燕飞. 贮藏因素对采后甘薯中甘薯酮积累的影响[D]. 临安:浙江农林大学, 2018.
[43]HE Q, LUO Y G. Enzymatic browning and its control in fresh-cut produce[J]. Stewart Postharvest Review, 2007, 3(6): 1-7.
[44]张德胜,乔奇,田雨婷,等. 5种杀菌剂对储藏期甘薯黑斑病的防效及对薯块的安全性评价[J]. 植物保护, 2015, 41(6): 221-224.
[45]AMOAH R S, TERRY L A. 1-Methylcyclopropene (1-MCP) effects on natural disease resistance in stored sweet potato[J]. Journal of the Science of Food Agriculture, 2018, 98(12): 4597-4605.
[46]庞林江,路兴花,成纪予,等. 甘薯酮检测方法研究进展[J]. 食品安全质量检测学报, 2020, 11(24): 9164-9168.
[47]中国作物学会甘薯专业委员会. 中国甘薯:第7卷[M]. 北京:中国农业科学技术出版社, 1994: 77-80.
[48]CHEN Y, ZHOU Y D, LABORDA P, et al. Mode of action and efficacy of quinolinic acid for the control of Ceratocystis fimbriata on sweet potato[J]. Pest Management Science, 2021, 77(10): 4564-4571.
[49]ZHANG H Y, MAHUNU G K, CASTORIA R, et al. Recent developments in the enhancement of some postharvest biocontrol agents with unconventional chemicals compounds[J]. Trends in Food Science & Technology, 2018, 78: 180-187.
[50]張德胜,白瑞英,乔奇,等. 甲基硫菌灵和百菌清浸苗防治甘薯黑斑病的影响因素分析[J]. 农药学学报, 2021, 23(2): 331-340.
[51]JIANG L M, JEONG J C, LEE J S, et al. Potential of Pantoea dispersa as an effective biocontrol agent for black rot in sweet potato[J]. Scientific Reports, 2019, 9(1): 16354.
[52]REYES-JURADO F, NAVARRO-CRUZ A R, OCHOA-VELASCO C E, et al. Essential oils in vapor phase as alternative antimicrobials: a review[J]. Critical Reviews in Food Science Nutrition, 2019, 60(10): 1641-1650.
[53]YUAN B, XUE L W, ZHANG Q Y, et al. Essential oil from sweet potato vines, a potential new natural preservative, and an antioxidant on sweet potato tubers: assessment of the activity and the constitution[J]. Journal of Agricultural Food Chemistry, 2016, 64(40): 7481-7491.
[54]PINTO E, GONALVES M J, OLIVEIRA P, et al. Activity of Thymus caespititius essential oil and alpha-terpineol against yeasts and filamentous fungi[J]. Industrial Crops Products, 2014, 62: 107-112.
[55]LI X Z, LIU M, HUANG T G, et al. Antifungal effect of nerol via transcriptome analysis and cell growth repression in sweet potato spoilage fungi Ceratocystis fimbriata[J]. Postharvest Biology Technology, 2020, 171: 111343.
[56]CHEN L, QU S, YANG K L, et al. Perillaldehyde: a promising antifungal agent to treat oropharyngeal candidiasis[J]. Biochemical Pharmacology, 2020, 180: 114201.
[57]ZHANG M, LIU M, PAN S Y, et al. Perillaldehyde controls postharvest black rot caused by Ceratocystis fimbriata in sweet potatoes[J]. Frontiers in Microbiology, 2018, 9: 1102.
[58]TIAN J, PAN C, ZHANG M, et al. Induced cell death in Ceratocystis fimbriata by pro-apoptotic activity of a natural organic compound, perillaldehyde, through Ca2+ overload and accumulation of reactive oxygen species[J]. Plant Pathology, 2019, 68(2): 344-357.
[59]WANG T, WANG X C, HAN M H, et al. Enhanced spoVF operon increases host attachment and biocontrol ability of Bacillus subtilis for the management of Ceratocystis fimbriata in sweet potato[J]. Biological Control, 2021, 161: 104651.
[60]YUAN B, JIA H, BU W, et al. A new chitosan sub-micron and encapsulated Iturin A with enhanced antifungal activity against Ceratocystis fimbriata and Rhizopus strolonifer[J]. International Journal of Biological Macromolecules, 2020, 159: 995-1003.
[61]XING K, LI T J, LIU Y F, et al. Antifungal and eliciting properties of chitosan against Ceratocystis fimbriata in sweet potato[J]. Food Chemistry, 2018, 268: 188-195.
[62]LI T J, ZHANG Y, XU M J, et al. Novel antifungal mechanism of oligochitosan by triggering apoptosis through a metacaspase-dependent mitochondrial pathway in Ceratocystis fimbriata[J]. Carbohydrate Polymers, 2020, 245: 116574.
[63]XING K, XING Y, LIU Y F, et al. Fungicidal effect of chitosan via inducing membrane disturbance against Ceratocystis fimbriata[J]. Carbohydrate Polymers, 2018, 192: 95-103.
[64]MEZZOMO R, PIVETA G, LAZAROTTO M, et al. Biological control of Ceratocystis fimbriata by Bacillus subtilis on Acacia mearnsii seedlings[J]. Floresta e Ambiente, 2019, 26(4): e20160195.
[65]杨冬静,孙厚俊,赵永强,等. 甘薯黑斑病菌的生物学特性研究及室内药剂筛选[J]. 西南农业学报, 2013, 26(6): 2336-2339.
[66]WANG C J, WANG Y Z, CHU Z H, et al. Endophytic Bacillus amyloliquefaciens YTB1407 elicits resistance against two fungal pathogens in sweet potato (Ipomoea batatas (L.) Lam.)[J]. Journal of Plant Physiology, 2020, 253: 153260.
[67]LI X W, LI B B, CAI S R, et al. Identification of rhizospheric actinomycete streptomyces lavendulae SPS-33 and the inhibitory effect of its volatile organic compounds against Ceratocystis fimbriata in postharvest sweet potato (Ipomoea batatas (L.) Lam.)[J]. Microorganisms, 2020, 8(3): 319.
[68]ZHANG Y, LI T J, LIU Y F, et al. Volatile organic compounds produced by pseudomonas chlororaphis subsp. aureofaciens SPS-41 as biological fumigants to control Ceratocystis fimbriata in postharvest sweet potatoes[J]. Journal of Agricultural Food Chemistry, 2019, 67(13): 3702-3710.
[69]XU M J, GUO J H, LI T J, et al. Antibiotic effects of volatiles produced by XK29 against the black spot disease caused by in postharvest sweet potato[J]. Journal of Agricultural Food Chemistry, 2021, 69(44): 13045-13054.
[70]LIU M Y, GONG Y, SUN H J, et al. Characterization of a novel chitinase from sweet potato and its fungicidal effect against Ceratocystis fimbriata[J]. Journal of Agricultural Food Chemistry, 2020, 68(29): 7591-7600.
[71]孫书军,周志林,张安,等. 影响甘薯种薯安全贮藏的主要因素及防控技术[J]. 农业开发与装备, 2020(6): 192-193.
(责任编辑:徐艳)

