非洲猪瘟病毒无标签p35蛋白的制备及间接ELISA抗体检测方法的建立
吴植 卢会鹏 王安平 谢军 曹世诺 徐艳 朱善元

摘要:為了进一步提高非洲猪瘟病毒(ASFV)间接酶联免疫吸附试验(ELISA)抗体检测方法的特异性,本研究构建了类弹性蛋白(ELP)标签与ASFV p35融合表达载体,利用相变循环分离纯化融合蛋白后,用烟草蚀纹病毒蛋白酶(TEVP)切除ELP标签,制备获得无标签p35蛋白,以此为包被抗原,通过一系列的条件摸索和优化,建立ASFV间接ELISA抗体检测方法。结果显示,ELP-p35融合蛋白的相对分子质量大小约为80 000;制备获得的无标签p35蛋白能够被非洲猪瘟阳性血清所识别;抗原包被最佳质量浓度为2.00 μg/ml,待检血清最佳稀释比例为1∶200,二抗最佳稀释比例为1∶10 000,阴性和阳性判定阈值OD450为0.171;与口蹄疫病毒(FMDV)、猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)和伪狂犬病毒(PRV)等阳性血清无交叉反应,特异性好;批内、批间试验结果显示变异系数都小于5.000%,重复性好;可检测400倍稀释的血清,敏感性较高;与商品化检测试剂盒(ING)检测结果的符合率高达100%。结果表明,用本研究制备的ASFV无标签p35蛋白作为包被抗原建立的间接ELISA方法可用于ASFV抗体的检测,为该病的进一步精准检测提供了技术手段。
关键词:非洲猪瘟;类弹性蛋白;无标签p35蛋白;间接ELISA方法
中图分类号:S852.65+1 文献标识码:A文章编号:1000-4440(2023)05-1209-08
Preparation of tag-free p35 of African swine fever virus and development of an indirect enzyme linked immunosorbent assay (ELISA) antibody detection methodWU Zhi,LU Hui-peng,WANG An-ping,XIE Jun,CAO Shi-nuo,XU Yan,ZHU Shan-yuan
(Jiangsu Agri-Animal Husbandry Vocational College/Jiangsu Key Laboratory for High-Tech Research and Development of Veterinary Biopharmaceuticals/Engineering Technology Research Center for Modern Animal Science and Novel Veterinary Pharmaceutic Development, Taizhou 225300, China)
Abstract:To further improve the specificity of indirect enzyme linked immunosorbent assay (ELISA) method for detection of African swine fever virus (ASFV) antibody, fusion expression vector containing elastin-like polypeptide (ELP) tag and ASFV p35 was constructed. After separating and purifying the fusion protein by inverse transition cycling, the tag-free p35 protein was obtained by cutting off the ELP tag by tobacco etch virus protease (TEVP). Using the purified recombinant protein as coating-antigen, the study aimed to establish an indirect ELISA method for detecting ASFV antibody through a series of condition exploration and purification. The results showed that, the relative molecular mass of ELP-p35 fusion protein was 80 000, and the obtained tag-free p35 protein could be recognized by positive serum of ASFV. It was found that the optimum antigen coating mass concentration was 2.00 μg/ml, the optimum dilution rate for sera to be tested was 1∶200, the optimum dilution rate for HRP-IgG was 1∶10 000, and the cut-off value of OD450was 0.171. The method showed no cross-reaction with positive sera of foot-and-mouth disease virus (FMDV), porcine circovirus type 2 (PCV2), porcine reproductive and respiratory syndrome virus (PRRSV), classical swine fever virus (CSFV) and pseudorabies virus (PRV), which showed high specificity. Coefficients of variation of the intra- and inter-assay were both <5.000% and showed good repeatability. Besides, the method could detect serum diluted 400 times, which showed high sensitivity. Compared with commercialized detection kits (ING), the coincidence rate of testing results of tag-free p35-ELISA method was 100%. The results indicated that the established indirect ELISA method by using tag-free p35 protein as coating antigen of ASFV can be applied in detection of ASFV-specific antibodies, which can provide technological tool for accurate detection of ASFV.
Key words:African swine fever;elastin-like polypeptide;tag-free p35 protein;indirect ELISA
江苏农业学报2023年第39卷第5期吴植等:非洲猪瘟病毒无标签p35蛋白的制备及间接ELISA抗体检测方法的建立非洲猪瘟病毒(African swine fever virus,ASFV)感染可引起家猪和野猪高热和全身性出血,是一种高度接触性传染病,各种年龄家猪均易感,病死率可达100%[1]。非洲猪瘟病毒最早于1921年在肯尼亚发现,随后蔓延至西欧、拉美等国家和地区[2]。2018年8月首次传入中国,并迅速扩散于国内多个地区,给生猪养殖业造成了严重的经济损失[3-4]。
ASFV呈20面体对称,其基因组为双股DNA分子,全长170~194 kb,编码150~200个蛋白质,大部分为结构蛋白质,目前仍有一半以上的蛋白质功能尚不清楚[5-7]。除结构蛋白质外,病毒具有完整的酶系统[8]、编码免疫逃逸相关的蛋白质[9]、能够吸附红细胞 [10-11]、侵害单核-巨噬细胞[12]等特点,以上病原学特点和感染特性给非洲猪瘟(ASF)的疫苗研制带来巨大挑战,至今尚无有效的疫苗问世。ASF的防控以病原检测和扑杀为主。经过长时间的传播和流行,ASFV在中国发生了不同形式的变异,出现了自然弱毒株与强毒株同时存在的新情况,致使感染猪出现超长潜伏期感染,给非洲猪瘟的精准剔除或“拔牙”增加了困难。因此监测 ASFV感染抗体成为早期发现 ASF 的重要手段之一。研究结果表明,由ASFV CP530R基因编码的pp62蛋白具有较高的免疫原性[13],感染猪后会产生较高水平的pp62抗体,通过间接酶联免疫吸附试验(ELISA)检测pp62抗体能够快速准确地检测感染猪的情况。多聚蛋白pp62在病毒颗粒成熟过程中,被S273R蛋白酶水解切割为p15和p35 2个主要蛋白质[14],p35的释放是病毒颗粒成熟的重要标志[15]。
类弹性蛋白多肽(Elastin-like polypeptide,ELP)是一种五肽聚合物,具有对温度敏感、可逆相变特性,可作为纯化标签实现外源蛋白质的纯化[16]。本研究将p35蛋白与ELP融合表达,利用可逆相变特性获得纯化蛋白质。为了减少假阳性,用烟草蚀纹病毒蛋白酶(TEVP)切除ELP,获得无标签可溶性p35蛋白,建立间接ELISA检测方法,为ASFV病毒抗体精准检测提供了有效的技术手段。
1材料与方法
1.1材料
感受态细胞BL21(DE3)与 PCR产物回收试剂盒购自南京诺唯赞生物科技股份有限公司,DNA质粒提取试剂盒购自安诺伦(北京)生物科技有限公司,连接酶、限制性内切酶和 DNA Marker均购自宝生物工程(大连)有限公司,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白质凝胶配制试剂盒购自北京索莱宝科技有限公司。ASFV标准阳性血清购自国家兽医微生物菌(毒)种保藏中心,商品化抗体检测试剂盒购自西班牙英吉纳公司。原核表达载体pET-ELP由本实验室构建并保存。
1.2引物设计
参照pUC-pp62序列,设计上下游引物,上游引物序列(F)为:5′-AAGAAGGAGATATAGGTGAGCTCCGAAAACCTGTACTTCCAGGGTAACGACCCCCCCGTGCCCAA-3′,下游引物序列(R)为: 5′- GTGGTGGTGGTGGTGCTCGAGTTAAACCTTCTCCTCGGGGAT-3′。斜体处分别是Sac Ⅰ和Xho Ⅰ酶切位点序列,加粗处为TEVP酶切位点序列,引物由英潍捷基(上海)贸易有限公司合成。
1.3pELP-p35融合表达载体的构建与鉴定
以p35重组质粒为模板进行PCR扩增,回收p35基因片段。PCR扩增体系为30 μl:p35重组质粒1 μl,上下游引物各1 μl,2×PrimeSTAR Max Premix 15 μl,ddH2O 12 μl。PCR反應程序:98 ℃ 2 min;98 ℃ 10 s,56 ℃ 10 s,72 ℃ 10 s,30个循环;72 ℃ 2 min。用Sac Ⅰ和Xho Ⅰ分别双酶切pET-ELP与p35基因片段,4 ℃过夜连接回收产物,转化,提取阳性质粒进行双酶切鉴定。
1.4ELP-p35融合蛋白的诱导表达与可逆相变循环(ITC)纯化将pELP-p35转化BL21(DE3),在营养琼脂平板(含50 μg/ml卡那霉素)上37 ℃培养过夜;挑取单克隆接种于5 ml LB培养基(50 μg/ml卡那霉素)中,37 ℃、220 r/min过夜培养活化;将重组菌液按体积比1∶100接种于200 ml 2×YT培养基(50 μg/ml卡那霉素)中,37 ℃、220 r/min培养至OD600约为0.6~0.8时,加入0.2 mmol/L 异丙基-β-D-硫代半乳糖苷(IPTG),20 ℃ 180 r/min过夜诱导,同时设置对照;诱导结束后用超声波破碎仪将菌液破碎10 min,直至液体清亮;将破碎后的菌液于4 ℃、8 000 r/min离心8 min,分别收集上清液、沉淀,沉淀用等量磷酸盐缓冲液(PBS)悬浮,各取10 μl进行SDS-PAGE电泳。在重组菌破碎离心的上清液中加入6 mol/L NaCl溶液,在22 ℃、24 ℃、26 ℃、28 ℃、30 ℃孵育10 min,12 000 g离心10 min,分别取沉淀制样,进行SDS-PAGE分析,根据蛋白质条带大小确定ITC最佳温度;在重组菌上清液中分别加入不同浓度的氯化钠溶液至终浓度为1.5 mol/L、2.0 mol/L、2.5 mol/L和3.0 mol/L,28 ℃孵育10 min,28 ℃、12 000 g离心10 min,用300 μl TEVP反应液重悬沉淀,进行SDS-PAGE分析,根据蛋白质条带含量大小确定可逆相变循环(ITC)纯化的氯化钠最佳浓度。
1.5无标签p35蛋白的制备与鉴定
纯化ELP-p35融合蛋白的相变循环参照文献[17]的方法进行,将重组菌裂解液与等量6 mol/L NaCl混匀,28 ℃孵育10 min,室温下12 000 g离心5 min,沉淀用TEVP溶液重悬,4 ℃孵育30 min,4 ℃、12 000 g离心10 min,收集上清液,取上清液10 μl进行SDS-PAGE电泳分析。标签ELP切割参考Li等[18]的方法进行,蛋白酶用量为100 μg/ml,30 ℃孵育36 h;4 ℃、16 000 g离心10 min;与等量6 mol/L NaCl混合,28 ℃孵育10 min;室温下14 000 g离心5 min,离心后的上清液用PBS(pH 7.2)透析2次,每次2 h,4 ℃、14 000 g离心10 min,收集上清液即为纯化无标签重组p35蛋白。将切割回收的蛋白质通过SDS-PAGE分离并转移到聚偏二氟乙烯膜(PVDF)上,封闭后加入体积比1∶200稀释的ASFV抗体阳性血清孵育2 h,用含有吐温20(Tween-20)的Tris盐缓冲液(TBST)洗涤4次,加入羊抗猪IgG二抗反应45 min,TBST洗膜4次后,滴加超敏发光液并置于化学发光仪内曝光。
1.6间接ELISA方法的建立
1.6.1抗原最适质量浓度与血清最佳稀释度的确定采用棋盘滴定方法,将不同质量浓度(8.0 μg/ml、4.0 μg/ml、2.0 μg/ml、 1.0 μg/ml、0.5 μg/ml、0.25 μg/ml)的p35包被到酶标板中,每孔100 μl,4 ℃过夜;用 TBST洗涤4次,用5%脱脂牛奶封闭1 h;按照1∶100、1∶200、1∶400、1∶800稀释倍比加入标准阴性血清、标准阳性血清,每孔100 μl,37 ℃ 1 h,洗涤4次,加入辣根过氧化物酶(HRP)标记羊抗猪IgG(1∶10 000),37 ℃孵育30 min后洗涤;加入四甲基联苯胺(TMB)显色反应10 min;用50 μl稀硫酸终止反应,测定OD450;以标准阳性血清OD450接近1,阳性血清OD450与阴性血清OD450的比值(P/N值)最大的孔蛋白质包被质量浓度和血清稀释度作为最适包被质量浓度和血清最佳稀释度。
1.6.2其他反应条件的优化以优化的最佳抗原包被质量浓度和血清稀释度,对包被液(去离子水、0.05 mol/L pH 9.6碳酸盐缓冲液、pH 7.2 PBS、0.05 mol/L pH 8.5 Tris-HCl缓冲液)、封闭液[5%卵清蛋白(OVA)、5%脱脂牛奶、5%牛血清白蛋白、1%明胶、1%海藻糖]、血清稀释液(1%脱脂牛奶、3%脱脂牛奶、5%脱脂牛奶)、酶标抗体稀释度(1∶5 000、1∶7 000、1∶10 000、1∶15 000、1∶20 000、1∶40 000)和底物显色时间(5 min、10 min、15 min、20 min)等条件进行优化,每个反应设置3个重复孔,测定OD450,取其平均值。
1.6.3阴性与阳性标准临界值的确定以优化后的p35-ELISA检测条件对已知143份阴性血清进行检测,计算OD450平均值(x—)和标准差(SD),当OD450大于等于x—+3SD时判定为阳性;小于x—+3SD时判定为阴性。
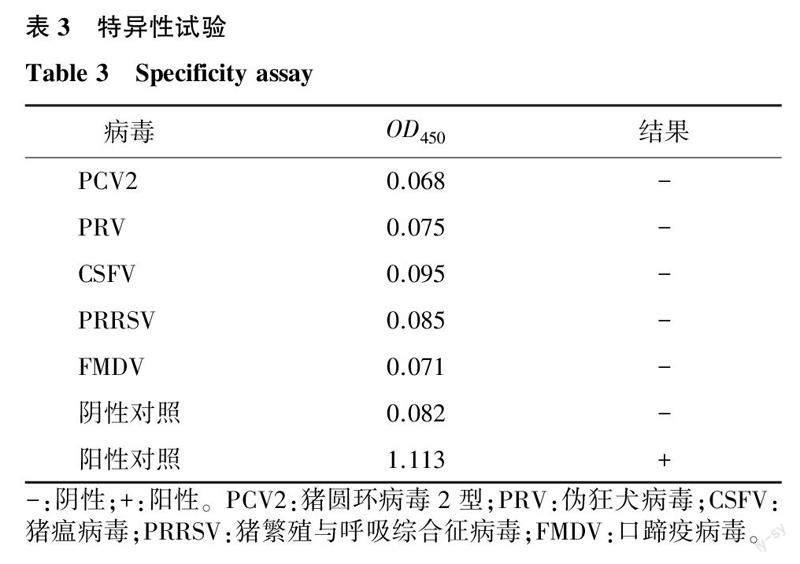
1.6.4特异性试验按照最优的检测条件,对口蹄疫病毒(FMDV)、猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)和伪狂犬病毒(PRV)等抗体阳性血清进行特异性检测,同时设置标准阴性血清对照和标准阳性血清对照,3次重复,测定OD450,取平均值,判斷是否存在非特异性交叉反应,判定特异性。
1.6.5重复性试验按照最优的检测条件,用相同批次及不同批次制备的无标签p53蛋白作为包被抗原检测6份血清,其中阳性血清5份,阴性血清1份,每个样品重复3孔,测定OD450,取其平均值,计算批内试验和批间试验变异系数,分析重复性。
1.6.6敏感性试验在最优条件下,将标准阳性血清进行倍比稀释800倍,并设置阴性对照,根据检测结果判定评价ELISA方法的灵敏度。
1.6.7临床样品的检测应用建立的p35间接ELISA抗体检测方法对实验室保存的103份临床血清样品进行检测,并与INGENASA公司ASFV抗体检测试剂盒的检测结果进行比较,计算符合率。
2结果与分析
2.1ASFV p35基因的扩增
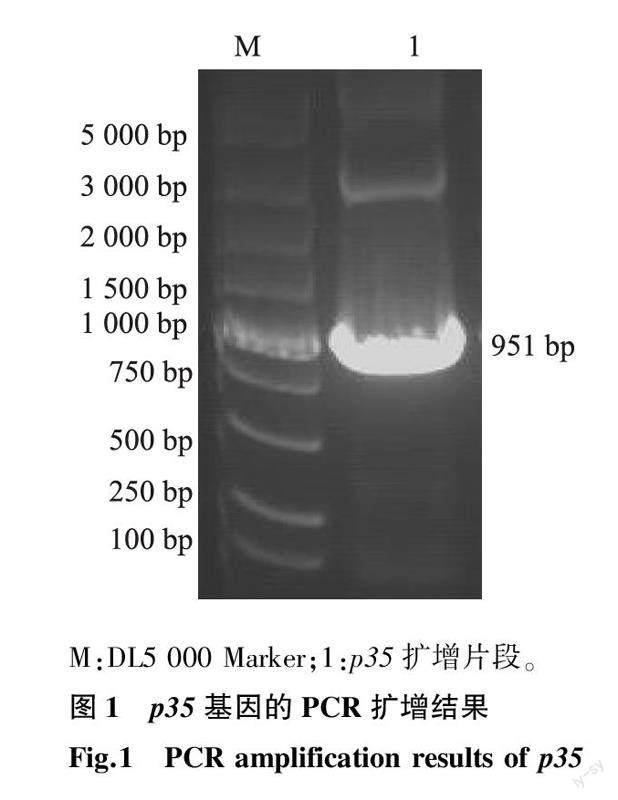
从模板扩增特异性p35基因片段,经1.5%琼脂糖凝胶电泳检测,目的片段的大小为915 bp,主要包含CP530R基因序列C端的478~1 383 bp、酶切位点序列、烟草蚀纹病毒蛋白酶(TEVP)酶切位点序列和保护性碱基等,与预期大小一致,结果见图1。
2.2融合表达载体的鉴定
将p35基因片段定向克隆至pET-ELP,构建融合重组表达质粒pET-ELP-p35,经过Sac Ⅰ+Xho Ⅰ双酶切后,获得预期大小的2个片段,即951 bp和6 912 bp,表明重组质粒pET-ELP-p35构建正确,结果见图2。
2.3融合蛋白的表达与ITC纯化
SDS-PAGE凝胶电泳结果(图3)显示,重组菌出现相对分子质量为80 000的蛋白质条带,与预期大小相符,且在上清液中获得表达。ELP-p35融合蛋白ITC的最佳孵育温度为28 ℃(图4)。ITC纯化的最佳NaCl浓度为4 mol/L(图5)。
2.4无标签重组p30蛋白纯化与免疫印迹鉴定
将烟草蚀纹病毒蛋白酶按一定比例加入纯化的ELP-p35融合蛋白溶液中,在水浴锅中30 ℃孵育切割ELP標签,12 000 r/min 离心10 min去除TEVP,在上清液中加入对应体积的4 mol/L NaCl,28 ℃孵育10 min,12 000 r/min 离心10 min,将上清液透析至PBS(pH 7.2),SDS-PAGE分析结果(图6)显示,经纯化后获得可溶性无标签p35重组蛋白。用非洲猪瘟抗体阳性猪血清通过免疫印迹鉴定(Western Blot)检测重组p35蛋白,结果显示切割后的p35重组蛋白能被非洲猪瘟抗体特异性识别(图7)。
2.5间接ELISA条件的确定
2.5.1重组蛋白质包被质量浓度和待检样品稀释度的确定通过方阵滴定试验可知,当无标签p35蛋白包被质量浓度为2.00 μg/ml,待检血清按1∶200稀释时,此时P/N值(1.514/0.091)最大,且此时阳性血清OD450>1,所以确定2.00 μg/ml为最适包被质量浓度,血清最适稀释比例为1∶200(表1)。
2.5.2其他条件的优化根据P/N值的大小确定包被液为0.05 mol/L、 pH 9.6碳酸盐缓冲液,封闭液为5%脱脂牛奶,血清稀释液为5%脱脂牛奶,二抗稀释比例为1∶10 000,3,3′,5,5′-四甲基联苯胺(TMB)显色时间为10 min。
2.5.3临界值的确定在最优化条件下,对已知的143份阴性血清进行检测,同时设置已知的ASFV抗体阳性样品作为对照,阴性血清样本OD450的平均值(x—)为0.081,标准误(SD)为0.03,则血清阴性和阳性判定阈值OD450为0.171,即待测血清OD450>0.171 为阳性,待测血清OD450≤0.171为阴性。
2.5.4批内、批间重复试验批内重复试验结果(表2)显示,变异系数为0.348%~3.757%;批间重复试验结果显示,变异系数为0.320%~2.040%,变异系数均小于5.000%,表明建立的ELISA方法重复性良好。
2.5.5敏感性试验在最优条件下,对倍比稀释的标准阳性血清进行ELISA抗体检测,结果显示,当按1∶400稀释时OD450>0.171,说明该方法有较好的灵敏度。
2.5.6特异性试验在优化条件下,检测CSFV、PRRSV、FMDV、PCV2和PRV的阳性血清,结果(表3)显示,建立的以p35为包被抗原的检测结果均为阴性,表明该方法特异性好。
2.5.7临床样品的检测利用本研究建立的p35间接ELISA抗体检测方法与商品化非洲猪瘟抗体检测试剂盒(ING)分别对103份临床血清样品进行检测。检测结果均为阴性(表4),与商品化试剂盒检测结果相比,两者的符合率为100%。
3讨论
目前,非洲猪瘟仍然是危害中国养猪业的重要传染病,造成了极大的经济损失。当前该病防控最主要的困扰是仍未有有效的疫苗,主要依靠检测、监测和扑杀来综合防控。当前病原学检测大多依靠普通PCR和荧光定量PCR方法,但当前中国非洲猪瘟出现了新的流行特点,主要表现为由急性发病转变为缓慢发病、出现隐性感染或耐过猪[19]和不定期排毒,这给病原的核酸检测带来了很大的不确定性。而猪可在感染后7~9 d产生抗体,血清学抗体检测成为可靠的检测、监测手段。研究结果表明,ASFV pp62蛋白具有强抗原性,在感染猪体内相应的抗体滴度较高,可作为抗原建立相应的血清学检测方法,用于ASFV的抗体检测[20]。在病毒颗粒成熟的过程中,pp62被S273R蛋白酶水解切割为p15、p35,p15和p35蛋白存在于成熟病毒颗粒的内膜,因此针对水解产物p15和p35蛋白开展抗体检测、监测更能够反映病毒感染的实际水平。本研究为了评估p35蛋白作为ELISA血清学诊断抗原的可行性,选用p35 作为包被抗原来建立ELISA检测方法。
当前研发的各种亚单位疫苗在中国大部分猪场被广泛应用,亚单位疫苗在研制过程中都会将抗原基因与纯化标签融合表达,这样猪群经过多次免疫后,会产生相应的抗多聚组氨酸抗体。同时在ELISA抗体检测方法建立的过程中,往往为了纯化目的蛋白的方便,用于检测包被的抗原大多数是与组氨酸的标签融合表达[21-23]。用这样的检测方法去开展临床猪群血清样品的检测,往往会出现假阳性的检测结果。为了消除影响,本研究选用p35与ELP融合表达,并在ELP和p35蛋白之间插入了TEVP切割位点,利用ELP相变特性纯化融合蛋白后,通过TEVP切割可获得无标签的ASFV抗原。与于学祥等[24]制备的无标签ASFV p30蛋白相比,本研究不需要经过包涵体的变复性和镍柱亲和层析纯化等复杂步骤,利用ELP标签具有温度敏感的可逆相变特性,通过升温、降温、离心和洗涤等步骤即可获得抗原蛋白,纯化过程不仅简单,而且经济实惠,最后得到了纯度较高的无标签p35蛋白,为使用该蛋白质作为包被抗原建立ELISA检测方法奠定了良好的基础。
本研究参考ASFV SY18毒株(GenBank:MH713612.1)的p35基因,该毒株是中国的流行毒株,在此基础上建立的ELISA抗体检测方法更具有针对性。建立的间接ELISA抗体检测方法对FMDV、PCV2、PRRSV、CSFV和PRV均无交叉反应,可检测稀释400倍的阳性血清,组间重复试验和组内重复试验变异系数均小于5.000%,该检测方法具有特异性好、敏感性高和重复性好的特点,且与非洲猪瘟商品化抗体检测进口试剂盒(ING)检测结果的符合率高达100%。
本研究成功制备了无标签p35重组蛋白,并以此建立了ASFV抗体ELISA检测方法,为非洲猪瘟的检测、监测提供了更精准的技术工具。
参考文献:
[1]ALONSO C, BORCA M, DIXON L, et al. ICTV virus taxonomy profile: asfarviridae[J]. Journal Of General Virology, 2018,99(5):613-614.
[2]DIXON L K, SUN H, ROBERTS H. African swine fever[J]. Antiviral Research,2019,165:34-41.
[3]GE S Q, LI J M, FAN X F, et al. Molecular characterization of African swine fever virus, China[J]. Emerging Infectious Diseases,2018,24(11):2131-2133.
[4]ZHOU X, LI N, LUO Y, et al. Emergence of African swine fever in China[J]. Transboundary and Emerging Diseases,2018,65(6):1482-1484.
[5]DE VILLIERS E P, GALLARDO C, ARIAS M, et al. Phylogenomic analysis of 11 complete African swine fever virus genome sequences[J]. Virology,2010,400(1):128-136.
[6]DIXON L K, CHAPMAN D A, NETHERTON C L, et al.African swine fever virus replication and genomics[J]. Virus Research,2013,173(1):3-14.
[7]ALEJO A, MATAMOROS T, GUERRA M, et al. A proteomic atlas of the African swine fever virus particle[J]. Journal of Virology,2018,92(23): e01293.
[8]EULLIO A, NUNES-CORREIA I, SALAS J, et al. African swine fever virus p37 structural protein is localized in nuclear foci containing the viral DNA at early post-infection times[J]. Virus Research,2007,130(1/2):18-27.
[9]DIXON L K, ABRAMS C C, BOWICK G, et al. African swine fever virus proteins involved in evading host defence systems[J]. Veterinary Immunology and Immunopathology,2004,100(3/4):117-134.
[10]WANG G G, XIE M J, WU W,et al. Structures and functional diversities of ASFV proteins[J]. Viruses,2021,13(11):2124.
[11]QUINTERO J C, WESLEY R D, WHYARD T C, et al. In vitro and in vivo association of African swine fever virus with swine erythrocytes[J].American Journal of Veterinary Research,1986,47(5):1125-1131.
[12]FRANZONI G, GRAHAM S P, GIUDICI S D, et al. Characterization of the interaction of African swine fever virus with monocytes and derived macrophage subsets[J].Veterinary Microbiology,2017,198:88-98.
[13]郭怡德,李冰,蔡汝健,等.非洲豬瘟病毒蛋白功能研究进展[J].动物医学进展,2020,41(10):96-101.
[14]储珺,赵普,张婕妮,等.非洲猪瘟病毒pp62蛋白单克隆抗体的制备和鉴定[J].中国兽医科学,2022,52(5):579-585.
[15]欧云文,刘俐君,贾宁,等.非结构蛋白在非洲猪瘟病毒感染中作用[J].病毒学报, 2021,37(4):910-921.
[16]李景生,徐军,刘陶莹,等.类弹性蛋白多肽及其应用研究进展[J].生物技术世界,2015(6):16-17.
[17]LIU W J, WU Q, XU B, et al. Single-step purification of recombinant proteins using elastin-like peptide-mediated inverse transition cycling and self-processing module from Neisseria meningitides FrpC[J]. Protein Expression And Purification,2014,98:18-24.
[18]LI G Y, XIAO Z Z, LU H P, et al. A simple method for recombinant protein purification using self-assembling peptide-tagged tobacco etch virus protease[J].Protein Expression and Purification,2016,128:86-92.
[19]肖景景,卢会鹏,李洋洋,等.非洲猪瘟病毒无标签重组K205R抗原制备与应用[J].扬州大学学报(农业与生命科学版),2019,40(3):90-94,100.
[20]ZHONG K, ZHU M, YUAN Q, et al. Development of an indirect ELISA to detect African swine fever virus pp62 protein-specific antibodies[J].Frontiers in Veterinary Science,2022,8:798559.
[21]吴竞,王西西,吴映彤,等.非洲猪瘟病毒p30基因的原核表达及间接ELISA抗体检测方法的建立[J].中国畜牧兽医, 2018, 45(12):3555-3562.
[22]庚辛,孙明霞,王淑杰,等.非洲猪瘟病毒p72蛋白间接ELISA抗体检测方法的建立[J].中国预防兽医学报, 2021, 43(9):946-951.
[23]施磊,田占成,杨吉飞,等.非洲猪瘟病毒p35蛋白作为诊断抗原的抗原性比较[J].生物工程学报,2021,37(1):187-195.
[24]于学祥,陈晓雨,李栋凡,等.非洲猪瘟病毒无标签p30-ELISA抗体检测方法的建立及应用[J].畜牧兽医学报, 2022,53(5):1517-1526.
(责任编辑:陈海霞)

