赤芍根腐病病原菌鉴定及生物学特性
马娅楠,李继平,,3,郑 果,,3,张金奎,马生彪,惠娜娜,3,王 立,3,张自强
(1.甘肃农业大学 植物保护学院,兰州 730070;2.甘肃省农业科学院 植物保护研究所,兰州 730070;3.农业部天水作物有害生物科学观测试验站,甘肃天水 741299)
赤芍(PaeoniaveitchiiLynch)为毛茛科(Ranunculaceae)多年生草本植物,是中国传统野生中药材,应用历史悠久[1],种质资源丰富,在中国四川、甘肃、陕西、云南、贵州、青海等地有大面积栽培[2]。
赤芍入药部位为根部,具有抗肿瘤[3]、散瘀止痛[4]、清肝火[5-6]等功效。此外,赤芍花色艳丽,花香四溢,是花坛和公园的首选观赏植物,适合生态绿化及林地经济开发。
2021年5月,在甘肃省定西市渭源县赤芍种植示范田发现一种新的赤芍根部病害。受侵染植株地上部出现叶片发黄、植株瘦弱矮小、近地部腐烂及整株干枯死亡等症状,根部组织变色腐烂且有异味,严重影响赤芍的生产量、药用品质及观赏价值。
据报道芍药属病害有炭疽病、叶斑病、锈病、灰霉病、白粉病、白绢病等[7-9],但未见赤芍根部病害的详细调查及病原菌鉴定报道。为明确赤芍根腐病病原菌及相关特性,遂对其进行了病原菌分离鉴定及生物学特性研究,以期为该病害的田间诊断及有效防控提供理论参考。
1 材料与方法
1.1 病害样品的采集及病原菌分离
2021年5月,从甘肃省定西市渭源县赤芍种植示范田随机采集典型根腐病根部病样。
采用常规组织分离法进行分离[10]:纵切发病根部,在病健交界处切取大小为5 mm×5 mm的组织块,浸入75%酒精溶液中消毒10 s,然后投入3%次氯酸钠溶液中消毒45 s,再用灭菌水清洗3次,晾干后移入PDA 平板,25 ℃黑暗条件下培养,待边缘长出菌丝后,根据颜色和形态,挑取菌落边缘的菌丝转接到新的PDA平板进行纯化,纯化后置于PDA斜面上,4 ℃保存。
1.2 致病性测定
采用室内离体接种法进行致病性测试[11]:纯化菌培养15 d后,洗脱孢子以制备悬浮液,利用纽鲍尔血球计数板计数孢子浓度,孢悬液稀释至107mL-1。选取健康赤芍根部,用75%的酒精擦拭表面,将其切成8~10 cm长的小根段,移液枪吸取10 μL接种于表面,进行刺伤与未刺伤两个处理,无菌水作为对照,每个处理重复3次。接菌后保湿置于25 ℃下黑暗培养,逐日观察发病 情况。
1.3 形态学鉴定
观察记录病原菌在PDA平板上的菌落形态、颜色变化、菌丝生长速率等,并对分生孢子形态、大小及颜色进行显微观察、拍照。
1.4 分子生物学鉴定
采用真菌基因组提取试剂盒(Solarbio)提取基因组DNA,利用引物ITS1/ ITS4[12]、LROR/LR7[13]、EF1-728F/EF1-986R[14]进行PCR扩增。取5 μL PCR产物在1%琼脂凝胶上检测出阳性后,将合成引物和PCR产物委托生工生物工程(上海 )有限公司完成测序,测序结果与数据库NCBI中已知的序列进行Nucleotide Blast同源性比对,下载相关的属种序列(表1)。利用 MAFF v7.037b软件进行多重比较,GBLOCKS 0.91b软 件 进 行 保 守 区 域 选择,ACOPTools软件将各基因串联成数据集并用PAUP v4.0b10软件和最大简约法(Maximum Parsimony,MP)构建多基因系统发育树。
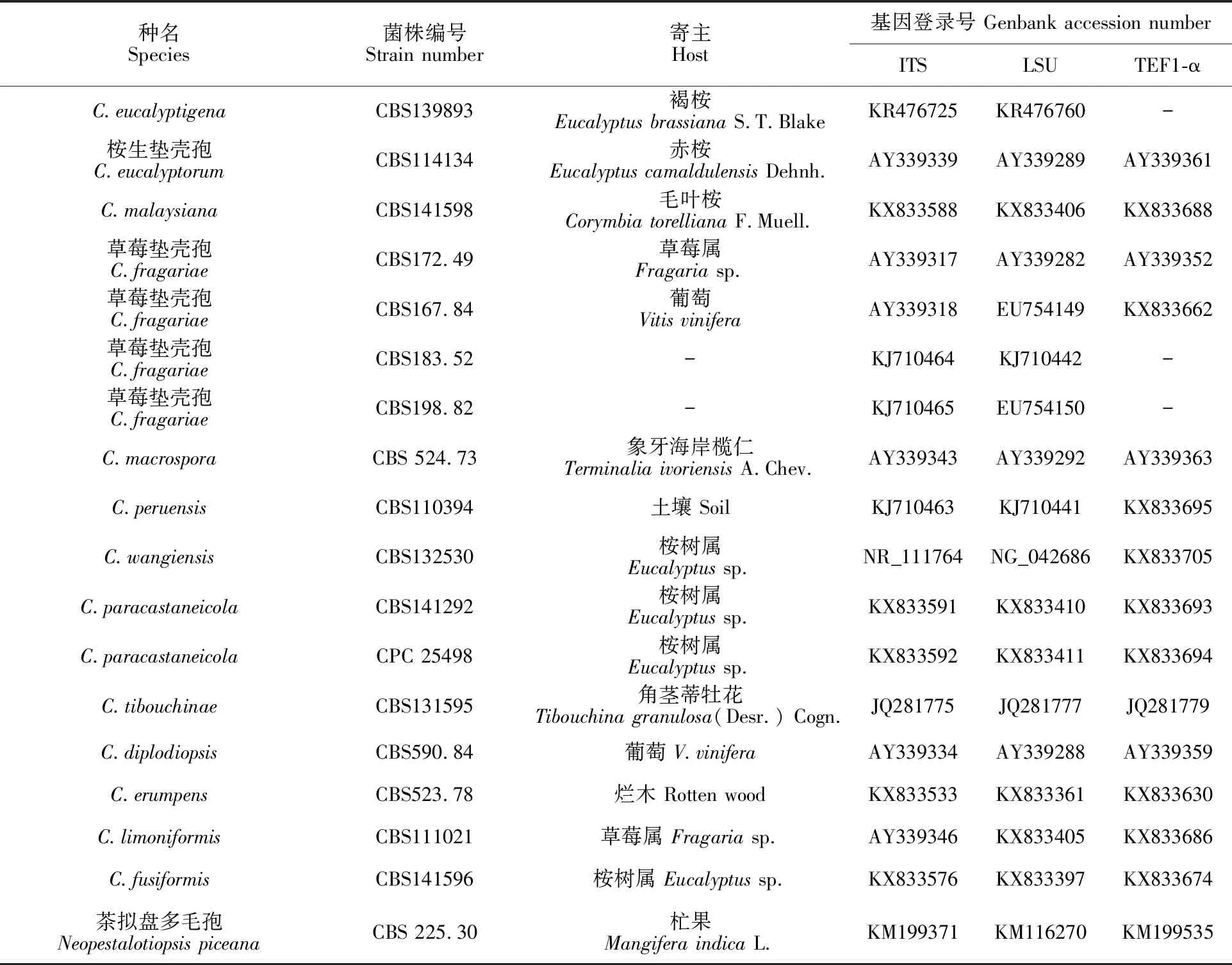
表1 参考菌株信息和GenBank登录号
1.5 病原菌的生物学特性测定
1.5.1 光照对病原菌生长的影响 光照条件设置为全黑暗(24 D)、全光照(24 L)、16 h光照+ 8 h黑暗(16 L/8 D)和12 h光照+12 h黑暗 (12 L/12 D)。
1.5.2 pH对病原菌生长的影响 培养基pH设定为4、5、6、7、8、9、10、11、12共9个梯度。
1.5.3 温度对病原菌生长的影响 设定5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃共7个温度条件。
1.5.4 培养基对病原菌生长的影响 选择PDA、Czapek、OA、NA、黑麦培养基共5种培 养基。
1.5.5 碳源和氮源对病原菌生长的影响 以Czapek为基础培养基,将蔗糖替换成等量的(以碳元素的质量计算)麦芽糖、乳糖、葡萄糖、蔗糖、甘露醇;将硝酸钠替换成等量的(以氮元素的质量计算)蛋白胨、牛肉膏、酵母膏、硫酸铵、硝酸纳、甘氨酸。同时,以不加碳源和氮源作为对照(CK)。
将病原菌菌饼(d=5 mm)接种在不同培养基平板中央,除温度对病原菌生长的影响外,所有处理均在25 ℃下黑暗培养,5 d后测量菌落直径,15 d后测量产孢量,每个处理重复3次。用Excel 2016和SPSS 25.0对数据进行整理和分析,Duncan’s 新复极差法进行差异显著性检验。
2 结果与分析
2.1 赤芍根部病害症状及病原菌分离
田间自然发病植株根部变色腐烂,根皮表面有黑褐色病斑,根皮与韧皮部脱离,横切面木质部有黑色扩散,并有异臭味,地上部分叶片褪绿皱缩变小,枝条枯死,发育不全,后期严重时可导致全株死亡(图1-A~1-B)。从采集的赤芍发病根部,分离纯化获得6株菌落颜色及形态一致的菌株,编号为CS-1~CS-6,随机选取菌株CS-1进行后续试验。

A.田间发病植株;B.发病植株近地部;C.赤芍根腐病发病根部(红色圆圈区域为分离样部位);D.病原菌孢子悬浮液接种7 d根段(左为根段表面发病症状,右为病原菌扩展状况); E.孢子悬浮液接种10 d后病原菌扩展根段; F.对照
2.2 致病性测定结果
结果表明CS-1可使刺伤根部发病。接菌7 d后,根部表面有明显棕褐色病变并附着白色菌丝,10 d后接种部位变黑并伴有腐烂发生,切开侵染根段后发现,病原菌已向木质部扩散,与田间发病症状一致。再分离已发病的接菌病根,可获得与原接种菌一致的菌落形态与分生孢子,符合柯赫氏法则,进一步证实了CS-1为赤芍根腐病的致病菌(图1)。
2.3 形态鉴定结果
病原菌菌丝在PDA培养基上生长较快,7 d后直径可达90 mm,菌落初呈白色或乳白色,具轮纹,由内向外呈放射状,背面呈白色(图2-A~2-B)。15 d后,培养基表面变成橘黄色并开始产生黑棕色油状分生孢子团。分生孢子团为球形或近球形,直径为231.5 ~ 512.4 μm,最初透明,后期逐渐变为黑棕色(图2-C)。分生孢子梗形态明显,透明呈近柱状,顶端着生有一至两个分生孢子,分生孢子大小为(7.5~11.0) μm×(5.5~7.5) μm,褐色,厚壁,球形至近球形(图3-D~3-F)。通过形态学特征比较,可初步鉴定该病原菌为Coniella属[15]。

A-B.PDA上菌落形态(正反面);C.PDA上的分生孢子团;D-E.分生孢子器;F.分生孢子
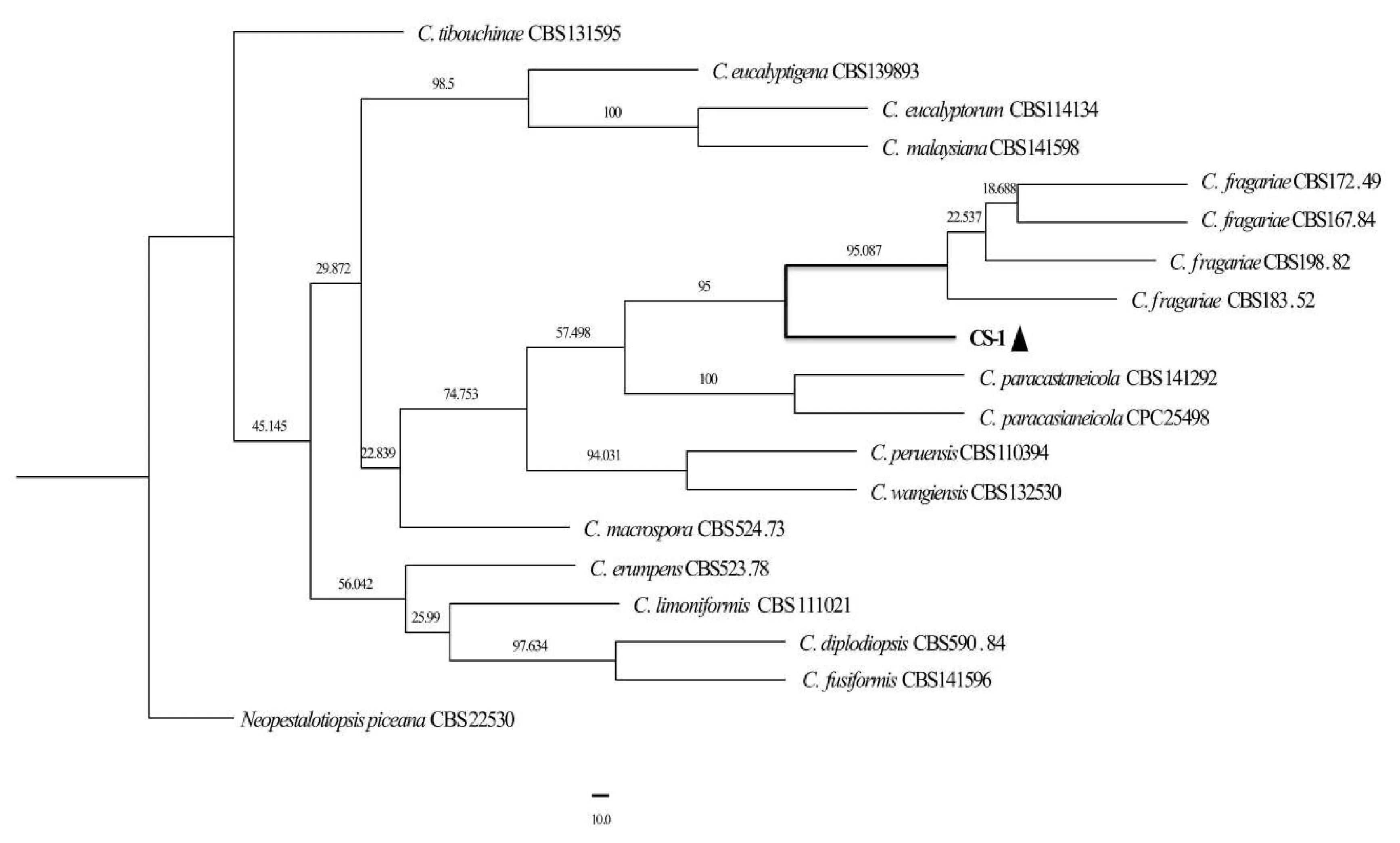
图3 基于ITS、LSU、TEF-α多基因联合构建的系统发育树
2.4 系统进化树的构建结果
PCR扩增后获得大小分别为601 bp(ITS)、 1 327 bp(LSU)和373 bp(TEF1-α)的DNA片段,将测序结果置于GenBank获得登录号分别为OP824764(ITS)、OP824767(LSU)和OP903926(TEF1-α)。Blastn分析结果显示,供试菌株CS-1与Coniellafragariae的相似度为99%~100%。选用其近源相关序列建立系统发育树(表1),结果表明:CS-1与C.fragariae遗传距离最近,聚于同一分支上,区别于其他Coniella属(图3)。结合形态学特征,确定该病原菌为草莓垫壳孢(C.fragariae)。
2.5 生物学特性测定
2.5.1 光照对病原菌生长的影响 病原菌在24D、24L、16L/8D和12L/12D条件下均能生长,菌丝生长速率表现为24D>16L/8D>12L/12D>24L,在24L条件下测得的菌落直径最小,为62.38 mm,显著低于其他处理。在4种光照条件下均可产孢,除24L外,其余光照条件下产孢量无显著差异(图4)。
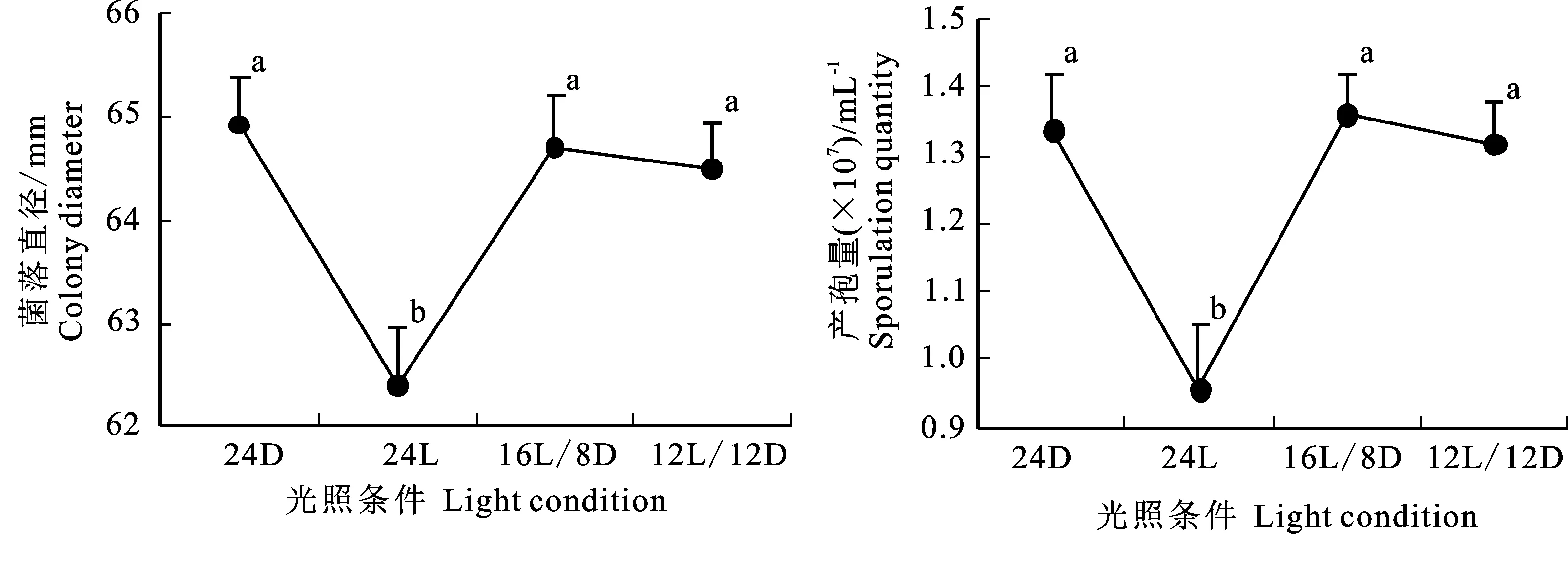
图中不同小写字母代表差异显著(P<0.05),下同
2.5.2 温度对病原菌生长的影响 病原菌在 10 ℃~30 ℃范围内均可生长,最适菌丝生长温度为20 ℃~25 ℃,25 ℃时产孢量达最高。在 5 ℃和35 ℃温度下,菌落大小无变化,菌丝无生长,未见产孢(图5)。
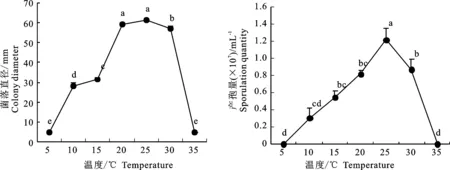
图5 不同温度下的病原菌菌丝和产孢量
2.5.3 培养基对病原菌生长的影响 病原菌在供试的5种培养基上都能生长,菌落从大到小依次为PDA、OA、黑麦培养基、Czapek和NA,其中在PDA培养基上生长最快,平均菌落直径为 63.92 mm,显著大于其他培养基中的菌落直径。在黑麦培养基上产孢量最高,在Czapek和NA上不产孢(图6)。
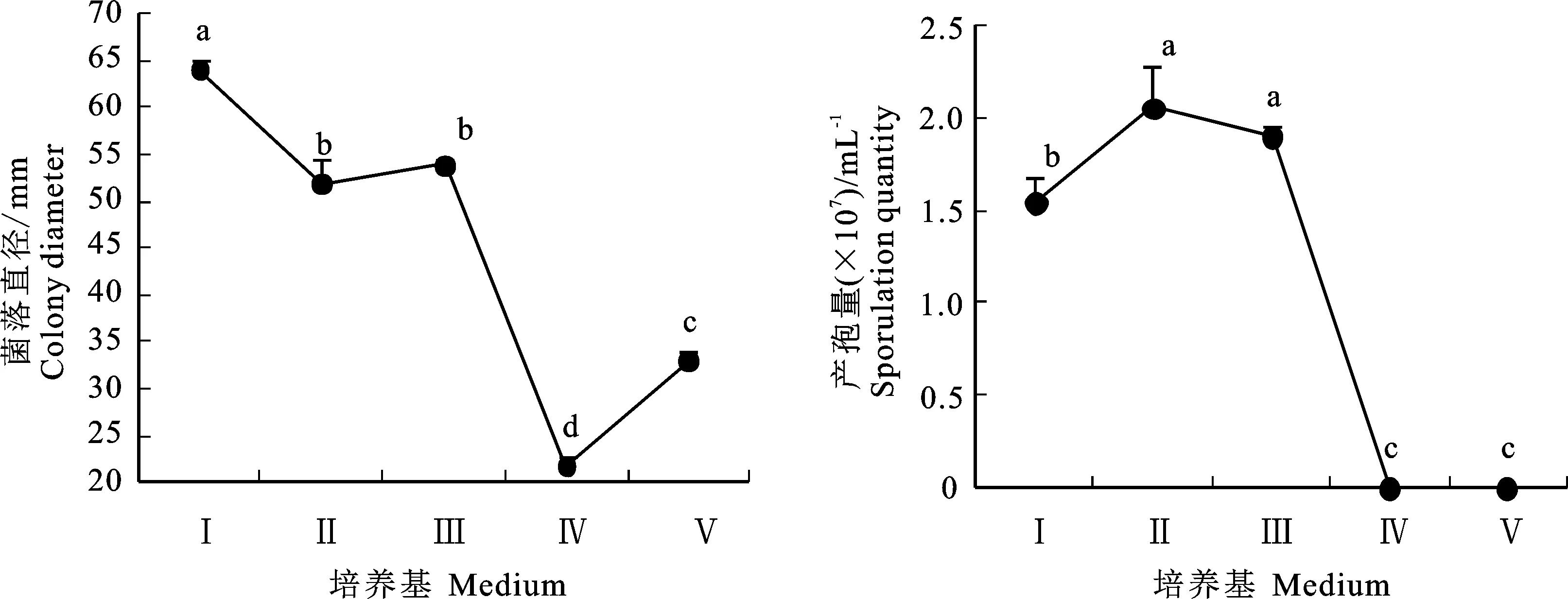
Ⅰ.PDA培养基;Ⅱ.黑麦培养基;Ⅲ.OA培养基;Ⅳ.NA培养基; Ⅴ.Czapek培养基
2.5.4 pH对病原菌生长的影响 适宜病原菌生长的pH为6~7,且pH为7时菌落直径和产孢量达到最大。过酸或过碱均不利于该菌菌丝生长和产孢(图7)。
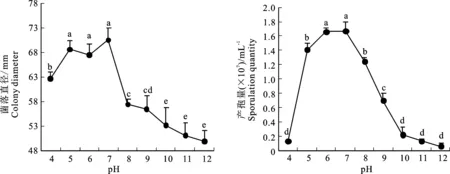
图7 不同pH下病原菌菌丝和产孢量
2.5.5 碳源对病原菌生长的影响 病原菌菌丝在供试的6种培养基上都能生长,表明该菌能够利用多种碳源。以乳糖为碳源时,菌落直径最大,为50.48 mm,显著大于以麦芽糖、甘露醇、葡萄糖和蔗糖为碳源时的菌落直径。该菌在供试的6种培养基上均不产孢(表2)。
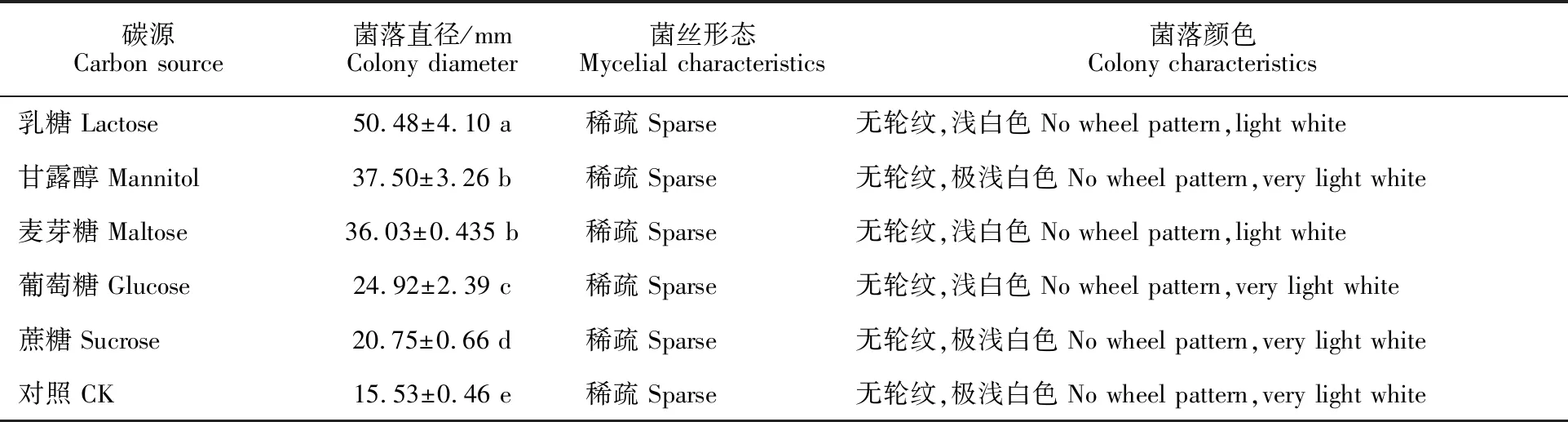
表2 不同碳源下病原菌的生长
2.5.6 氮源对病原菌生长的影响 由表3可见,病原菌在以酵母膏为氮源的培养基上菌落直径最大,显著大于以牛肉膏、甘氨酸、硝酸钠、硫酸铵为氮源的菌落直径。该菌在供试的7种培养基上均不产孢。不同碳源与氮源下病原菌的菌落形态见图8。

表3 不同氮源下病原菌的生长
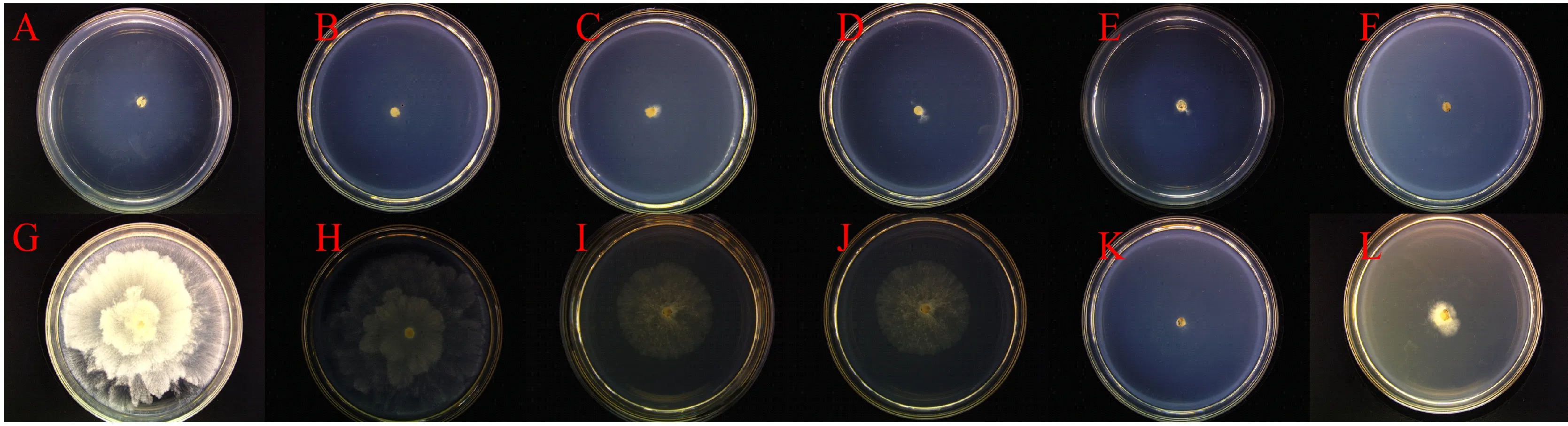
A.乳糖;B.甘露醇;C.麦芽糖;D.葡萄糖;E.蔗糖;F.无碳源;G.酵母膏;H.蛋白胨;I.牛肉膏;J.甘氨酸;K.硝酸钠;L.硫酸铵
3 结论与讨论
本研究发现一种新的赤芍根部病害,经病原菌分离纯化、致病性检测、形态特征观察和多基因序列分析,确定该病原菌为草莓垫壳孢(Coniellafragariae)。据报道,C.fragariae可侵染蔷薇属(Rosasp.)、小麦属(Triticumsp.)、欧洲草莓(FragariavescaL.)、草莓属(Fragariasp.)、豌豆(PisumsativumL.)、碗豆属(Pisumsp.)、叶下珠属(Phyllanthussp.)、榆绿木属(Anogeissussp.)、展叶松(PinuspatulaSchlecht.et Cham)、柏木属(Cupressussp.)等[16],但未见病原菌分离鉴定及生物学特性方面的研究报道。2020年,张智博等[17]从赤芍根部分离出C.fragariae,但并未将其作为致病菌进行研究,而是以内生菌进行抑菌试验。本研究首次发现C.fragariae侵染赤芍根部导致根腐病,但致病性试验发现,该菌不能侵染无伤的赤芍根部,说明该菌致病性或寄生性较弱,只能通过伤口侵入[18]。因此,该病的防控方面,应避免根部受伤,预防地下害虫,该病害侵染是否存在复合侵染尚需进一步研究。
病原菌的生物学特性与其生长环境有着密切联系,根据生物学特性研究可以更好地预测病情发生时期以及对病害的防控[19-21]。本试验结果表明:病原菌在供试的多种培养基上都能生存,OA和黑麦培养基可促进其产孢,全光照不利于病原菌生长,最适温度为20~25 ℃,这与5月份当地赤芍根腐病的发生趋势相符。该病发生最适pH为6~7,喜好中性偏酸环境,与赤芍多年性生长、连作导致土壤偏酸有关。病原菌在不同的碳氮源条件下均可存活,但对碳源的利用率较低,生长至后期也未见有明显的菌落形成,且不产孢,但在不同氮源的培养基上生长差异显著,酵母膏为氮源时菌丝茂密且菌落形态明显,缺氮时该菌停止生长。该结果与赤芍田间施肥管理有无直接关系,有待进一步研究。

