鳖甲活性寡肽I-C-F-6的合成工艺研究
张梓杰,曾 琪,张 佟,雷海民,徐 冰
北京中医药大学,北京 100102
中药鳖甲(Carapaxtrionycis)为鳖科动物鳖(Trio-nyxsinensisWiegmann)的背甲,具有滋阴潜阳、退热除蒸和软坚散结的功效。以鳖甲为君药的制剂鳖甲煎丸和复方鳖甲软肝片在临床上常用于治疗肝纤维化[1-2]。现代药理研究结果表明,鳖甲及其复方制剂具有防治肝细胞损伤、改善肝功能、减轻肝细胞变性坏死以及抑制肝纤维化形成的作用[3-4]。近年来的研究表明,小分子寡肽可能是鳖甲抗肝纤维化的药效物质基础[5-7]。
本课题组在前期研究中从鳖甲中分离得到活性寡肽I-C-F-6(化学结构见图1),其氨基酸序列为GAGPHGG。研究表明,I-C-F-6能通过降低肝脏中促炎、促纤维化因子白细胞介素-4(interleukin-4,IL-4)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的水平,升高抗炎和抗纤维化因子白细胞介素10(interleukin-10,IL-10)的水平,抑制肝组织中E-cadherin蛋白的表达,显著改善由CCl4诱导的大鼠肝纤维化[8-9]。贺松其教授团队采用CCl4诱导的大鼠肝纤维模型对I-C-F-6的作用机制研究发现,其能显著改善肝纤维化大鼠肝损伤,减少细胞外基质(extracellular matrixc,ECM)沉积,抑制核因子-κB(nuclear factorκB,NF-κB)p65和Wnt/β-catenin信号通路的活化,进而调控其下游CTGF、TGF-β1、TNF-α和VEGF等各种细胞因子的表达水平[10-11]。肽类化合物的现代合成方法分为固相合成法与液相合成法,其中固相合成法操作步骤简单、易于投入实际生产[12]。因此,本实验用正交实验,以目标肽质量分数作为评价指标,优选活性寡肽I-C-F-6的固相合成工艺,研究结果为开发具有自主知识产权的抗肝纤维化创新药物奠定基础。
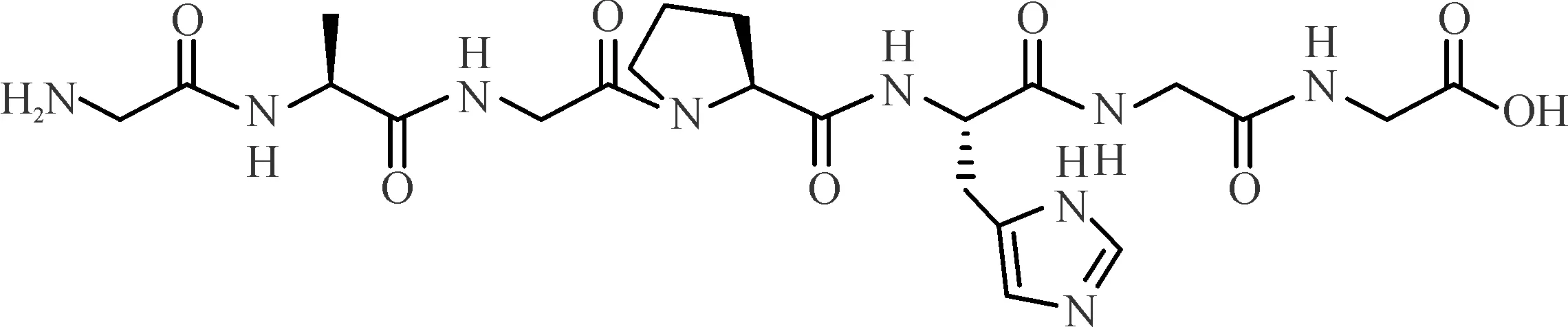
图1 鳖甲寡肽I-C-F-6的结构
1 仪器与试药
1.1 仪器
岛津LC-20A型高效液相色谱仪;Beta 2-8 LDplus型真空冷冻干燥机(德国Christ公司);RE-3000B型旋转蒸发器(日本EYELA有限公司);BSA224S-CW型万分之一电子分析天平(德国赛多利斯公司);TY-80A/S型脱色摇床(常州荣华仪器制造有限公司)。
1.2 试药
Fmoc-Gly-Wang resin、2-氯三苯甲基树脂、Rink Amide MBHA树脂、Fmoc-Gly-OH、Fmoc-Ala-OH、Fmoc-Pro-OH、Fmoc-His(boc)-OH、6-氯苯并三氮唑-1,1,3,3-四甲基脲六氟磷酸酯[O-(6-chloro-1-hydrocibenzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphat,HCTU]、I-C-F-6(对照品)均购自吉尔生化(上海)有限公司;N,N’-二异丙基碳二亚胺(N,N’-diisopropylcarbodiimide,DIC,质量分数为98%)、三氟乙酸(trifluoroacetic acid,TFA,质量分数为99.0%)均购自上海麦克林生化科技有限公司;哌啶(piperidine,PIP,质量分数为99%)、1-羟基苯并三唑(1-hydroxybenzotriazole,HOBt,质量分数99%)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl) carbodiimide,EDCI,质量分数为98%]、N,N-二异丙基乙胺(N,N-diisopropylethylamine,DIPEA,质量分数为99%)均购自北京伊诺凯科技有限公司;无水乙醚(分析纯,北京市通广精细化工公司三河分公司);甲醇(分析纯)、二氯甲烷(分析纯)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF,分析纯)均购自天津市致远化学试剂有限公司;甲醇(色谱纯)、乙腈(色谱纯)、醋酸铵(色谱纯)均购自赛默飞世尔科技(中国)有限公司。
2 方法与结果
2.1 试剂的配制
2.1.1体积分数20% PIP-DMF溶液 取20 mL PIP,溶于80 mL DMF中,即得。
2.1.2体积分数95%TFA溶液 量取5 mL去离子水加入95 mL TFA中,即得。
2.1.3Kaise test溶液 溶液1:取80 g苯酚溶于15.8 g无水乙醇中,即得;溶液2:取0.2 mL KCN(0.001 mol·L-1)溶于9.8 mL PIP中,即得;溶液3:取500 mg茚三酮溶于7.9 g无水乙醇中,即得。
3种溶液均需密闭避光保存。检验时滴加溶液1、2、3各2~5滴,加热4 min。
2.2 鳖甲七肽I-C-F-6的合成与检测
2.2.1正交实验设计 正交实验因素与水平见表1。实验方法如下(以正交实验1为例)。

表1 正交实验的因素及水平
(1)树脂溶胀:称取0.5 g Rink Amide MBHA树脂,置于10 mL多肽反应管中;加入7 mL DMF溶胀20 min,重复1次。
(2)投料:称取Fmoc-Gly-OH 136.8 mg(氨基酸的投料量=树脂的质量×树脂取代率×投料比×氨基酸的相对分子质量),HCTU 192.4 mg,置于7 mL DMF中溶解,加入DIPEA 59.5 mg,于摇床上振摇1 h。
(3)Kaise test检测:抽去反应液,用DMF洗涤2次,取少许树脂,滴入Kaise test溶液中,110 ℃加热4 min,检验溶液呈淡黄棕至红棕色。
(4)Fmoc的脱除:量取7 mL 2.1.1项下制备的体积分数为20%的PIP-DMF溶液,进行Fmoc的脱除,并重复1次该操作,用DMF洗涤2次。
(5)Kaise test检测:取少许树脂,滴入Kaise test溶液,110 ℃加热4 min,检验溶液呈蓝黑色(连接脯氨酸时,溶液呈淡黄棕至红棕色,树脂为红色)。
(6)重复步骤(2)—(5)。
(7)根据肽链倒置顺序投料,制备目标树脂。
(8)树脂的切割:用甲醇、二氯甲烷洗涤2次,抽干,加入切割液5 mL,置于摇床上振摇2 h。抽干切割液,减压浓缩,倒入适量的冰乙醚内,以4 000 r·min-1离心3 min,弃去上清液,加入乙醚搅拌,再以4 000 r·min-1离心3 min,得沉淀,冷冻干燥。
正交实验2~9的操作步骤基本与正交实验1的相同,其中Fomc-Gly-Wang的投料顺序为G-H-P-G-A-G,且在树脂溶胀后进行Fmoc的脱除,Rink Amide MBHA树脂溶胀后进行保护基的脱除,其他步骤相同。
最终得到冻干粉样品18份。
2.2.2鳖甲七肽I-C-F-6粗产物的检测 色谱柱:月旭水性色谱柱Welch Ultimate AQ-C18(250 mm×4.6 mm,5 μm);流动相:甲醇为有机相A,以5 mmol·L-1醋酸铵水溶液作为水相B;梯度洗脱:98%B~27%A;检测波长:220 nm;流速:1 mL·min-1;柱温:30 ℃;进样量:10 μL。
称取粗产物冻干粉,配制成质量浓度为1 mg·mL-1的水溶液,每份样品进样2次,以峰面积比计算相对含量,结果取平均值。结果见图2(以实验8为例)。

注:A.I-C-F-6对照品;B.实验8粗产物。
2.3 正交实验的结果与分析
正交实验中每个实验重复2次,取平均值。用SAS 8.2软件对数据进行处理和方差分析。L9(34)正交实验直观分析结果见表2。正交实验方差分析结果见表3。

表2 L9(34)正交实验直观分析结果
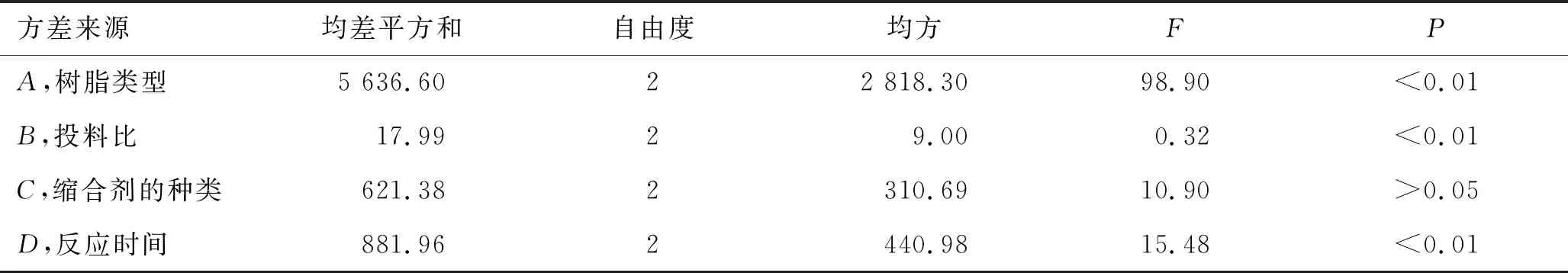
表3 正交实验方差分析结果
由表2可见,各因素对鳖甲七肽I-C-F-6合成相对含量影响的顺序为:A(树脂类型)>D(反应时间)>C(缩合剂的种类)>B(投料比)。由表3可见,树脂的类型、投料比、反应时间对I-C-F-6的合成均存在显著性影响而缩合剂种类对I-C-F-6的合成不存在显著性影响。因此,从生产实际和资源利用的角度考虑,可将合成的较优工艺定为采用Fmoc-Gly-Wang树脂,投料比(树脂担载量/氨基酸摩尔质量)为1∶5,以6-氯苯并三氮唑-1,1,3,3-四甲基脲六氟磷酸酯[O-(6-chloro-1-hydrocibenzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphat,HCTU]N,N-二异丙基乙胺(N,N-diisopropylethy-lamine,DIPEA)为缩合剂,反应2 h。
2.4 验证及放大实验
各实验平行1次,得到样品6份,每个样品进样2针,结果取平均值,验证实验目标肽产率为77.03%,在5倍和25倍放大实验中目标肽的产量分别为62.86%、78.69%。
3 讨论
肽类化合物的固相合成涉及树脂、缩合剂、氨基酸保护基的选择,投料比与反应时间对合成的影响也十分显著。在本实验中,选择了以MBHA树脂为代表的氨基树脂、以WANG树脂为代表的羟基树脂、以2-氯三苯甲基树脂为代表的三苯甲基树脂作为树脂类型的考察因素,选择以DIC、EDCI为代表的碳二亚胺型缩合剂以及以HCTU为代表的鎓盐型缩合剂作为缩合剂类型的考察因素,以确定活性多肽I-C-F-6的合成工艺。由于Fmoc保护基具有对酸敏感而对碱(脱保护溶液)不敏感的特性[13],故被应用到本次实验中。投料比与反应时间的选择也基于高倍量反应物推动反应正向进行的原则加以确定[14]。
正交实验结果显示,实验1、3、4、5中I-C-F-6的产率相对较低,分析可能由于多肽固相合成中反应投料比高倍量可促进反应正向进行,而实验1和4的投料比过小且反应时间短,导致反应不完全,从而造成产率相对较低;而实验5虽然投料比为1∶3,但由于反应时间不充足,导致产率较低;实验3采用DIC/HOBt作为缩合剂且以5倍投料反应,在反应过程中发现有部分反应原料析出,这可能是导致实验3产率低的原因。
中医药是世界医学的宝藏,从中药中寻找抗肝纤维化活性成分的报道很多[15-17],其中天然活性寡肽类成分具有良好的成药性,可被人体肠道直接吸收[18],其与游离氨基酸相比,更容易进入血液,目前寻找小分子活性寡肽作为药物或先导化合物已成为国内外药学领域研究的热点之一[19]。中药是优质的天然寡肽库,对中药中寡肽类活性成分的研究已经引起国内外学者的密切关注[20-21]。本实验通过正交实验,采用经典的固相合成法,优选鳖甲中抗肝纤维化活性寡肽I-C-F-6的合成工艺,操作简单,适用于工业生产,为I-C-F-6新药的研发奠定基础。

