3种地被菊的抗寒生理特性比较
乔谦,朱乐,王江勇*,王璐,贾曦
(1.山东省果树研究所,山东 泰安 271000;2.山东乐惠生态农业发展有限公司,山东 泰安 271000;3.山东省农业科学院,山东 济南 250100)
菊花(Chrysanthemum)是菊科菊属多年生宿根草本花卉。作为中国十大传统名花,深受人们的喜爱[1]。1985年始,陈俊愉院士等人采用小菊与多种野生菊花进行多年杂交,选育便于管理、适宜地栽过冬的地栽菊花品种群,命名为“地被菊”[2]。如今,地被菊新品种已达上千种,主要以东北、华北、西北地区为主,具有花色花型丰富,抗旱性、抗寒性强,植株矮小,覆盖性好,绿期长等特征,是一种良好地被覆盖材料与装饰花卉,在各类园林绿地中广泛应用,具有良好的观赏价值与经济价值[3-4]。
寒害和冻害是北方主要天气灾害,几乎每年都有不同程度的发生,气候变化背景下更有加剧的趋势。低温胁迫往往伴随着植物的膜透性、渗透势、抗氧化酶系统等变化,进而影响植物的生长与发育以及地被菊的产量和品质[5],导致园林绿地应用地被菊观赏品质下降,制约城市园林绿化应用,降低经济效益。随着城市绿化对四季耐寒地被植物需求的不断增加,地被菊抗寒品种的选育再次成为了热点[6]。本文以黄菊1号、红小与1709品种的地被菊为研究材料,通过人工模拟低温环境,对比不同低温处理下各品种地被菊的渗透调节物质、抗氧化酶活性、解剖结构指标等参数,进行抗寒性综合评定,研究其耐寒性强弱,进行抗寒性综合评价与筛选,发掘优秀地被菊品种,以期为国内寒冷地区推广优良地被菊提供科学依据,为进一步研究菊花抗寒性机理、选育抗寒性新品种奠定基础。
1 材料与方法
1.1 试验材料
于2020年7—8月在山东省果树研究所金牛山花卉种质资源圃选取长势良好无病虫害的黄菊1号、红小、1709 三个品种的一年生地被菊扦插苗为试验材料,尽量保证植株生长状况一致,以保证试验数据的准确性。
1.2 试验方法
1.2.1 人工低温处理
2020年8月上旬,摘取黄菊1号、红小、1709 三个品种的地被菊健壮植株枝条上第2~4个叶片,每种30~40片并混合均匀,用潮湿纱布包裹,经自来水、蒸馏水、去离子水冲洗去除表面尘土等杂质,用滤纸轻轻吸干叶片上的水分。将每个品种的地被菊叶片平均分成5份,利用低温恒温槽/人工气候箱/冰箱进行低温处理。先放入冰箱中4 ℃预冷2 h,预冷结束后,共设5个温度梯度(0、-4、-8、-12、-16 ℃),每个梯度处理2 h。处理结束放入4 ℃冰箱解冻2 h,解冻后进行解剖结构的观察与丙二醛(malondialdehyde,MDA)含量等生理指标的测定,每个处理3次重复。
1.2.2 叶片解剖结构观察
每个处理取10片解冻后的叶片,剪取该叶片主脉部分,福尔马林-乙酸-乙醇混合液(FAA液)固定后完成脱水、透明、包埋等制片过程,切片8 μm,番红-固绿双重染色,中性树胶封片并烘干。将制作好的石蜡切片置于LEICA DMLB/荧光倒置显微镜下观察并拍照,利用 Leica Application Suite 图像分析软件测定其主脉直径、叶片厚度、上表皮厚度、下表皮厚度、角质膜厚度、栅栏组织厚度、海绵组织厚度、栅海比、叶肉组织紧密度和叶肉组织疏松度,所测数据均为15个视野下的平均值,用SPSS软件对数据进行显著性分析。
1.2.3 抗寒性生理指标测定方法
相对电导率(relative electric conductivity,REC)采用电导法测定[7],将叶片避开叶片主脉和叶缘剪成5 mm×5 mm大小,称取 0.2 g,装入试管中,加入去离子水 20 mL。试管塞口后置于恒温振荡箱充分振荡 1 h,用电导率仪测量初电导率(S1)。再将试管放入沸水浴中加热 15 min,冷却至室温后测其终电导率(S2)。实验重复 3 次。
将不同温度梯度下的各组样品剪碎混合均匀,准确称取叶片 0.5 g 置于预冷的研钵中,加入少量石英石和适量液氮,充分研磨后转入加有5 mL 磷酸缓冲液(50 mmol·L-1,pH值7.8)的离心管中。将离心管置于冷冻离心机中 4 ℃、10 000 r·min-1离心 20 min。所得上清液即为酶液,可用于MDA、可溶性蛋白含量测定和过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)活性测定。
POD测定采用愈创木酚法,SOD 活性测定采用氮蓝四唑法,MDA测定采用BC0025 MDA试剂盒(苏州科铭),可溶性糖含量测定采用蒽酮比色法,可溶性蛋白含量测定采用考马斯亮蓝染色法[8],3次重复,取平均值进行统计。
1.3 数据分析与处理
根据REC拟合logistic回归方程确定各植株的半致死温度。
其中,r为同类中某一指标与其他指标之间的相关系数,n为同类中指标的个数。
采用Excel 2007制表,应用SPSS 22.0(P=0.05)统计分析软件进行各指标试验数据显著性差异分析,运用隶属函数法,对各指标求得的隶属值进行累加、取平均数。按照从大到小的顺序对各地被菊品种的反隶属函数平均值进行排序,对3种地被菊进行抗寒性综合评价。
2 结果与分析
2.1 低温胁迫下3种地被菊的生理指标
2.1.1 低温胁迫对3种地被菊相对电导率的影响
细胞膜是细胞内部与外部环境之间的分界面,低温对细胞的影响最先作用于细胞膜,细胞膜透性随温度的下降而增加,电解质和一些小分子有机物大量外渗,从而引起相对电导率的上升。在低温胁迫下3种地被菊REC的变化情况如表1所示。3种地被菊REC的变化趋势相同,都随着温度的降低逐渐升高,但不同品种地被菊的相对电导率变幅不同,总体上看相对电导率均呈“缓慢升高—迅速升高—平稳升高”的“S”型曲线;从0 ℃降至-4 ℃时,1709叶片电导率急剧升高,且高于黄菊1号与红小,叶片细胞膜受害越严重是相对电导率变化幅度越大的主要原因,表明该品种对低温更敏感,-4 ℃时其细胞膜已被破坏,且被破坏程度远大于其他品种;在整个低温胁迫过程中,黄菊1号与红小的叶片相对电导率较低,初步推测二者抗寒性较强。

表1 低温胁迫对3种地被菊REC的影响
2.1.2 低温胁迫下3种地被菊超氧化物歧化酶(SOD)活性变化
由表2可知,随着温度的降低,3种地被菊的SOD 活性均呈现先升高后下降的趋势,以红小最明显。红小和黄菊1号的值大于1709。从0降至-8 ℃时,3种地被菊的 SOD 活性均明显提高,说明在此期间3种地被菊能迅速产生大量SOD来抵御低温胁迫,以红小最明显,在-12 ℃达到最大值。从-8 ℃降至-12 ℃时,1709的SOD活性转为下降趋势,红小与黄菊1号的SOD活性仍继续增长,说明-12 ℃已超出1709的低温耐受限度。

表2 低温胁迫对3种地被菊叶片SOD活性的影响 单位:U·g-1
2.1.3 低温胁迫下3种地被菊叶片过氧化物酶(POD)活性变化
随着胁迫温度的持续降低,3种地被菊的POD活性均呈先上升后下降的趋势。从0 ℃降至-8 ℃时,3种地被菊的POD活性均呈上升趋势,说明POD已开始发挥作用抵御低温胁迫,黄菊1号和1709在-8 ℃低温处理下POD活性达到最大值,而红小在-12 ℃达到最大值,且在整个低温胁迫过程中,红小的POD活性平均值最大(表3)。

表3 低温胁迫对3种地被菊叶片POD活性的影响 单位:U·g-1
2.1.4 低温胁迫下3种地被菊叶片中丙二醛(MDA)含量变化
低温胁迫条件下,3种地被菊叶片的MDA含量见表4。由表4可以看出,随着胁迫温度的降低,3个品种的地被菊叶片的MDA含量呈现逐渐升高的趋势,且均在-16 ℃胁迫处理条件下达最大值,整体变化趋势较为平缓,以1709最明显。其中-4~-16 ℃胁迫处理条件下黄菊1号叶片MDA含量显著高于对照,但彼此之间差异不显著。红小的MDA含量在-4 ℃胁迫处理条件下与对照差异不明显,而在-16 ℃胁迫处理下显著高于对照。

表4 低温胁迫对3种地被菊叶片MDA含量的影响 单位:nmol·g-1
2.1.5 低温胁迫下3种地被菊叶片过氧化氢酶(CAT)活性的变化
低温胁迫条件下,3种地被菊叶片的CAT活性见表 5。随着胁迫温度的降低,黄菊1号与1709叶片的CAT活性在0~-8 ℃缓慢升高,在-12 ℃显著升高(P<0.05),后又下降;而红小叶片的CAT活性变化趋势较为平缓,0~-4 ℃微增,之后呈显著下降趋势(P<0.05)。

表5 低温胁迫对3种地被菊叶片CAT活性的影响 单位:U·g-1
2.1.6 低温胁迫下3种地被菊可溶性糖含量的变化
低温处理条件下,3种地被菊叶片可溶性糖含量见表6。由表6可以看出,随着低温胁迫程度的增加,3个地被菊品种的可溶性糖含量均呈先增加后降低的趋势,三者平均可溶性糖差异不大,其中红小稍高于黄菊1号和1709。黄菊1号叶片的可溶性糖含量在-8 ℃的低温胁迫处理条件下达最大值;红小叶片的可溶性糖含量在-12 ℃低温胁迫处理条件下达最大值;1709地被菊叶片的可溶性糖含量在-8 ℃低温胁迫处理条件下达最大值;此外,红小在0~-12 ℃可溶性糖含量持续增加,且含量高于另外两个品种。
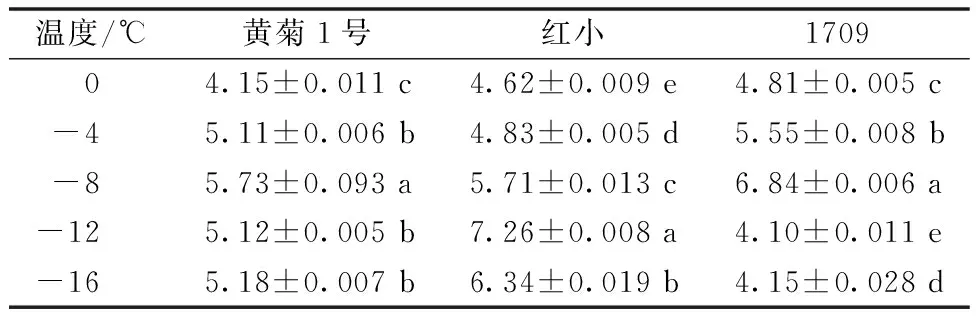
表6 低温胁迫对3种地被菊叶片可溶性糖含量的影响 单位:mg·g-1
2.1.7 低温胁迫下3种地被菊可溶性蛋白含量的变化
由表7可以看出,随着胁迫温度的降低,3种地被菊的可溶性蛋白含量大致呈先上升后下降趋势。0 ℃降至-8 ℃时,3种地被菊的可溶性蛋白含量均上升,说明在此低温胁迫下,3种地被菊均诱导产生了可溶性蛋白来抵御低温胁迫。但黄菊1号和红小在-12 ℃达到可溶性蛋白含量最大值,而1709在-8 ℃达到最大值。三者相比,红小的平均可溶性蛋白含量最高,其次是黄菊1号,1709最小。

表7 低温胁迫对3种地被菊叶片可溶性蛋白含量的影响 单位:mg·g-1
2.2 叶片解剖结构特征
对3种地被菊叶片表皮及叶肉解剖结构特征等指标进行多重比较(图1、表8)。叶片表皮是植物叶片表面的一层特殊的保护组织,由一层薄壁细胞紧密排列构成,植物表皮厚度越厚,植物的防损伤性能就越强,3个地被菊品种的叶片厚度平均值为0.254 6 μm,厚度排序为红小>黄菊1号>1709,3个品种间差异显著。红小角质层最厚,为0.003 2 μm;黄菊1号和1709角质层厚度为0.003 1 μm。3个品种上表皮厚度均大于下表皮厚度。其中黄菊1号上表皮最厚,红小上表皮最薄。黄菊1号下表皮最厚,红小下表皮最薄。栅栏组织厚度依次为:红小>1709>黄菊1号。红小海绵组织最厚,1709最薄。栅海比依次为:1709>黄菊1号>红小。细胞结构紧密度排序与栅海比一致。细胞结构疏松度依次为:红小>黄菊1号>1709。

图1 3种地被菊叶片解剖结构

表8 3个地被菊品种叶片解剖结构指标及多重比较
2.3 利用隶属函数法进行抗寒性综合评定
2.3.1 3种地被菊叶片半致死温度(LT50)分析
通过低温处理下的相对电导率变化曲线结合logistic方程,拟合出红小、黄菊1号与 1709的拐点温度来表示半致死温度见表 9。由表9可知,红小、黄菊1号与1709的半致死温度分别为-5.124、-3.631、-3.408 ℃。半致死温度越低,说明其忍耐低温的能力越强;反之则耐低温能力较弱,根据半致死温度分析,3种地被菊的抗寒性强弱顺序为:红小>黄菊1号>1709。
2.3.2 3种地被菊叶片各指标隶属度平均值及抗寒性综合性评价分析
针对SOD、POD、MDA、可溶性蛋白含量、可溶性糖含量与相对电导率等生理指标,采用隶属函数法对黄菊1号、红小与1709的抗寒性进行评价,结果如表10所示。红小隶属函数值最大,为0.572;1709隶属函数值最小,为0.366。因此,抗寒性由强到弱的排列顺序为:红小>黄菊1号>1709。

表10 3个地被菊各指标隶属度平均值及抗寒性综合性评价
2.3.3 3种地被菊叶片解剖结构指标的隶属函数分析
利用隶属函数法对10 个解剖结构指标进行抗寒性综合评价,评价结果见表11,结果表明,与低温半致死温度判断结果一致,抗寒性由强到弱的排列顺序为:红小>黄菊1号>1709。

表11 叶片解剖结构隶属函数值
3 结论与讨论
3.1 渗透调节物质对低温的响应
细胞膜是细胞内部与外部环境之间的分界面,其重要功能之一是使植物细胞与外界环境隔离,保持细胞内部环境相对稳定性,起着重要的屏障作用,行使细胞与外界环境的物质交换和信息传递功能[9-10]。当植物受到低温胁迫时,细胞膜最先感知低温刺激,并且作出反应。低温胁迫对细胞的影响最先作用于细胞膜,细胞膜透性随温度下降而增加,电解质和一些小分子有机物大量外渗,从而引起相对电导率的上升[11]。刘大林[12]研究发现,随低温持续时间的延长,番石榴的电渗率急剧增大,说明长时间的持续低温使膜透性增大,造成冻害;相对电导率可在一定程度上反映植物品种间抗寒性的强弱,抗寒性强的品种(品系)质膜的稳定性大于抗寒性弱的品种(系),陈禹兴等[13]研究发现,冬小麦随着低温胁迫的加剧,细胞膜透性增大,相对电导率也相应增加,这与本研究结果一致。
低温胁迫下,自由基和活性氧含量的增加导致膜脂过氧化加剧从而能对细胞膜系统造成损伤[14]。有研究表明,膜脂过氧化的中间产物丙二醛可以抑制细胞保护酶活性并且降低抗氧化物的含量,从而加剧膜脂过氧化,破坏细胞膜结构和功能[15]。MDA 含量越高,膜脂过氧化程度越高,说明膜受伤越严重,徐田军等[16]研究发现,随低温胁迫时间的延长,玉米叶片中 MDA 含量呈增加趋势。低温胁迫下,白三叶叶片中丙二醛含量随着温度的降低呈先升髙后降低趋势[17],相对电导率随温度降低逐渐增加,与本研究中的趋势一致:随着胁迫温度的降低,3个品种的地被菊叶片的 MDA 含量呈现逐渐升高的趋势,说明随着胁迫温度的不断降低,其膜脂过氧化程度逐渐加重,当丙二醛含量积累到一定程度时,相对电导率显著上升,且 LT50越低的植物,其叶片 MDA 含量增加的幅度越小。这与前人在红掌[18]、柑橘[19]等植物上的研究结果一致。
可溶性糖和可溶性蛋白是植物体内重要的渗透调节物,有研究表明,在低温条件下,植物可通过渗透调节作用减轻伤害[20-21]。大量研究表明,可溶性糖含量与植物抗寒性呈正相关,抗寒性越强,可溶性糖含量越高[22-23]。本研究结果也证明了这一点。本研究还发现,随着胁迫温度的降低,3种地被菊的可溶性蛋白含量大致呈先上升后下降趋势,且三者相比红小的平均可溶性蛋白含量最高,这与曾雯[24]的研究结果一致,可溶性蛋白作为另外一种渗透调节物质,其含量的增加会促进下游物质合成,为植物响应低温胁迫提供必需的物质和能量,同时也可以促进细胞外代谢活动的变化,从而恢复生物合成和碳水化合物代谢平衡,所以可溶性蛋白含量与抗寒性呈正相关。
3.2 抗氧化酶活性对低温的响应
超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物酶促防御系统中的主要抗氧化酶,能在一定程度上抵御低温对植物产生的伤害。SOD是酶促防御系统中的第一道防线,SOD能够清除活性氧,使其生成氧气与过氧化氢,再通过 CAT与POD分解过氧化氢,从而保护细胞免受活性氧的伤害[25]。POD 在系统中的主要作用是酶促降解 H2O2,将其分解成氧气(O2)和水(H2O),避免细胞膜发生膜脂过氧化。随低温胁迫时间的延长,植物叶片细胞膜的伤害越大,叶片中抗氧化酶活性均表现为先升高后降低的变化规律,抗寒性强的植物品种在低温条件下具有较高的过氧化氢酶、超氧化物歧化酶活性以及较稳定的过氧化物酶活性,清除自由基能力较强[26]。在本试验中,低温胁迫初期,3个地被菊品种的 SOD 和 POD 活性大幅度上升,说明此时的低温胁迫诱导 SOD 和 POD 活性迅速增强,以保护各植物不受伤害,当胁迫温度超过植物耐受限度后,SOD 和 POD 活性转为下降趋势,说明此时的重度低温胁迫抑制了 SOD 和 POD 活性,对植物体造成了伤害,这与前人在用茄子[27]和花生[28]上的研究结果一致。但抗寒性最强的地被菊品种红小的POD活性高于其他品种,SOD活性低于黄菊1号,说明单一的生理指标不能对植物的抗寒性强弱进行准确描述,通过对多个指标进行综合分析后得出植物抗旱性的评价,才更加客观准确。
3.3 解剖结构对低温的响应
叶片是植物光合作用和蒸腾作用的主要器官,叶片解剖结构能够反映植物对环境变化的响应[29-30]。有关研究发现,植物受到低温胁迫时,通过改变相应结构来应对低温伤害,降低能量消耗,增强对低温环境的适应性。植物受到低温胁迫后,外部形态发生显而易见的变化,叶片组织结构作为生态适应指标与植物的抗寒性有着密切关系。生理生化指标易受环境的改变而表现出不同的变化,但形态和解剖结构是长期特定环境条件下适应性形成的结果,不会因环境因子的改变而发生较大的变化,能体现植物对生态条件的长期适应特点[31]。因此,在抗寒性研究中,形态解剖结构特征被作为一个重要的参考指标。叶片是植物能够敏锐感应环境变化的器官之一,经过自然条件筛选,植物叶片的解剖结构和外部结构在一定程度上能够反映植物对环境变化的响应[32-33]。叶片总厚度、栅栏组织厚度或海绵组织厚度往往会随低温胁迫而发生改变。唐立红等[34]研究发现,紫斑牡丹叶片的表皮厚度、角质膜厚度、叶脉突起度、叶片组织结构紧密度与抗寒性呈正相关,叶片组织结构疏松度与抗寒性呈负相关,其中表皮厚度、叶片结构紧密度和疏松度随温度的降低会发生变化,以主动适应低温环境。研究表明,叶片越厚,角质层越厚,植物的抗寒性越强[35-36],这与本研究结果基本一致。
本研究从7项生理指标隶属函数角度和3项叶片结构指标隶属函数角度分析了3种地被菊的抗寒性,综合判断抗寒性,结果表明,红小、 黄菊1号与1709地被菊品种中,红小抗寒性最强,可在我国寒冷地区大范围进行推广。

