基于指纹图谱和4种指标成分的经典名方一贯煎基准样品量值传递分析
胡钰荧,李淑萍,热依木古丽·阿布都拉,阿吉艾克拜尔·艾萨,吴 涛*
基于指纹图谱和4种指标成分的经典名方一贯煎基准样品量值传递分析
胡钰荧1, 2,李淑萍1,热依木古丽·阿布都拉1,阿吉艾克拜尔·艾萨1,吴 涛1*
1. 中国科学院新疆理化技术研究所 新疆特有药用资源利用重点实验室,新疆 乌鲁木齐 830011 2. 中国科学院大学,北京 100049
建立经典名方一贯煎(Yiguan Decoction)基准样品HPLC指纹图谱,并对其指标性成分(5-羟甲基糠醛、阿魏酸、洋川芎内酯I、毛蕊花糖苷)进行含量测定,研究一贯煎基准样品量值传递规律,为复方制剂研制奠定基础。制备15批一贯煎基准样品,建立其HPLC指纹图谱,明确并归属特征峰;对一贯煎基准样品中指标性成分进行含量测定,分析指标性成分从饮片-基准样品的传递规律。15批一贯煎基准样品HPLC指纹图谱相似度>0.800,标定了29个共有峰,并对各共有峰进行药材归属,其中1号峰为北沙参、麦冬、当归、生地黄、枸杞子共有峰,2号峰为北沙参、麦冬、当归、生地黄、枸杞子、川楝子共有峰,3号峰为北沙参、当归、生地黄、枸杞子共有峰,4、13号峰为生地黄、枸杞子共有峰,5号峰为北沙参、枸杞子、川楝子共有峰,6号峰为生地黄、川楝子共有峰,7、8、10、17、24号峰为当归、枸杞子共有峰,11、20号峰为当归、生地黄共有峰,12号峰为当归、枸杞子、川楝子共有峰,15号峰为枸杞子、川楝子共有峰,18号峰为北沙参、枸杞子共有峰,19号峰为麦冬、当归、枸杞子、川楝子共有峰,29号峰为当归、生地黄、枸杞子、川楝子共有峰,14、22、25~28号峰为当归专属峰,23号峰为生地黄专属峰,9、16、21号峰为枸杞子专属峰。指标性成分5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷质量分数分别为90.3~144.1、75.6~166.2、105.4~200.3、149.9~293.3 μg/g,转移率分别为15.53%~27.11%、38.36%~62.68%、16.23%~31.37%、31.41%~55.65%;测定15批一贯煎干膏率为42.95%~49.93%,传递率为84.39%~96.15%。采用指纹图谱、指标性成分含量测定及干膏率相结合的模式,对经典名方一贯煎基准样品的量值传递过程进行分析,可初步拟定一贯煎基准样品的质量标准,为其后续新药研发提供参考。
经典名方;一贯煎;基准样品;量值传递;HPLC;指纹图谱;5-羟甲基糠醛;阿魏酸;洋川芎内酯I;毛蕊花糖苷;北沙参;麦冬;当归;地黄;枸杞子;川楝子;转移率
经典名方一贯煎系滋阴疏肝之良方,出自清代魏之琇《续名医类案·心胃痛门》[1],由北沙参、麦冬、当归、生地黄、枸杞子、川楝子6味中药组成,因其主治肝证有奇效而被收录于《古代经典名方目录(第一批)》[2]和《古代经典名方关键信息表(7首方剂)》[3]。其原方重用君药生地滋阴养血、补益肝肾;当归、枸杞养血滋阴柔肝;北沙参、麦冬滋养肺胃,养阴生津,佐金平木,扶土制木;四药共为臣药,再以川楝子为佐药,疏肝泄热,理气止痛,复其条达之性[4];诸药合用,共奏疏肝解郁、滋阴养血之功。由于滋阴疏肝系一贯煎传统功效,沿用自古至今,因而一贯煎在临床上多用于治疗肝硬化、肝纤维化、慢性萎缩性胃炎、干燥综合征等消化科、内科疾病,应用广泛且具有显著疗效[4-5]。
刘昌孝院士提出了质量标志物(quality markers,Q-Marker)的概念用以作为中药的质控成分,并从质量传递与溯源、成分特有性、成分有效性、复方配伍环境以及成分可测性5个方面对中药Q-Marker的内涵及其发现和确定思路及方法进行了论述[6-8]。课题组前期基于质量传递与溯源原则、成分特有性原则、成分有效性原则、复方配伍环境原则以及成分可测性原则5个方面,从一贯煎中预测分析到17个Q-Marker,其中包括有机酸类成分阿魏酸、苯乙醇苷类成分毛蕊花糖苷、香豆素类成分佛手柑内酯等[9]。
目前,一贯煎的相关研究多集中在药理作用、药效机制及临床应用等方面,关于以基准样品量值传递为核心的质量控制方面鲜有文献报道。因而,本实验通过制备15批一贯煎基准样品,建立其HPLC指纹图谱,进行相似度评价及特征峰归属分析,并结合5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷4个指标性成分含量、转移率以及干膏率的传递关系,进行饮片到基准样品的量值传递相关性质量控制研究并深入分析,以期承载经典名方的有效性和安全性,为后续复方制剂的开发奠定实践基础并提供理论支撑。
1 仪器与材料
1.1 仪器
Sartorius BT 25S型十万分之一电子天平,赛多利斯科学仪器(北京)有限公司;SK7210LHC型超声清洗仪,上海科导超声仪器有限公司;FTS-10A型陶瓷煎药锅,广东省一壶万里电器实业有限公司;SHB-III型循环水式多用真空泵,郑州长城科工贸有限公司;H22-X3型九阳电陶炉,杭州九阳生活电器有限公司;FD-2A型真空冷冻干燥机,北京博医康实验仪器有限公司;Agilent型高效液相色谱仪,赛默飞世尔科技(中国)有限公司,包含二极管阵列检测器(DAD)和Chromeleon 7.2色谱工作站;LC-LX-H185C型台式高速离心机,上海力辰科技有限公司。
1.2 药材与试剂
北沙参、麦冬、当归、生地黄、枸杞子和川楝子药材经中国科学院新疆理化技术研究所刘戈宇研究员鉴定,分别为伞形科珊瑚菜属植物珊瑚菜Fr. Schmidtex Miq.的干燥根、百合科沿阶草属植物麦冬(L. f) Ker-Gawl.的干燥块根、伞形科当归属植物当归(Oliv.) Diels的干燥根、玄参科地黄属植物地黄Libosch.的新鲜或干燥块根、茄科枸杞属植物宁夏枸杞L.的干燥成熟果实和楝科楝属植物川楝Sieb. et Zucc.的干燥成熟果实。
单味饮片质量经前期检测均符合要求,产地信息见表1。
表1 一贯煎组方药材来源信息
Table 1 Source information of Yiguan Decoction prescription medicinal materials
序号北沙参麦冬当归生地黄枸杞子川楝子 批号产地批号产地批号产地批号产地批号产地批号产地 1BSSCF01内蒙古赤峰MDMY01四川绵阳DGMX01甘肃岷县SDHJZ01河南焦作GQZZN01宁夏中宁CLZJY01四川简阳 2BSSCF02内蒙古赤峰MDMY02四川绵阳GSMX02甘肃岷县SDHJZ02河南焦作GQZZN02宁夏中宁CLZJY02四川简阳 3BSSCF03内蒙古赤峰MDMY03四川绵阳GSMX03甘肃岷县SDHJZ03河南焦作GQZZN03宁夏中宁CLZJY03四川简阳 4BSSCF04内蒙古赤峰MDMY04四川绵阳GSMX04甘肃岷县SDHJZ04河南焦作GQZZN04宁夏中宁CLZJY04四川简阳 5BSSCF05内蒙古赤峰MDMY05四川绵阳GSMX05甘肃岷县SDHJZ05河南焦作GQZZN05宁夏中宁CLZJY05四川简阳 6BSSAG01河北安国MDHZ01浙江杭州DGLJ01云南丽江SDHXY01陕西咸阳GQZZW01宁夏中卫CLZCD01四川成都 7BSSAG02河北安国MDHZ02浙江杭州DGLJ02云南丽江SDHXY02陕西咸阳GQZZW02宁夏中卫CLZCD02四川成都 8BSSAG03河北安国MDHZ03浙江杭州DGLJ03云南丽江SDHXY03陕西咸阳GQZYS01青海玉树CLZCD03四川成都 9BSSAG04河北安国MDHZ04浙江杭州DGLJ04云南丽江SDHXY04陕西咸阳GQZYS02青海玉树CLZCD04四川成都 10BSSAG05河北安国MDHZ05浙江杭州DGLJ05云南丽江SDHXY05陕西咸阳GQZYS03青海玉树CLZCD05四川成都 11BSSSD01山东莱阳MDST01四川三台DGDC01甘肃宕昌SDHBA01河南博爱GQZYS04青海玉树CLZCQ01重庆 12BSSSD02山东莱阳MDST02四川三台GSDC02甘肃宕昌SDHBA02河南焦作GQZYM01甘肃玉门CLZCQ02重庆 13BSSSD03山东莱阳MDST03四川三台GSDC03甘肃宕昌SDHBA03河南焦作GQZYM02甘肃玉门CLZCQ03重庆 14BSSSD04山东莱阳MDST04四川三台GSDC04甘肃宕昌SDHBA04河南焦作GQZHB01河北安国CLZHB01湖北恩施 15BSSSD05山东莱阳MDST05四川三台GSDC05甘肃宕昌SDHBA05河南焦作GQZHB02河北安国CLZHB02湖北恩施
对照品毛蕊花糖苷(批号21123001)、藁本内酯(批号22031804)、咖啡酸(批号20110501),均购自成都普菲德生物科技有限公司;对照品阿魏酸(批号110773-201313)、槲皮素(批号100081-201610)、5-羟甲基糠醛(批号111626-202114)、东莨菪内酯(批号110768-200504),均购自中国食品药品检定研究院;对照品洋川芎内酯I(批号21012505)、绿原酸(批号15060713)、伞形花内酯(批号17042603)均购自上海纯优生物科技有限公司;各对照品质量分数均≥94%。乙腈、甲酸,色谱纯,购自Fisher公司;甲醇,分析纯,购自北京化工厂;怡宝纯净水,购自华润怡宝饮料(中国)有限公司;其他试剂为分析纯。
2 方法与结果
2.1 一贯煎基准样品的制备
《医方絜度》[10]记载一贯煎处方为“北沙参、麦冬、当归各一钱五分,枸杞、生地各三钱,川楝子二钱。”《古代经典名方关键信息表(7首方剂)》[3]明确处方剂量与制法如下:北沙参、麦冬、当归各5.60 g,生地黄、枸杞子各11.19 g,川楝子7.46 g,水煎服。因《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》[11]明确水煎服应参照《医疗机构中药煎药室管理规范》[12]的相关规定,即药材浸泡30 min以上、加水量应没过药材1.0~1.5 cm为宜,滋补类药材应煎煮40~60 min,并结合具体情况加以优化。
本课题组前期以5-羟甲基糠醛、阿魏酸、毛蕊花糖苷和洋川芎内酯I含量和干膏率为参考指标,赋以权重系数对一贯煎基准样品制备工艺进行综合评分,通过料液比、煎煮时间、煎煮次数、提取方式、干燥方式等单因素筛选,最终确定一贯煎基准样品制备方法:处方药材加12倍量,浸泡30 min,煎煮2次,武火加热煮沸后,文火煎煮60 min,采用100目纱布滤过,合并滤液,浓缩至400 mL,即为一贯煎标准煎液;精密移取一贯煎标准煎液5 mL于25 mL西林瓶中,置于−80 ℃预冷2 h的冷冻干燥机,冻干温度−80 ℃,真空度(4±1)Pa,冷冻干燥24 h,取出压盖密塞,即得一贯煎基准样品(一贯煎冻干粉)。将北沙参、麦冬、当归、生地黄、枸杞子、川楝子各15批饮片采用随机数表法组合,编号为S1~S15,具体组合信息见表2。按上述工艺制备15批一贯煎基准样品以及单味饮片、单味饮片阴性样品。
表2 15批一贯煎基准样品随机组合信息
Table 2 Random combination information of 15 batches of Yiguan Decoction benchmark samples
序号饮片批号 北沙参麦冬当归生地黄枸杞子川楝子 S1BSSCF01MDST04DGDC05SDHXY02GQZZN05CLZCQ01 S2BSSAG01MDMY04DGDC02SDHJZ03GQZYS02CLZCD01 S3BSSSD02MDHZ02DGDC04SDHJZ05GQZZN03CLZJY02 S4BSSSD05MDHZ05DGLJ01SDHBA02GQZHB01CLZCD04 S5BSSCF05MDMY05DGMX05SDHJZ01GQZZN04CLZJY05 S6BSSCF04MDMY02DGMX01SDHXY01GQZYM02CLZCQ03 S7BSSAG02MDHZ04DGLJ03SDHBA04GQZZW01CLZHB01 S8BSSCF03MDST01DGDC01SDHXY05GQZYS01CLZCD02 S9BSSAG04MDMY01DGLJ05SDHXY03GQZZW02CLZCD05 S10BSSAG05MDHZ01DGMX02SDHBA03GQZHB02CLZJY04 S11BSSSD04MDST02DGDC03SDHXY04GQZYS04CLZHB02 S12BSSSD01MDHZ03DGMX03SDHJZ04GQZNY02CLZJY01 S13BSSAG03MDST05DGLJ04SDHJZ02GQZYS03CLZCQ02 S14BSSCF02MDST03DGMX04SDHBA05GQZYM01CLZJY03 S15BSSSD03MDMY03DGLJ02SDHBA01GQZZN01CLZCD03
2.2 一贯煎基准样品指纹图谱的建立
2.2.1 色谱条件 SunFire®C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%甲酸水溶液,梯度洗脱:0~30 min,4%~10%乙腈;30~36 min,10%~16%乙腈;36~51 min,16%~62%乙腈;51~52 min,62%~90%乙腈;52~57 min,90%乙腈;体积流量1 mL/min;柱温30 ℃;检测波长280、321 nm;进样量10 μL。
2.2.2 供试品溶液的制备 精密称定一贯煎基准样品冻干粉约1 g,精密加入10 mL 50%甲醇溶液,超声30 min,于13 000 r/min离心5 min(离心半径6 cm),取上清液过0.22 μm微孔滤膜,取续滤液,即得供试品溶液。
2.2.3 对照品溶液的制备 取5-羟甲基糠醛、绿原酸、咖啡酸、伞形花内酯、东莨菪内酯、阿魏酸、毛蕊花糖苷、洋川芎内酯I、藁本内酯、槲皮素对照品适量,以50%甲醇溶液制成质量浓度均为40 μg/mL的混合对照品溶液,即得。
2.2.4 精密度试验 取编号为S1的一贯煎基准样品1份,按“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件连续进样6次,以6号峰(5-羟甲基糠醛)为参照(参照峰选择依据:以峰形对称,分离度优,无拖尾现象,且峰面积稳定为选择依据,选定5-羟甲基糠醛作为参照峰),计算各共有峰的相对保留时间的RSD均<0.58%,相对峰面积的RSD均<0.02%,表明仪器精密度良好。
2.2.5 重复性试验 取编号为S1的一贯煎基准样品1份,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.2.1”项下色谱条件进样,以6号峰(5-羟甲基糠醛)为参照,计算各共有峰的相对保留时间的RSD均<0.08%,相对峰面积的RSD均<0.07%,表明该方法重复性良好。
2.2.6 稳定性试验 取编号为S1的一贯煎基准样品1份,按“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件分别在制备后0、3、6、9、12、18、24 h进样,以6号峰(5-羟甲基糠醛)为参照,计算各共有峰相对保留时间的RSD均<0.12%,相对峰面积的RSD均<0.09%,表明供试品溶液在24 h内稳定性良好。
2.2.7 指纹图谱建立及相似度评价 按“2.2.2”项下方法制备15批一贯煎基准样品的供试品溶液,按“2.2.1”项下色谱条件进样,将15批一贯煎基准样品色谱图导入中药色谱指纹图谱相似度评价系统(2012版),以S1为参照图谱,采用中位数法,时间窗设为0.1 min,S1~S15的HPLC指纹图谱见图1。15批一贯煎基准样品(S1~S15)指纹图谱相似度分别为0.957、0.826、0.934、0.904、0.866、0.965、0.948、0.922、0.970、0.849、0.862、0.850、0.853、0.910、0.926,结果见表3。除S2、S5、S10~S13,其余批次基准样品相似度均在0.900以上,结果表明药材的产地会直接影响一贯煎基准样品指纹图谱相似度评价,道地产区药材和主产区药材存在一定差异性。
根据15批一贯煎基准样品,拟合出对照指纹图谱(R)。从中共标定了29个共有峰,通过与对照品比对,指认了其中10个共有峰,分别为6号峰5-羟甲基糠醛、16号峰绿原酸、18号峰咖啡酸、20号峰伞形花内酯、21号峰东莨菪内酯、22号峰阿魏酸、23号峰毛蕊花糖苷、24号峰槲皮素、26号峰洋川芎内酯I、28号峰藁本内酯,一贯煎基准样品对照指纹图谱及混合对照品HPLC图谱见图2。

图1 15批一贯煎基准样品的HPLC指纹图谱
表3 15批一贯煎基准样品指纹图谱相似度
Table 3 Fingerprint similarities of 15 batches of benchmark samples of Yiguan Decoction
样品编号相似度 S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15R S11.0000.8200.9520.8340.7630.9370.8130.9040.9390.8900.8340.8200.7760.9660.8550.957 S20.8201.0000.7600.7660.5780.8380.8460.8100.8160.6510.6450.8740.6650.7850.6570.826 S30.9520.7601.0000.8400.8220.7290.8010.8960.9370.8070.8110.7920.8170.9540.8920.934 S40.8340.7660.8401.0000.9230.8400.8810.7320.8330.6430.6670.7830.7170.8720.7740.904 S50.7630.5780.8220.9231.0000.8220.8350.6670.8190.6650.6810.6060.6950.8470.8310.866 S60.9370.8380.7290.8400.8221.0000.8960.7350.9370.8070.8110.7920.8170.9540.8920.965 S70.8130.8460.8010.8810.8350.8961.0000.8440.9200.7950.8190.7880.7840.9440.8530.948 S80.9040.8100.8960.7320.6670.7350.8441.0000.9150.7810.7960.8670.9170.9090.7950.922 S90.9390.8160.9370.8330.8190.9370.9200.9151.0000.8310.8470.7980.8480.9620.8890.970 S100.8900.6510.8070.6430.6650.8070.7950.7810.8311.0000.9660.5960.6760.8280.9440.849 S110.8340.6450.8110.6670.6810.8110.8190.7960.8470.9661.0000.6080.7090.8490.9370.862 S120.8200.8740.7920.7830.6060.7920.7880.8670.7980.5960.6081.0000.8650.8090.6160.850 S130.7760.6650.8170.7170.6950.8170.7840.9170.8480.6760.7090.8651.0000.8270.7230.853 S140.9660.7850.9540.8720.8470.9540.9440.9090.9620.8280.8490.8090.8271.0000.8960.910 S150.8550.6570.8920.7740.8310.8920.8530.7950.8890.9440.9370.6160.7230.8961.0000.926 R0.9570.8260.9340.9040.8660.9650.9480.9220.9700.8490.8620.8500.8530.9100.9261.000
2.2.8 饮片-基准样品指纹图谱峰归属关系分析与传递 分别取北沙参、麦冬、当归、生地黄、枸杞子和川楝子饮片冻干粉约1 g,按照“2.2.2”方法制备饮片供试品溶液,同法制备各饮片阴性样品供试品溶液,按照“2.2.1”项下色谱条件进样,建立北沙参、麦冬、当归、生地黄、枸杞子和川楝子单味饮片及单味饮片阴性样品的指纹图谱。通过比对一贯煎基准样品与单味饮片、单味饮片阴性样品的HPLC图谱,发现单味饮片的特征峰均可传递到基准样品的对照图谱中,结果见图3。图谱中14、22(阿魏酸)、25、26(洋川芎内酯I)、27、28号峰(藁本内酯)为当归专属峰,23号峰(毛蕊花糖苷)为生地黄专属峰,9、16(绿原酸)、21号峰为枸杞子专属峰;此外,1号峰归属于北沙参、麦冬、当归、生地黄、枸杞子,2号峰属于北沙参、麦冬、当归、生地黄、枸杞子、川楝子,3号峰归属于北沙参、当归、生地黄、枸杞子,4、13号峰归属于生地黄、枸杞子,5号峰属于北沙参、枸杞子、川楝子,6号峰(5-羟甲基糠醛)属于生地黄、川楝子,7、8、10、17、24号峰属于当归、枸杞子,11、20号峰属于当归、生地黄,12号峰属于当归、枸杞子、川楝子,15号峰属于枸杞子、川楝子,18号峰归属于北沙参、枸杞子,19号峰归属于麦冬、当归、枸杞子、川楝子,29号峰归属于当归、生地黄、枸杞子、川楝子。

6-5-羟甲基糠醛 16-绿原酸 18-咖啡酸 20-伞形花内酯 21-东莨菪内酯 22-阿魏酸 23-毛蕊花糖苷 24-槲皮素 26-洋川芎内酯I 28-藁本内酯
确定单味饮片和基准样品的特征峰归属,计算单味饮片和基准样品的特征峰相对峰面积并进行分析比较,结果见表4、5。饮片-基准样品指纹图谱的传递在特征峰个数与峰面积方面是比较稳定的,标定的各单味药饮片的主要物质群均能完整传递到基准样品,表明一贯煎基准样品制备工艺和供试品溶液制备方法未造成饮片主要物质群丢失。由此可见,大部分一贯煎基准样品特征峰和主要物质群在饮片与基准样品间传递较为稳定,归属关系清晰。
2.3 一贯煎基准样品多成分含量测定
根据“2.2.8”项研究结果,选择5-羟甲基糠醛(生地黄、川楝子),洋川芎内酯I和阿魏酸(当归),毛蕊花糖苷(生地黄)为指标性成分,建立了一贯煎基准样品的含量测定方法。
2.3.1 色谱条件 SunFire®C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%甲酸水溶液,梯度洗脱:0~6 min,2%~4%乙腈;6~36 min,4%~16%乙腈;36~51 min,16%~62%乙腈;51~52 min,62%~90%乙腈;52~57 min,90%乙腈;体积流量1 mL/min;柱温30 ℃;检测波长280、321 nm;进样量10 μL。
2.3.2 对照品溶液的制备 取5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷对照品适量,精密称定,加50%甲醇溶液制成质量浓度分别为158.4、82.4、142.4、103.2 μg/mL的混合对照品溶液,备用。
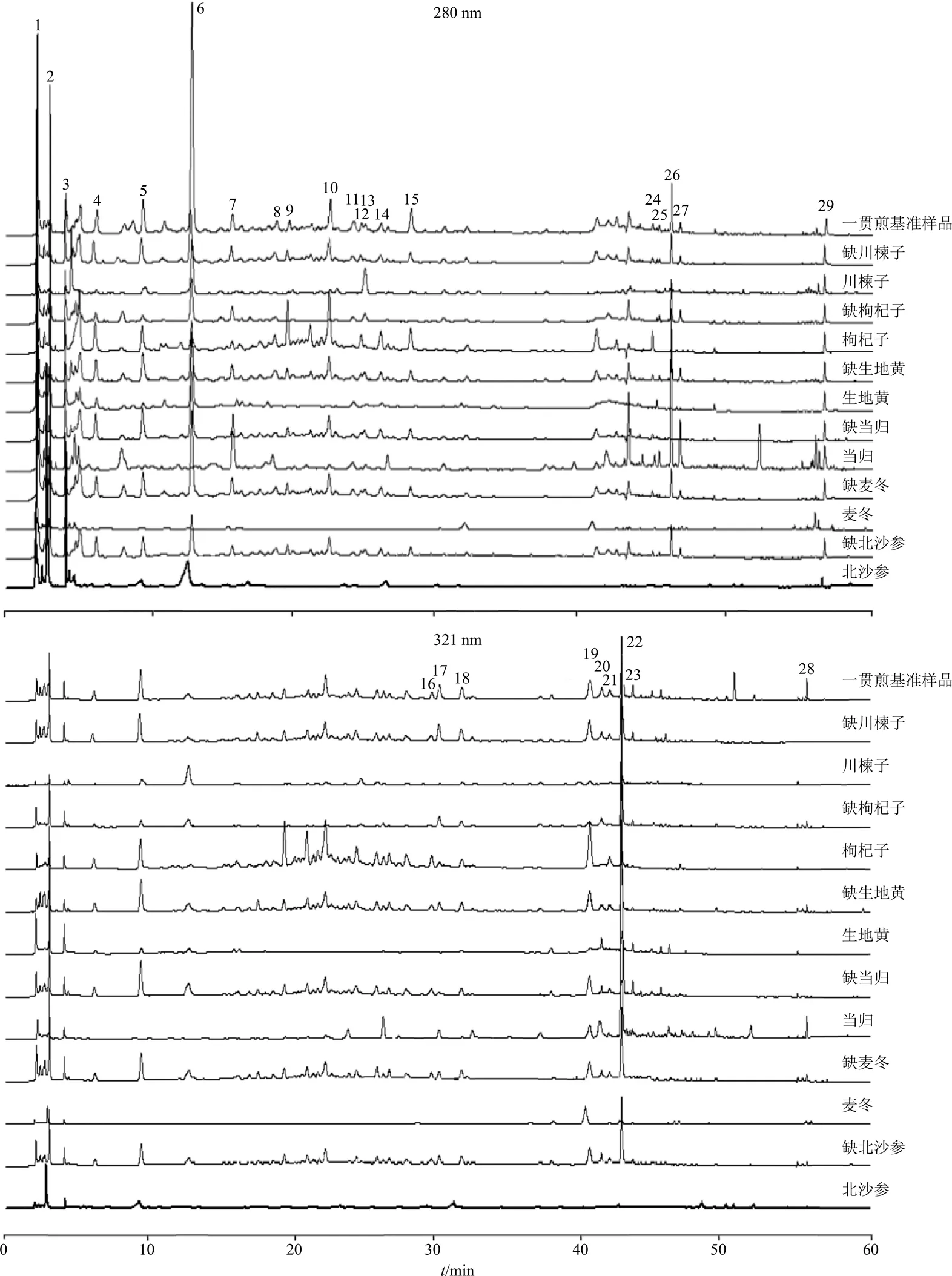
图3 一贯煎基准样品的特征峰归属
2.3.3 供试品溶液的制备 与“2.2.2”项下供试品溶液的制备方法一致。
表4 饮片-基准样品中特征峰的归属
Table4 Attributionof characteristic peaks in decoction pieces and benchmark samples
峰号特征峰归属峰号特征峰归属 北沙参麦冬当归生地黄枸杞子川楝子北沙参麦冬当归生地黄枸杞子川楝子 1+++++−16−−−−+− 2++++++17−−+−+− 3+−+++−18+−−−+− 4−−−++−19−++−++ 5+−−−++20−−++−− 6−−−+−+21−−−−+− 7−−+−+−22−−+−−− 8−−+−+−23−−−+−− 9−−−−+−24−−+−+− 10−−+−+−25−−+−−− 11−−++−−26−−+−−− 12−−+−++27−−+−−− 13−−−++−28−−+−−− 14−−+−−−29−−++++ 15−−−−++
表5 饮片-基准样品中特征峰相对峰面积的传递
Table5 Transmission of relative peak area of characteristic peaks in decoction pieces and benchmark samples
峰号相对峰面积峰号相对峰面积 北沙参麦冬当归生地黄枸杞子川楝子基准样品北沙参麦冬当归生地黄枸杞子川楝子基准样品 10.200.400.100.510.25−0.4316−−−−0.10−0.10 21.001.000.321.001.000.482.9117−−0.04−0.12−0.15 30.28−0.120.340.75−0.55180.06−−−0.13−0.12 4−−−0.160.46−0.2919−0.390.12−0.440.030.38 50.18−−−0.570.190.6720−−0.180.13−−0.24 6−−−0.86−1.001.0021−−−−0.22−0.06 7−−0.35−0.21−0.2022−−1.00−−−0.81 8−−0.06−0.17−0.1123−−−0.08−−0.05 9−−−−0.80−0.1224−−0.06−0.18−0.03 10−−0.03−0.86−0.7625−−0.09−−−0.05 11−−0.150.04−−0.2326−−0.45−−−0.48 12−−0.02−0.160.510.2227−−0.18−−−0.16 13−−−0.060.22−0.2928−−0.09−−−0.05 14−−0.35−−−0.3129−−0.020.140.180.210.18 15−−−−0.280.030.31
2.3.4 线性关系考察 取不同质量浓度的混合对照品溶液,按“2.3.1”项下色谱条件进样,以进样质量为横坐标(),峰面积为纵坐标(),绘制标准曲线并计算回归方程,结果分别为5-羟甲基糠醛=74.795-81.621,=0.999 8,线性范围1.2~158.4 μg/mL;洋川芎内酯I=41.866-69.877,=0.999 1,线性范围4.7~82.4 μg/mL;阿魏酸=33.342+7.366 1,=0.999 2,线性范围2.2~142.4 μg/mL;毛蕊花糖苷=3.709 2+68.882,=0.999 0,线性范围2.1~103.2 μg/mL。
2.3.5 精密度考察 取一贯煎基准样品(S1)供试品溶液1份,按“2.3.1”项下色谱条件,连续进样6次,计算各指标性成分峰面积的RSD值,结果5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷峰面积的RSD分别为0.49%、0.37%、0.37%、0.37%,表明仪器精密度良好。
2.3.6 重复性考察 取一贯煎基准样品(S1),按“2.2.2”项下方法平行制备供试品溶液6份,按“2.3.1”项下色谱条件进样,计算各指标性成分质量分数的RSD值,结果5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷质量分数的RSD分别为0.32%、0.34%、0.34%、0.34%,表明该方法重复性良好。
2.3.7 稳定性考察 取一贯煎基准样品(S1)供试品溶液1份,按“2.3.1”项下色谱条件分别在制备后0、3、6、9、12、18、24 h进样,计算各指标性成分峰面积的RSD值,结果5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷峰面积的RSD分别为0.42%、0.60%、0.44%、0.44%,表明供试品溶液在24 h内稳定性良好。
2.3.8 加样回收率考察 精密称定已测知指标性成分含量的一贯煎基准样品适量,共6份,分别加入一定量的对照品溶液,按“2.2.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件分别进样,进行含量测定,计算4种指标性成分的加样回收率及RSD值,结果5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷平均加样回收率分别为88.78%、94.86%,94.25%、96.53%,RSD分别为2.02%、1.62%、2.71%、2.94%,表明该方法加样回收率良好。
2.3.9 4种指标性成分含量测定与量值传递分析 取15批一贯煎基准样品、当归、生地黄和川楝子单饮片冻干粉,按“2.2.2”项下方法制备供试品溶液,并按“2.3.1”项下色谱条件进样,进行指标成分含量测定,计算指标成分从饮片-一贯煎基准样品的转移率,结果见表6。
结果表明,15批基准样品(S1~S15)中5-羟甲基糠醛质量分数为90.3~144.1 μg/g,洋川芎内酯I质量分数为75.6~166.2 μg/g,阿魏酸质量分数为105.4~200.3 μg/g,毛蕊花糖苷质量分数为149.9~293.3 μg/g;5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷的转移率分别为15.53%~27.11%、38.36%~62.68%、16.23%~31.37%、31.41%~55.65%。结果5-羟甲基糠醛、洋川芎内酯I、阿魏酸、毛蕊花糖苷4个指标成分的含量和转移率大都位于其均值的±30%范围内,说明基准样品的制备工艺相对稳定可行,指标成分可稳定从饮片传递至基准样品中。
表6 15批一贯煎基准样品指标性成分含量测定及转移率
Table6 Content determination and transfer rate of indicator components in 15 batches of Yiguan Decoction benchmark samples
编号5-羟甲基糠醛/(μg∙g−1)洋川芎内酯I/(μg∙g−1)阿魏酸/(μg∙g−1)毛蕊花糖苷/(μg∙g−1) 饮片基准样品转移率/%饮片基准样品转移率/%饮片基准样品转移率/%饮片基准样品转移率/% S1368.090.324.54230.8100.443.50647.7105.416.27395.5189.447.89 S2549.6123.422.45247.6109.444.18417.5121.929.20547.6292.453.40 S3725.1112.615.53232.4107.646.30627.4129.720.67505.9272.053.77 S4695.3117.516.90210.598.346.70951.3154.416.23523.1279.853.49 S5623.7110.217.67378.7166.243.89601.7144.123.95809.8278.234.35 S6531.1102.019.21263.4125.847.76484.4115.423.82413.4204.749.52 S7647.6116.217.94174.694.253.95765.0151.819.84662.9263.139.69 S8401.5100.825.11233.0103.444.38410.3128.731.37459.1255.555.65 S9353.795.927.11147.192.262.681 009.3200.319.85448.7245.854.78 S10453.6111.224.51374.6143.738.36618.7124.520.12798.5274.834.41 S11534.6107.020.01181.299.755.02693.2130.718.85329.6149.945.48 S12613.1114.018.59300.9131.943.84709.8144.620.37466.5245.852.69 S13702.0144.120.53177.396.554.43963.3156.516.25588.2262.744.66 S14725.2120.116.56257.2115.444.87694.8128.718.52893.1280.531.41 S15629.8125.619.94144.175.652.46721.6147.920.50893.1293.332.84 均值570.3112.720.44236.9110.748.15687.7139.021.05582.3252.542.05
S1~S15中S5和S15的洋川芎内酯I、S9的阿魏酸和S11的毛蕊花糖苷含量略超出其均值的70%~130%,但也在范围边缘相差并不是很大,其原因可能与药材的产地相关。研究表明,岷当归中苯酞类成分洋川芎内酯I、云当归阿魏酸和怀地黄毛蕊花糖苷含量均高于其他产区[13-17],S5中当归来自甘肃岷县,S9、S15中当归来自云南丽江,S11中地黄来自陕西咸阳,受产地影响S5和S15中洋川芎内酯I、S9中阿魏酸和S11中毛蕊花糖苷含量略超出均值的±30%。
2.4 干膏率的测定及传递关系分析
取“2.1”项中制备的一贯煎标准煎液和一贯煎各单味饮片标准煎液,精密量取标准煎液25 mL,置于已干燥至恒定质量的蒸发皿中,恒温水浴干燥后,105 ℃干燥3 h,后置于干燥器中冷却30 min,迅速精密称定质量,计算15批一贯煎基准样品和一贯煎各单味饮片的干膏率。
干膏率=/
表示所得干膏质量,表示煎液总体积,表示取样体积,表示处方饮片质量
理论干膏率=∑(单味饮片干膏率×单味饮片质量/全方饮片总质量)
干膏转移率=干膏率/理论干膏率
根据上述公式计算干膏率、理论干膏率和干膏率转移率,结果见表7。结果表明,15批一贯煎干膏率为42.95%~49.93%,平均干膏率为46.03%,理论干膏率为44.67%~55.06%,平均理论干膏率为50.16%,干膏传递率为84.39%~96.15%,平均干膏率传递率为91.84%,各批次一贯煎干膏率、理论干膏率和干膏传递率均位于均值的90%~110%,表明饮片中成分可稳定传递至基准样品。
表7 15批一贯煎基准样品干膏率及传递率
Table7 Dry extract yield and transfer rate of 15 batches of Yiguan Decoction benchmark samples
编号干膏率/%传递率/% 北沙参麦冬当归生地黄枸杞子川楝子理论值实际值 S119.8220.5647.7060.1847.3159.0645.8143.0693.99 S220.5316.9053.0462.8443.5451.8044.6742.9596.15 S320.1616.5744.2965.0662.4353.8848.9344.9591.87 S414.3415.4447.1367.2463.5458.3149.9345.9492.00 S525.4913.8044.0172.0172.6461.8954.6049.9391.44 S626.1017.8746.9162.7966.6258.6351.3447.9793.43 S714.0415.5753.7369.7350.7059.9548.4844.2591.26 S825.7710.6349.3473.6969.7064.7955.0646.4684.39 S918.3411.3953.0471.9661.9350.7150.1745.6891.05 S1023.1713.3651.1070.5460.5461.7351.8448.8794.27 S1122.6421.9955.0369.9558.2445.3249.9745.9591.97 S1215.9915.9952.6367.6163.4163.9251.8147.2291.14 S1316.3116.3144.5766.6063.1649.6748.3443.0789.09 S1423.2916.1450.6470.1160.7442.6449.0245.2492.27 S1518.6313.1645.1665.2770.0966.8052.4048.9093.32 均值20.3115.7149.2267.7060.9750.6150.1646.0391.84
3 讨论
经典名方基准样品作为后续复方制剂研究及质量控制的参照,其指标性成分的选择在基准样品质量控制中具有重要意义。一贯煎处方中生地黄为君药,能够滋阴养血、补益肝肾;当归、枸杞、北沙参、麦冬四药共为臣药,具有养血滋阴柔肝、滋养肺胃、养阴生津的功效;川楝子为佐药,疏肝泄热,理气止痛。诸药合用,共奏疏肝解郁、滋阴养血之功。现代药理学研究表明,当归中阿魏酸、洋川芎内酯I均能够抑制促炎细胞因子的分泌,激活抗氧化反应元件调控基因的转录,改善肝脏病理状态,从而起到保护肝脏的作用[18-20]。
生地黄和川楝子共有的5-羟甲基糠醛可通过抑制肝脏促炎因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-1β(interleukin-1β,IL-1β)的产生,避免或缓解肝氧化损伤,从而起到一定的肝脏保护作用[21]。研究还发现,生地黄中毛蕊花糖苷能够保护肝损伤,降低丙氨酸氨基转移酶、谷氨酸氨基转移酶的活性和肝指数[22-23]。因此,基于指标成分与药效关联性分析,故选择5-羟甲基糠醛、阿魏酸、毛蕊花糖苷、洋川芎内酯I作为含量测定中一贯煎的指标性成分。
本实验以指纹图谱、指标成分和干膏率的传递为核心,探讨饮片-一贯煎基准样品的关键质量属性的传递规律。结果表明,15批一贯煎基准样品归属了29个共有峰,确定了其中10个成分并明确药材归属,分别为6号峰5-羟甲基糠醛、16号峰绿原酸、18号峰咖啡酸、20号峰伞形花内酯、21号峰东莨菪内酯、22号峰阿魏酸、23号峰毛蕊花糖苷、24号峰槲皮素、26号峰洋川芎内酯I和28号峰藁本内酯。
但《中国药典》2020年版上记载的药材质控成分并未被囊括于29个特征峰中,其原因为麦冬中鲁斯可皂苷元不具备HPLC-UV检测的结构特点,地黄中梓醇和地黄苷D、枸杞子中甜菜碱以及川楝子中川楝素在低波段方才能被检出,而低波段存在倒峰、末端吸收、基线漂移和氨基酸、多糖超高吸收等干扰。而当归中洋川芎内酯I、地黄与川楝子共有的5-羟甲基糠醛在280 nm下吸收较大且峰形和分离度良好,当归中阿魏酸、藁本内酯和地黄毛蕊花糖苷在321 nm下吸收较高且峰形与分离度均能满足检测要求。
另外,定性的绿原酸、咖啡酸、伞形花内酯、东莨菪内酯和槲皮素也可在280、321 nm下顺利检出,因此,指纹图谱和成分含量测定检测波长选定为280、321 nm。对于上述不足之处,本课题组今后将进一步深入研究,结合HPLC-ELSD方法对一贯煎非UV成分(甾体皂苷类和氨基酸类成分)展开指纹图谱研究和含量测定方,应用LC-MS(低波段下吸收较大的成分)进行全面质量控制,力求一贯煎质控指标包含《中国药典》2020年版[24]单味药项下规定的指标性成分,为一贯煎基准样品质量评价提供更加全面的理论依据。
以5-羟甲基糠醛、洋川芎内酯I、阿魏酸和毛蕊花糖苷含量为参考指标,通过比较不同提取溶剂及剂量、不同提取方式、不同提取时间,最终筛选得到一贯煎基准样品供试品溶液制备方法:精密称定一贯煎基准样品适量,以50%甲醇超声提取,离心,即得。S5和S15的洋川芎内酯I、S9的阿魏酸和S11的毛蕊花糖苷含量略超出均值的70%~130%,但也在范围边缘相差并不是很大,推测缘由可能与药材的产地相关。经研究发现,岷当归洋川芎内酯I[13]、云当归阿魏酸[14]均为成分识别标志,不同产区中岷当归苯酞类成分含量最高[15],云当归阿魏酸含量最高[16],S5中当归来自甘肃岷县,S9、S15中当归来自云南丽江,受产地影响S5中洋川芎内酯I和S9中阿魏酸含量略超出均值的130%,S15中洋川芎内酯I含量略低于均值的70%。研究表明,不同产区中河南产地黄中毛蕊花糖苷的含量普遍较高[17],而河南为地黄道地产区,S11中地黄来自陕西咸阳,并非道地产区药材,受产地影响S11中地黄的毛蕊花糖苷含量略低于均值的70%。因此,在制备一贯煎基准样品期间,需考虑药材产地以保证基准样品质量稳定性,并动态监控成分含量。
4 结论
一贯煎依托“理、法、方、药”,组方严谨、用药精炼,具有滋阴疏肝之功效,主治肝肾阴虚证。为保证经典名方质量疗效一致,需以基准样品为核心,建立从饮片到中间体的质量控制体系,而基准样品质量稳定的前提是处方所用饮片的质量需均一、稳定[25]。本实验采用指纹图谱、指标性成分含量测定及干膏率相结合的模式,对经典名方一贯煎基准样品的量值传递过程进行研究分析,初步建立了科学稳定的基准样品质量评价方法,以期为经典名方一贯煎的后续开发及相关制剂的质量控制提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 魏玉璜. 续名医类案(卷十八) [M]. 北京: 人民卫生出版社, 1957: 1770.
[2] 国家中医药管理局. 关于发布《古代经典名方目录(第一批)》的通知 [EB/OL]. (2018-04-16) [2023-03-21]. http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/7107. html.
[3] 国家中医药管理局, 国家药品监督管理局. 关于发布《古代经典名方关键信息考证原则》《古代经典名方关键信息表(7首方剂)》的通知 [EB/OL]. (2020-11-10) [2023-03-21]. http://kjs.satcm.gov.cn/zhengcewenjian/ 2020-11-10/18132.html.
[4] 徐静, 卢贺起, 李淑莉, 等. 一贯煎临床与实验研究新进展 [J]. 湖北中医杂志, 2018, 40(7): 61-64.
[5] 郑嘉琦, 张定棋, 简迅, 等. 经典名方一贯煎治疗慢性肝病的临床与基础研究进展 [J]. 上海中医药杂志, 2021, 55(6): 96-100.
[6] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物 (Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[7] Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[8] 刘昌孝. 中药质量标志物 (Q-Marker) 研究发展的5年回顾 [J]. 中草药, 2021, 52(9): 2511-2518.
[9] 胡钰荧, 陈丽, 李淑萍, 等. 经典名方一贯煎的历史沿革、现代研究进展和质量标志物 (Q-Marker) 预测分析 [J]. 中草药, 2022, 53(23): 7585-7595.
[10] 清·吴杖仙著. 清·坐啸山人辑. 医方絜度 [M]. 上海: 上海科学技术出版社, 2004: 41.
[11] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》的通告. (2021-08-27) [2023-03-21]. https://www.cde.org.cn/main/news/view InfoCommon/1c18dd163e7c9221786e5469889367d0.
[12] 国家中医药管理局, 卫生部. 国家中医药管理局、卫生部关于印发医疗机构中药煎药室管理规范的通知 (国中医药发〔2009〕3号) [EB]. 中华人民共和国卫生部公报, 2009(6): 29-31.
[13] 张明惠, 朱田田, 晋玲, 等. 基于HPLC多指标成分测定及指纹图谱多模式识别的不同产地不同品种当归质量差异分析 [J]. 中草药, 2022, 53(19): 6187-6199.
[14] 杨燕, 于春强, 郭子娴, 等. 基于HPLC指纹图谱及多指标成分定量分析的不同产地当归质量特征研究 [J]. 中草药, 2021, 52(15): 4666-4674.
[15] 龚韬, 杨薇, 王夏, 等. 不同产地的当归中苯酞类成分的含量测定及聚类分析 [J]. 中国医药导报, 2022, 19(19): 20-24.
[16] 晋玲, 金尧, 张弦飞, 等. 不同产地当归药材中阿魏酸含量比较研究 [J]. 中兽医医药杂志, 2013, 32(2): 12-14.
[17] 柴烨, 郑立颖. 不同产地生地黄和熟地黄中毛蕊花糖苷含量的比较研究 [J]. 甘肃科学学报, 2015, 27(3): 37-40.
[18] 钟正灵, 张飞, 江玉华, 等. 阿魏酸对急性肝损伤的保护作用 [J]. 中国临床药理学与治疗学, 2018, 23(12): 1335-1339.
[19] Roghani M, Kalantari H, Khodayar M J,. Alleviation of liver dysfunction, oxidative stress and inflammation underlies the protective effect of ferulic acid in methotrexate-induced hepatotoxicity [J]., 2020, 14: 1933-1941.
[20] Li J A, Hua Y L, Ji P,. Effects of volatile oils ofon an acute inflammation rat model [J]., 2016, 54(9): 1881-1890.
[21] Li W, Qu X N, Han Y,. Ameliorative effects of 5-hydroxymethyl-2-furfural (5-HMF) fromon alcoholic liver oxidative injury in mice [J]., 2015, 16(2): 2446-2457.
[22] Zhao J, Liu T, Ma L,. Protective effect of acteoside on immunological liver injury induced by-lipopolysaccharide [J]., 2009, 75(14): 1463-1469.
[23] Morikawa T, Pan Y N, Ninomiya K,. Acylated phenylethanoid oligoglycosides with hepatoprotective activity from the desert plant[J]., 2010, 18(5): 1882-1890.
[24] 中国药典 [S]. 一部. 2020: 44, 129, 139, 162, 260.
[25] 樊启猛, 贺鹏, 李海英, 等. 经典名方物质基准研制的关键技术分析 [J]. 中国实验方剂学杂志, 2019, 25(15): 202-209.
Quantitative value transfer analysis of benchmark sample of classical prescription Yiguan Decoction based on fingerprint chromatogram and four indicator components
HU Yu-ying1, 2, LI Shu-ping1, ABDULA Rahima1, AISA Hajiakber1, WU Tao1
1. State Key Laboratory of Xinjiang Indigenous Medicinal Plants Resource Utilization, Xinjiang Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Urumqi 830011, China 2. University of Chinese Academy of Sciences, Beijing 100049, China
To establish the HPLC fingerprints of the benchmark samples of Yiguan Decoction (YD, 一贯煎), determine the contents of its index components (5-hydroxymethylfurfural, ferulic acid, senkyunolide I and verbascoside), and study the transfer pattern of YD benchmark samples, so as to lay the foundation for the development of compound formulations.Fifteen batches of YD benchmark samples were prepared, then their HPLC fingerprints were established and their characteristic peaks were identified and assigned. The contents of the index components in the YD benchmark samples were determined, and the transfer pattern of the indicator components from the decoction pieces to the benchmark samples was analyzed.The similarity of the fingerprints of the 15 batches of YD benchmark samples was greater than 0.800, and 29 common peaks were calibrated and the medicinal materials of each common peak were assigned. Among these peaks, peak 1 was the common peak of Beishashen (, GR), Maidong (, OR), Danggui (, ASR), Dihuang (, RR) and Gouqizi (, LF); Peak 2 was the common peak of GR, OR, ASR, RR, LF and Chuanlianzi (, TF); Peak 3 was the common peak of GR, ASR, RR and LF, peaks of 4 and 13 were the common peaks of RR and LF, peak 5 was the common peak of GR, LF and TF, peak 6 was the common peak of RR and TF, and peaks of 7, 8, 10, 17 and 24 were common peaks of ASR and LF, peaks of 11 and 20 were common peaks of ASR and RR, peak 12 was common peak of ASR, LF and TF, peak 15 was common peak of LF and TF, peak 18 was common peak of GR and LF, peak 19 was common peak of OR, ASR, LF and TF, and peak 29 was common peak of ASR, RR, LF and TF, peaks of 14, 22, 25—28 were exclusive to ASR, peak 23 was exclusive to RR, and peaks of 9, 16 and 21 were exclusive to LF. The mass fractions of 5-hydroxymethylfurfural, senkyunolide I, ferulic acid, and verbascoside ranged from 90.3 to 144.1 μg/g, 75.6 to 166.2 μg/g, 105.4 to 200.3 μg/g, 149.9 to 293.3 μg/g, respectively. The transfer rates ranged from 15.53% to 27.11%, 38.36% to 62.68%, 16.23% to 31.37%, 31.41% to 55.65%, respectively. The dry extract yield of the benchmark samples was in the range from 42.95% to 49.93%, and the transmission rate was in the range from 84.39% to 96.15%.The combination of fingerprinting, dry extract yield and determination of the content of the indicator components was used to analyze the quantitative transfer process of the benchmark samples of the classical formula YD, which can initially formulate the quality standard of the benchmark samples of YD and provide reference for its future development of new drugs.
classical prescription; Yiguan Decoction; benchmark sample; quantitative transfer; HPLC; fingerprints; 5-hydroxymethylfurfural; ferulic acid; senkyunolide I; verbascoside;;;;;;;transmission rate
R283.6
A
0253 - 2670(2023)18 - 5880 - 12
10.7501/j.issn.0253-2670.2023.18.006
2023-03-21
国家重点研发计划项目(2020YFE0205600);中国科学院青年创新促进会优秀会员项目(Y202086);中国科学院青年创新促进会会员项目(2022442);王宽诚教育基金会资助项目
胡钰荧,硕士研究生,从事中药质量控制研究。E-mail: huyuying20@mails.ucas.ac.cn
吴 涛,研究员,博士生导师,从事中药民族药新药研发。E-mail: wutao@ms.xjb.ac.cn
[责任编辑 郑礼胜]

