乙醛脱氢酶2 改善急性肺损伤小鼠的肺内皮屏障及维持线粒体动力学平衡
王丽娅,田美惠,李蓉,吴越,王莎莎,吕恒,刘忠义,于影
蚌埠医学院1生理学教研室,2心脑血管疾病基础与临床重点实验室,3流行病与卫生统计学教研室,安徽 蚌埠233000
急性肺损伤(ALI)具有高发病率、高死亡率的特点,是重症监护室中常见的一种危及生命的疾病,目前仍未见针对ALI的有效治疗药物[1]。内皮屏障功能障碍在ALI的发展中起重要作用[2],线粒体功能异常与内皮屏障功能障碍密切相关[3]。生理状态下,线粒体处于分裂与融合的动态平衡中,维持内环境稳态[4]。ALI时由于线粒体动力学失衡,线粒体过度分裂,活性氧(ROS)过量产生,从而导致内皮屏障通透性增加,加重肺组织损伤[5]。抑制氧化应激可以增加紧密连接蛋白如闭锁小带蛋白1(ZO-1)和闭合蛋白Occludin的表达,维持内皮屏障的稳定性,减轻脂多糖(LPS)诱导的肺损伤[6]。
核因子E2相关因子2(Nrf2)是氧化应激重要的转录因子,生理条件下Nrf2与细胞核中的抗氧化反应元件结合,诱导抗氧化防御基因血红素加氧酶1(HO-1)的表达,维持氧化还原平衡[7]。激活Nrf2/HO-1途径,可以抑制Drp1介导的线粒体分裂,发挥肺组织保护作用[5]。线粒体乙醛脱氢酶2(ALDH2)是位于线粒体基质内重要的醛类氧化酶,催化乙醛氧化为乙酸[8],被证实在多种器官中具有保护效应[9-12]。已有研究发现,ALDH2可以通过激活Nrf2/HO-1抗氧化途径,抑制ROS过度生成,从而缓解肝脏损伤[13]。课题组前期研究发现,LPS引起的脑微血管内皮细胞屏障损伤,与线粒体融合减少和分裂增多以及氧化应激水平增加有关,激动ALDH2可以有效改善上述病理变化[14]。但ALDH2是否能够通过激活Nrf2/HO-1信号通路,维持线粒体动力学平衡,抑制氧化应激,减轻ALI小鼠肺内皮屏障的破坏?目前尚无相关研究报道。故本实验通过建立LPS诱导的ALI小鼠模型,观察ALDH2对小鼠肺内皮屏障的作用,并进一步探究Nrf2/HO-1信号通路以及线粒体动力学在其中的调控机制,以期为临床诊治提供理论依据。
1 材料和方法
1.1 材料
雄性C57BL/6J小鼠,6~8周龄,体质量20~25 g,购自河南斯克贝斯生物公司(许可证号:SCXK2020-0005)。动物实验操作严格按照蚌埠医学院伦理要求进行(动物伦理审批号:[2020]第099号)。丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)测定试剂盒(南京建成生物工程研究所有限公司);4-羟基壬烯醛(4-HNE)Elisa试剂盒(卡尔文公司);伊文思蓝(EB)、核蛋白提取试剂盒(索莱宝科技公司);电镜固定液(赛维尔生物科技有限公司);4%多聚甲醛、RIPA强效裂解液(Biosharp);PMSF、BCA蛋白试剂盒、5×蛋白上样缓冲液(碧云天);PAGE凝胶试剂盒(雅酶生物公司);PVDF膜、Immobilon Western(Millipore);脱脂奶粉(Biofroxx);ALDH2、ZO-1、Occludin、OPA1、Drp1一抗(Abcam);Mfn2、Fis1、Nrf2、HO-1、β-actin一抗及辣根过氧化物酶标记的羊抗兔二抗(Biosharp);LPS(Sigma);ALDH2激动剂Alda-1、ALDH2抑制剂Daidzin(MCE)。
1.2 方法
1.2.1 动物模型建立和分组 雄性C57BL/6J小鼠在25~27 ℃、相对湿度60%~70%的条件下饲养,待小鼠适应1周后。将小鼠随机分为Sham组、LPS组、LPS+Alda-1组、LPS+Daidzin组。Sham组小鼠腹腔内注射等量的生理盐水;LPS组小鼠腹腔注射10 mg/kg 的LPS建立小鼠ALI模型[15];LPS+Alda-1组小鼠提前1 h腹腔注射20 mg/kg的Alda-1,然后注射10 mg/kg的LPS[16];LPS+Daidzin组小鼠提前1 h腹腔注射10 mg/kg的Daidzin,然后注射10 mg/kg的LPS[17]。注射12 h后,采用1%的戊巴比妥钠麻醉处理小鼠。
1.2.2 HE染色观察肺组织结构 按前述方法分组和处理,小鼠深度麻醉后迅速取出肺组织,用4%的多聚甲醛溶液固定,常规石蜡包埋、切片,HE染色观察肺组织的形态。在显微镜下观察各组肺组织病理学改变,并统一条件下拍照记录。对以下4项内容进行评分:(1)肺泡结构破坏,肺泡腔大小不等(融合或塌陷);(2)肺泡和肺间质炎性细胞(中性粒细胞)聚集或浸润;(3)肺泡及肺间质出血;(4)肺水肿程度(肺泡间隔增厚)。肺损伤评分累积为0~4分。0分:没有损伤;1分:轻度损伤;2分:中度损伤;3分:重度损伤;4分:极重度损伤[18]。
1.2.3 透射电镜检查肺组织超微结构改变 分组和处理同上,切取一小块肺脏组织,2.5%的戊二醛固定过夜。次日PBS洗净肺组织,依次经过后固定(1%四氧化锇室温2 h)、清洗、脱水、环氧树脂包埋、超薄切片机切片。柠檬酸铅及醋酸双氧铀双染,透射电镜下观察拍片。
1.2.4 计算肺组织湿干质量比(W/D)造模12 h后,取肺部组织并精确测定质量,记为湿质量(W),再将肺组织置于95 ℃的烘箱中烘干72 h后测定质量,为干质量(D),计算肺组织的W/D以确定水肿程度。
1.2.5 肺微血管通透性检测 造模12 h后腹腔注射2%的EB 染液(4 mL/kg),观察眼球结膜、耳朵及四肢变蓝。2 h后麻醉小鼠,用生理盐水从小鼠心脏处灌注,取肺、吸干多余水分、称重。每100 mg肺组织加入1 mL甲酰胺进行匀浆,45 ℃避光孵育48 h,置于离心机内(8000 r/min)离心7 min收集上清液,于620 nm波长下测定,按标准曲线计算EB渗漏量。
1.2.6 ELISA检测小鼠血清4-HNE的水平 造模12 h
后麻醉小鼠,取小鼠外周血,置于离心机内(3000 r/min)离心15 min收集上清液,然后参照4-HNE检测试剂盒的说明书,检测4-HNE的表达水平。酶标仪在450 nm波长下检测各孔的吸光度值,绘制标准曲线,计算各组4-HNE的含量。
1.2.7 试剂盒检测小鼠血清MDA含量和SOD、CAT活性 取小鼠外周血上清液,按照各试剂盒的操作说明进行操作,酶标仪在450 nm波长下检测各孔的吸光度值,计算各组血清MDA含量及SOD、CAT活性。
1.2.8 Western blot法检测各蛋白表达 依据100 mg肺组织加入1 mL裂解液(配置比例RIPA∶PMSF=100∶1),匀浆后放于冰上裂解1 h,期间不停震荡,设置离心机参数12 000 r/min,4 ℃离心15 min,留取上清即总蛋白;核蛋白按照核蛋白提取说明书进行提取。BCA法测定蛋白浓度。配置SDS-PAGE凝胶,并按试剂盒说明书进行电泳分离组织中的蛋白,湿转法将蛋白转移至PVDF膜上,5%的脱脂奶粉进行抗体封闭,随后将PVDF膜分别与ALDH2(1∶1000)、ZO-1(1∶1000)、Occludin(1∶1000)、OPA1(1∶1000)、Mfn2(1∶8000)、Drp1(1∶1000)、Fis1(1∶2000)、Nrf2(1∶3000)、HO-1(1∶3000)、β-actin(1∶1000)一抗4 ℃孵育过夜,洗膜后室温孵育HRP标记的山羊抗兔IgG抗体(1∶10 000)2 h。洗膜后,ECL发光检测并用ImageJ软件对灰度值进行分析计算。
1.3 统计学分析
利用GraphPad Prism 8.0进行统计学分析,所有数据以均数±标准差表示。多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 ALDH2减轻ALI模型小鼠肺组织损伤
Sham组小鼠肺泡结构基本正常,无明显肺水肿;LPS组可见肺泡腔大小不一,肺泡腔内可见大量粉红色渗出液,肺泡间隔明显增厚,肺间质有明显的水肿、出血,其损伤评分高于Sham组(11.00±0.82vs1.75±0.50,P<0.01),且LPS+Daidzin 组较Sham 组损伤更为明显(12.75±0.96vs1.75±0.50,P<0.01);而LPS+Alda-1组可改善LPS诱导的肺组织损伤,肺水肿减轻,炎症反应减弱,其损伤评分较LPS 组明显降低(5.00±0.82vs11.00±0.82,P<0.01,图1)。
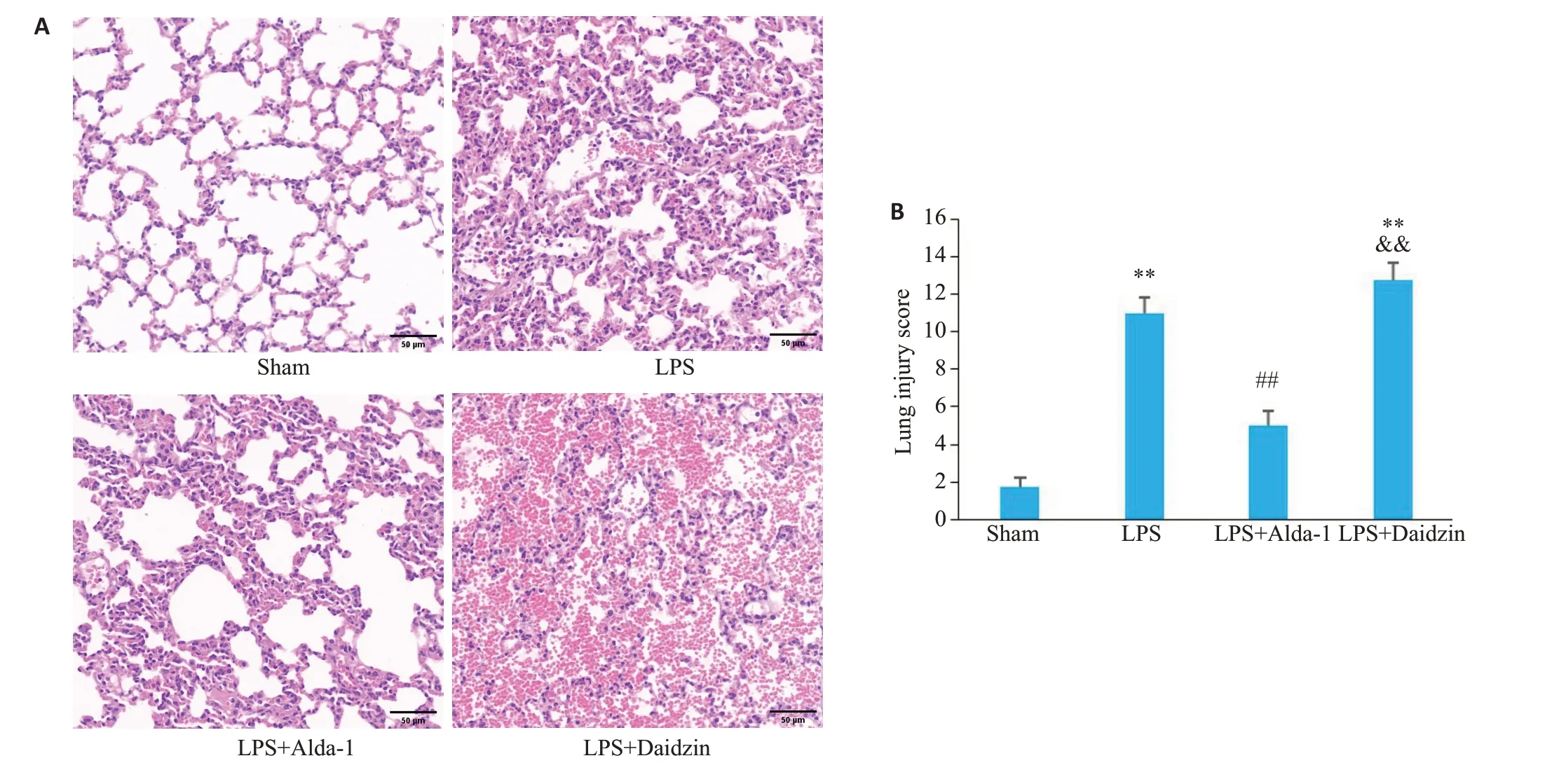
图1 各组小鼠肺组织病理学变化Fig. 1 Histopathological changes in the lungs of the mice in different groups.A:HE staining of the lung tissues(Original magnification:×200,scale bar=50 μm).B:Comparison of histopathological scores of the lungs among the 4 groups of mice(Mean±SD,n=4).**P<0.01 vs Sham,##P<0.01 vs LPS,&&P<0.01 vs LPS+Alda-1.
2.2 ALDH2减轻ALI模型小鼠肺内皮细胞紧密连接及线粒体结构损伤
Sham组小鼠肺内皮细胞完整,细胞之间的紧密连接稳定清晰,未见间隙;而LPS组和LPS+Daidzin组内皮细胞发生皱缩,细胞间紧密连接密度下降,存在明显间隙;LPS+Alda-1组细胞形态趋于正常,细胞间紧密连接较为完整(图2A)。观察各组线粒体超微结构,Sham组线粒体形态正常呈长梭形,基质致密,嵴发达。而LPS组和LPS+Daidzin组线粒体表现为肿胀形式、嵴减少或消失,其中LPS+Daidzin组最为明显;而给予Alda-1干预后减轻了LPS对线粒体超微结构的损伤,与Sham相比没有显著差异(图2B)。
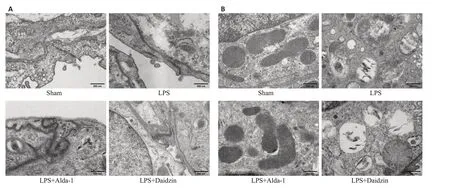
图2 透射电镜下观察各组小鼠超微结构改变Fig. 2 Ultrastructural changes of the lung tissues in each group observed under transmission electron microscopy(×20 000,scale bar=500 nm).A:Alteration of tight junction structure of lung endothelial cells in each group.B:Structural changes of the mitochondria in the 4 groups.
2.3 ALDH2降低ALI模型小鼠肺组织的W/D值
与Sham 组相比,LPS 组小鼠肺组织W/D 值增加(5.55±0.09vs4.89±0.12,P<0.01);与LPS组相比,LPS+Alda-1组可降低ALI小鼠肺组织W/D值(4.86±0.07vs5.55±0.09,P<0.01);而与LPS+Alda-1 组相比,LPS+Daidzin 组小鼠肺组织W/D 比值增加(5.84±0.06vs4.86±0.07,P<0.01,图3)。
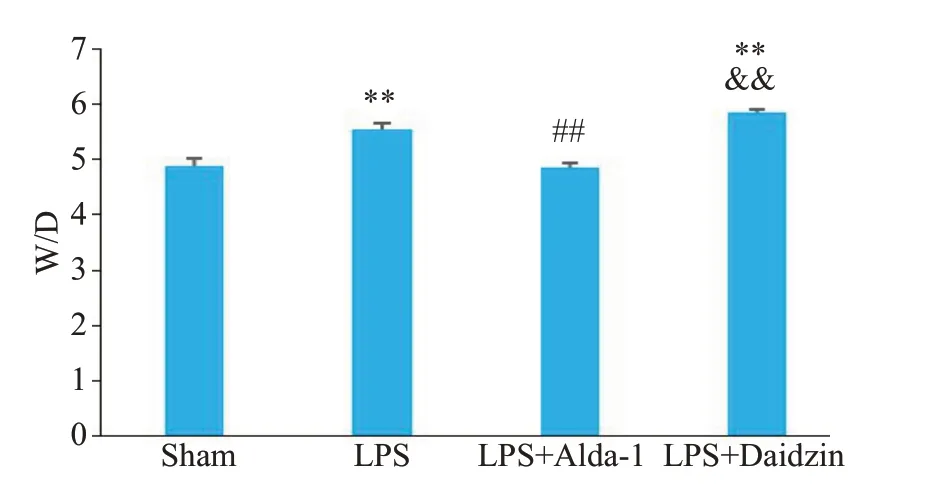
图3 各组小鼠肺组织W/D比较Fig. 3 Comparison of wet/dry mass ratio of the lung tissue among the 4 groups(Mean±SD,n=4).**P<0.01 vs Sham,##P<0.01 vs LPS,&&P<0.01 vs LPS+Alda-1.
2.4 ALDH2降低ALI模型小鼠肺组织EB含量
与Sham组相比,LPS组小鼠肺组织EB含量增加(12.47±0.82vs4.94±0.47,P<0.01);与LPS 组相比,LPS+Alda-1组可降低ALI小鼠肺组织EB含量(9.11±0.78vs12.47±0.82,P<0.01);与LPS+Alda-1 组相比,LPS+Daidzin组小鼠肺组织EB含量显著增加(14.19±0.31vs9.11±0.78,P<0.01,图4)。
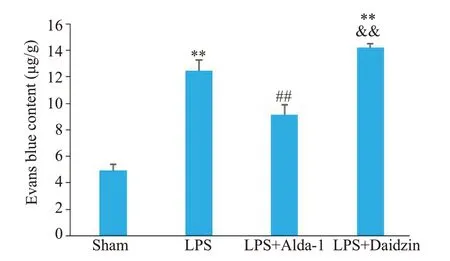
图4 各组小鼠肺组织EB含量比较Fig. 4 Comparison of Evans Blue content in the lung tissues among the 4 groups(Mean±SD,n=4).**P<0.01 vs Sham,##P<0.01 vs LPS,&&P<0.01 vs LPS+Alda-1.
2.5 ALDH2抑制ALI模型小鼠氧化应激反应
与Sham 组相比,LPS 组4-HNE(152.10±14.42vs81.90±16.09,P<0.01)和MDA(6.34±0.30vs3.90±0.40,P<0.01)含量升高,而SOD(49.00±3.58vs82.63±2.21,P<0.01)和CAT(12.23±0.55vs17.06±1.34,P<0.01)活性降低;与LPS 组相比,LPS+Alda-1 组中4-HNE(92.62±9.32vs152.10±14.42,P<0.01)和MDA(4.08±0.28vs6.34±0.30,P<0.01)含量降低,而SOD(73.88±3.88vs49.00±3.58,P<0.01)和CAT(14.94±0.37vs12.23±0.55,P<0.01)活性升高(图5)。与LPS+Alda-1组相比,LPS+Daidzin 组4-HNE(222.40±14.87vs92.62±9.32,P<0.01)和MDA(7.64±0.48vs4.08±0.28,P<0.01)含量增加,而SOD(45.13±3.33vs73.88±3.88,P<0.01)和CAT(10.52±0.68vs14.94±0.37,P<0.01)活性降低(图5)。
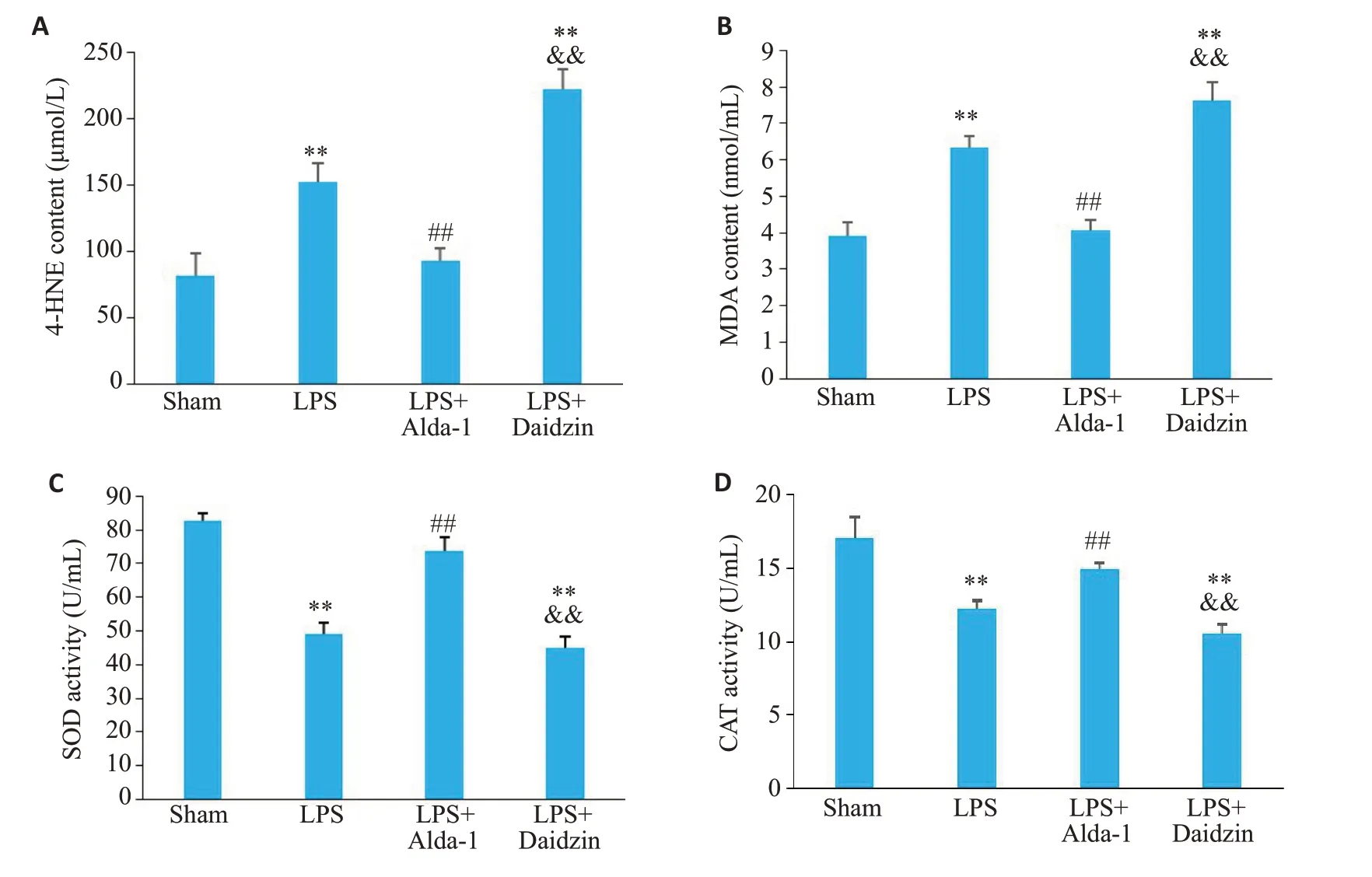
图5 各组小鼠氧化应激水平指标比较Fig. 5 Comparison of oxidative stress level indicators among the 4 groups. A: Content of 4-HNE. B:Content of MDA.C:Activity of SOD.D:Activity of CAT.Data are presented as Mean±SD(n=4).**P<0.01 vs Sham,##P<0.01 vs LPS,&&P<0.01 vs LPS+Alda-1.
2.6 ALDH2对ALI模型小鼠肺组织ALDH2和ZO-1、Occludin蛋白表达的影响
Western blot检测各组小鼠肺组织ALDH2、ZO-1、Occludin蛋白表达,结果显示,与Sham组相比,LPS组小鼠肺组织中ALDH2蛋白(0.73±0.06vs1.11±0.16,P<0.01)、ZO-1 蛋白(0.71±0.03vs1.29±0.15,P<0.01)、Occludin蛋白(0.58±0.03vs1.15±0.09,P<0.01)表达降低;与LPS组相比,LPS+Alda-1组上调ALI小鼠肺组织中ALDH2蛋白(1.06±0.16vs0.73±0.06,P<0.05)、ZO-1蛋白(0.97±0.06vs0.71±0.03,P<0.05)、Occludin蛋白(0.95±0.01vs0.58±0.03,P<0.01)的表达;与LPS+Alda-1组相比,LPS+Daidzin组的ALDH2蛋白(0.72±0.06vs1.06±0.16,P<0.01)、ZO-1 蛋白(0.50±0.12vs0.97±0.06,P<0.01)、Occludin 蛋白(0.37±0.18vs0.95±0.01,P<0.01)表达减少(图6)。
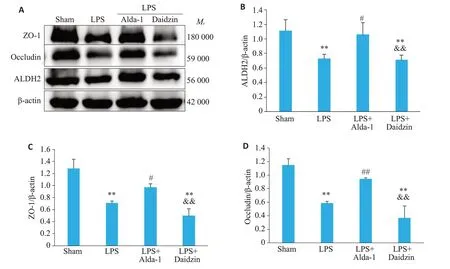
图6 各组小鼠肺组织ALDH2、ZO-1、Occludin蛋白水平比较Fig. 6 Comparison of ALDH2,ZO-1 and Occludin protein levels in the lung tissues among the 4 groups.A: Representative Western blots of ALDH2,ZO-1,Occludin in each group. B: Quantitative data of ALDH2.C:Quantitative data of ZO-1.D:Quantitative data of Occludin.Data are presented as Mean±SD(n=4).**P<0.01 vs Sham,#P<0.05,##P<0.01 vs LPS,&&P<0.01 vs LPS+Alda-1.
2.7 ALDH2促进ALI模型小鼠肺组织OPA1、Mfn2蛋白表达,降低Drp1和Fis1蛋白表达
Western blot结果显示,与Sham组相比,LPS组小鼠肺组织中OPA1 蛋白(0.61±0.02vs0.98±0.10,P<0.01)、Mfn2蛋白(0.40±0.01vs1.22±0.08,P<0.01)表达降低,Drp1 蛋白(1.12±0.20vs0.47±0.19,P<0.01)和Fis1蛋白(1.18±0.04vs0.97±0.05,P<0.01)表达增加;与LPS组相比,LPS+Alda-1组上调ALI小鼠肺组织中OPA1蛋白(0.87±0.08vs0.61±0.02,P<0.01)、Mfn2蛋白(0.54±0.04vs0.40±0.01,P<0.05),下调Drp1 蛋白(0.67±0.02vs1.12±0.20,P<0.01)和Fis1 蛋白(0.93±0.08vs1.18±0.04,P<0.01)表达;与LPS+Alda-1 组相比,LPS+Daidzin 组OPA1 蛋白(0.58±0.11vs0.87±0.08,P<0.01)、Mfn2蛋白(0.21±0.06vs0.54±0.04,P<0.01)表达减少,Drp1蛋白(1.02±0.11vs0.67±0.02,P<0.05)和Fis1蛋白(1.21±0.08vs0.93±0.08,P<0.01)表达增加(图7)。
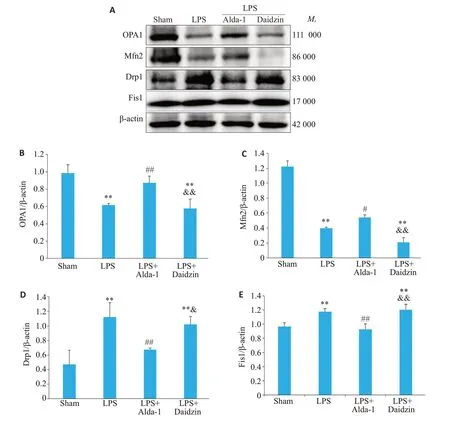
图7 各组小鼠肺组织OPA1、Mfn2、Drp1、Fis1蛋白水平比较Fig. 7 Comparison of OPA1,Mfn2,Drp1 and Fis1 protein levels in lung tissues of various groups of mice.A:Representative Western blots of OPA1,Mfn2,Drp1,and Fis1 in each group.B:Quantitative data of OPA1.C:Quantitative data of Mfn2.D:Quantitative data of Drp1.E:Quantitative data of Fis1.Data are presented as Mean±SD(n=4).**P<0.01 vs Sham,#P<0.05,##P<0.01 vs LPS,&P<0.05,&&P<0.01 vs LPS+Alda-1.
2.8 ALDH2 上调ALI 模型小鼠肺组织Nrf2 核蛋白、HO-1蛋白表达
Western blot法检测各组小鼠肺组织中Nrf2核蛋白和HO-1蛋白的表达。结果显示,与Sham组相比,LPS组小鼠肺组织中Nrf2核蛋白(0.84±0.09vs0.58±0.14,P<0.01)、HO-1蛋白(0.74±0.03vs0.41±0.12,P<0.01)的表达增加;与LPS组相比,LPS+Alda-1组上调ALI 小鼠肺组织中Nrf2 核蛋白(1.04±0.04vs0.84±0.09,P<0.05)、HO-1蛋白(1.00±0.13vs0.74±0.03,P<0.05)的表达;与LPS+Alda-1 组相比,LPS+Daidzin组的Nrf2核蛋白(0.71±0.05vs1.04±0.04,P<0.01)、HO-1蛋白(0.73±0.11vs1.00±0.13,P<0.05)的表达减少(图8)。
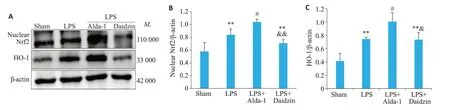
图8 各组小鼠肺组织nuclear Nrf2、HO-1蛋白水平比较Fig. 8 Comparison of nuclear Nrf2 and HO-1 protein levels in the lung tissues among the 4 groups.A: Representative Western blots of nuclear Nrf2 and HO-1 in each group. B: Quantitative data of nuclear Nrf2. C: Quantitative data of HO-1.Data are presented as Mean±SD(n=4).**P<0.01 vs Sham,#P<0.05,##P<0.01 vs LPS,&P<0.05,&&P<0.01 vs LPS+Alda-1.
3 讨论
肺内皮屏障功能障碍是导致ALI高死亡率的主要原因[19],而内皮屏障功能障碍与线粒体动力学失衡、氧化应激和紧密连接的破坏直接相关[20]。革兰氏阴性菌感染是ALI最重要的病因之一,LPS是革兰氏阴性菌细胞壁的主要成分,已被广泛用于诱导ALI[21,22]。本研究采用LPS诱导小鼠ALI模型,首次证实ALDH2通过维持线粒体动力学平衡,抑制氧化应激,减轻ALI小鼠肺内皮屏障功能障碍,其作用机制可能与激活Nrf2/HO-1信号通路有关。
线粒体是内皮细胞中至关重要的细胞器,是细胞的主要能量来源,当细胞受到环境或代谢压力时,线粒体将开始进行循环地分裂和融合,以最大程度地保持其功能并维持内环境稳态[4]。线粒体的稳态和动态平衡是其功能完整性的先决条件,一旦动态平衡受损,将会触发代谢和能量紊乱,导致细胞死亡和组织损伤[3]。先前的研究发现,LPS可以诱导线粒体分裂蛋白Drp1表达增加,导致肺内皮屏障破坏,通透性增加,加重组织损伤[5]。若体内缺乏线粒体融合蛋白Mfn2,会导致线粒体融合减少、分裂增加,从而引起内皮细胞功能障碍,血管渗漏增加[23]。本研究电镜结果显示,LPS诱导的ALI小鼠线粒体肿胀、嵴减少或消失,线粒体分裂增多,我们进一步检测了线粒体分裂与融合相关蛋白的变化,发现线粒体分裂蛋白Drp1和Fis1表达增加,而融合蛋白Mfn2和OPA1表达减少。此外,本研究还观察到ALI小鼠肺组织湿干重比、EB渗透均增高,肺内皮细胞紧密连接结构受到破坏,紧密连接蛋白ZO-1和Occludin表达降低。
作为一种重要的醛类氧化酶,ALDH2的抗氧化功能引起了许多研究者的关注[9,24]。ALDH2可以通过分解4-HNE和MDA等毒性醛类物质,抑制ROS的生成,发挥间接抗氧化的作用[10]。ALDH2还被证明通过调控线粒体分裂和融合,抑制氧化应激水平,从而减轻心肌缺血再灌注损伤[25]。本实验观察到激活ALDH2可以提高线粒体结构的完整性,降低氧化应激指标4-HNE和MDA的含量,提高SOD、CAT的活性。这说明ALDH2可能通过减轻ALI小鼠线粒体损伤,调控氧化应激水平。接下来本研究观察了ALDH2对线粒体分裂与融合相关蛋白的调控及对肺内皮屏障功能的影响,结果显示:激活ALDH2不仅抑制线粒体分裂蛋白Drp1和Fis1的表达、促进线粒体融合蛋白Mfn2和OPA1的表达,还可以降低LPS诱导的ALI小鼠的肺组织水肿和内皮屏障的通透性,促进紧密连接蛋白ZO-1和Occludin的表达,维持紧密连接结构的完整性。这些结果表明,激活ALDH2可以通过维持线粒体的动力学平衡,抑制氧化应激,在ALI时发挥肺内皮屏障的保护作用。
为进一步分析ALDH2改善ALI小鼠的肺内皮屏障功能与调控线粒体动力学平衡之间的关系,本研究还观察了抗氧化通路Nrf2/HO-1的表达。既往研究显示,Nrf2相关信号通路在抑制氧化应激诱导的组织损伤中发挥着不可替代的作用,被证明可以保护细胞免受氧化损伤[26]。同时,Nrf2也是线粒体动力学平衡的重要调节因子,一旦Nrf2被激活,它可以转移到细胞核中,并转录激活大量负责线粒体融合和分裂的抗氧化基因如HO-1,以维持线粒体功能[27]。而ALDH2作为Nrf2通路的激活剂,在各种疾病的细胞保护和抗凋亡作用中起着关键作用,这些保护作用与减轻炎症反应、氧化应激有关[9,28]。ALDH2还通过激活Nrf2/HO-1抗氧化途径,抑制了ROS的过度生成和线粒体损伤,对肝脏起到保护作用[13]。因此,我们研究了ALDH2是否通过激活Nrf2/HO-1信号通路来减轻LPS诱导的ALI小鼠的损伤。结果表明,激活ALDH2后,小鼠肺组织中Nrf2核蛋白和HO-1 蛋白表达明显增加。而使用ALDH2 抑制剂Daidzin干预后,Nrf2核蛋白和HO-1蛋白的表达降低,线粒体分裂增多,融合减少,氧化应激水平增加,加剧了肺内皮屏障的损伤。我们推测ALDH2 可能以Nrf2/HO-1途径依赖的方式发挥作用,但其确切机制仍有待进一步阐明。
综上所述,本研究揭示了ALDH2通过Nrf2/HO-1途径维持线粒体动力学平衡,抑制氧化应激损伤,从而减轻LPS诱导的ALI小鼠的内皮屏障功能障碍。

