VDAC1 通过诱导气道上皮细胞铁死亡参与屋尘螨诱导的哮喘小鼠气道炎症
黄奕,林丽珊,黄浩华,董航明
南方医科大学南方医院呼吸与危重症医学科,广东 广州510515
支气管哮喘是一种以慢性气道炎症和气道高反应性(AHR)为特征的炎症性疾病,表现为反复发作的喘息、呼吸困难、咳嗽或胸闷。目前认为其发病机制由遗传、环境。人体免疫等多个方面相关,在临床上哮喘分为多种表型[1],而在哮喘的所有表型中,都会出现了上皮损伤这一病理特征[2]。提示气道上皮与哮喘密切相关,深入探讨气道上皮对哮喘的发生发展具有重要意义。
线粒体是细胞内重要的细胞器,是细胞多种代谢反应的中心,在细胞稳态、代谢、先天免疫、细胞凋亡等方面发挥着至关重要的作用。因此线粒体损伤可影响细胞代谢和能量产生,进而引起一系列代谢紊乱和炎症反应[3]。目前认为线粒体功能障碍与肺部疾病的发病机制相关,如慢性阻塞性肺疾病(COPD)和特发性肺纤维化(IPF)[4-6],可造成增殖、凋亡、氧化应激反应、Ca2+稳态破坏和活性氧(ROS)产生增加等影响。不同气道细胞群中的线粒体功能障碍,包括肺泡上皮细胞、成纤维细胞和免疫细胞等,例如刺激上皮细胞衍生的细胞因子导致肌成纤维细胞的激活,从而促进成纤维过程[7],但线粒体与哮喘的相关研究较少。为了更好地了解线粒体在哮喘中的作用并开发新的治疗策略,有必要进一步的进行研究。
电压依赖性阴离子选择性通道蛋白1(VDAC1)是是锚定线粒体外膜上的多功能蛋白,它可以调控线粒体与细胞其他组分之间的物质代谢,维持细胞的生理功能;而在调节能量产生、线粒体氧化酶应激、Ca2+运输、物质代谢等方面,VDAC1同样参与其中[8]。当细胞受到外界刺激时,VDAC1还可通过与Bax结合,参与细胞凋亡的调节[9];因此VDAC1与线粒体功能息息相关,但近年来,有研究指出,在香烟烟雾、空气污染、炎症因素、缺氧等因素刺激下,VDAC1可发生寡聚化释放损伤相关分子模式从而引起炎症反应,参与慢性炎症疾病的发生发展[10-12],而哮喘作为全身性的慢性炎症疾病,我们认为VDAC1参与了哮喘气道炎症的发生。
铁死亡是一种程序性的细胞死亡形式,本质是铁依赖的脂质过氧化过程,与神经退行性变、缺血再灌注、癌症等疾病有关[13-15]。在正常情况下,胱氨酸的正常运输保护细胞免受脂质过氧化和抑制铁死亡[16]。在不同疾病模型的铁死亡过程中都可以观测到线粒体功能受损,活性氧(ROS)增多、膜电位(MMP)改变、脂质过氧化加剧和线粒体内铁的积累都证明了这一点[17,18]。然而,对于目前铁死亡与线粒体之间的调控作用与关系尚不明确[19]。本研究旨在探讨HDM诱导的气道上皮细胞细胞是否通过调控VDAC1引起线粒体功能障碍从而引起铁死亡,以进一步揭示哮喘的发生机制并为哮喘的精准治疗提供新的治疗靶点。
1 材料和方法
1.1 材料
人气道上皮细胞株(HBE细胞,ATCC);角质细胞培养基(KM培养基,ScienCell);胎牛血清(GIBCO);屋尘螨制剂(HDM,ALK-Abello);VBIT-4(Selleckchem);线粒体红色荧光探针(Mito-Tracker Red),Hoechst 33342活细胞染色液(碧云天);苏木素染液,伊红染液,瑞氏-姬萨姆复合染液(索莱宝);免疫组化兔二步法检测试剂盒(中国北京中杉金桥生物技术有限公司);兔抗VDAC1 单克隆抗体,鼠抗β-acitn 多克隆抗体(Proteintech);兔抗谷胱甘肽过氧化物酶4(GPX4)单克隆抗体(abcam),兔抗铁蛋白重链1(FTH1)多克隆抗体;驴抗兔红外二抗(Licor)。
1.2 方法
1.2.1 细胞培养 HBE 细胞使用KM 培养基进行培养。HDM浓度梯度刺激分组如下:对照组;200 U刺激组组:用HDM(800 U/mL)处理24 h;400 U刺激组:用HDM(800 U/mL)处理24 h;800U刺激组组:用HDM(800 U/mL)处理24 h。VBIT-4分组处理如下:对照组;HDM组:用HDM(800 U/mL)处理24 h;VBIT-4组:用VBIT-4(10 μmol/L)处理24 h;HDM+VBIT-4组:HDM(800 U/mL)与VBIT-4联合处理24 h;每天更换KM培养基。
1.2.2 细胞线粒体膜电位测定 将HBE细胞传代铺于小皿中,按照实验设计进行处理后加入200µL JC-1染色工作液(1∶200)在37 ℃敷箱避光孵育20 min,PBS清洗后使用荧光显微镜拍照观察。
1.2.3 线粒体ROS检测 将HBE细胞传代铺于小皿中,按照实验设计进行处理后加入200µL JC-1染色工作液(1∶1000,终浓度为5 μmol/L)在37 ℃敷箱避光孵育10 min,PBS清洗后使用荧光显微镜拍照观察。
1.2.4 Western blot 根据目的蛋白的相对分子质量配适合浓度(10%~15%)的SDS-PAGE胶,以80 V恒压进行电泳至溴酚蓝指示剂到达分离胶的底部(根据Maker位置),再以300 mA恒流进行转膜,转膜时间根据目的蛋白相对分子质量+30 min公式来计算,用5%的BSA溶液室温封闭1 h后,孵育对应的一抗稀释液8 h或过夜(兔抗VDAC1浓度为1∶1000,兔抗GPX4浓度1∶1000,兔抗FTH1浓度1∶1000,鼠抗ACTIN浓度为1∶1000),孵育相应种属的二抗(1∶10000)2 h,洗膜后通过Licor Odyssey显影仪进行显影分析。
1.2.5 哮喘模型构建 SPF级雄性C57BL/6小鼠32只,6~8 周龄,体质量20~24 g,饲养于南方医科大学公共卫生学院清洁级动物房,将小鼠随机分为4组,8只/组:对照组;VBIT-4组;HDM组;HDM+VBIT-4组。本实验经南方医院实验动物伦理委员会批准(NFYY-2021-1205)。
1.2.5.1 致敏阶段 HDM及HDM+VDAC1组每只小鼠在第0天和第7天通过腹腔腔注射100µL的HDM混合液(4000 U/只,HDM40 µL+PBS60 µL);对照组及VBIT-4组注射100µL的PBS磷酸缓冲液。
1.2.5.2 激发阶段 第8天在异氟烷吸入麻醉下,HDM处理组的小鼠每两天采用滴鼻给药方式给予10µL HDM混悬液(400 U/只,HDM4µL+PBS6µL),总共激发10 次。HDM+VBIT-4组激发前进行VBIT-4混合液滴鼻(5µg/10µL),最后1次激发后在24 h内处死小鼠进行收样。
1.2.6 肺泡灌洗液计数 将收集的肺泡灌洗液充分混匀,吸取10µL混悬液滴加到自动细胞计数板中,放入细胞计数仪内,调整相关参数,测得细胞总数后保存数据。
1.2.7 H&E染色 取小鼠肺脏组织,4%多聚甲醛固定24 h、石蜡包埋、连续切片,经脱蜡、水化后使用苏木素和伊红染色后封片。
1.2.8 瑞氏-姬萨姆染色 收集小鼠肺泡灌洗液,重悬后取适量灌洗液滴于载玻片上,固定后使用瑞氏-姬萨姆染液染色后封片,显微镜下观并采集数据。
1.2.9 免疫组织化学染色 取小鼠的肺脏组织,使用4%多聚甲醛固定24 h、石蜡包埋、连续切片,经脱蜡、水化后封闭,孵育一抗过夜(GPX-4),在37 ℃下二抗孵育1 h,DAB显色、改良苏木素复染,透明后封片。
1.3 统计学分析
应用SPSS22.0 统计软件对实验数据进行统计学分析,对于计量数据使用均数±标准差表示;均数满足方差齐性时,组间比较采用单向方差分析,组间多重比较采用Bonferroni 法或q检验;均数不满足方差齐性时,均数比较采用Welch法,组间多重比较采用Tamhane's T2检验比较,P<0.05 提示差异有统计学意义。所有实验都是独立重复3次。
2 结果
2.1 经HDM 诱导的HBE细胞的线粒体出现损伤
在HDM刺激下,与对照组相比,HBE细胞mtROS的生成增多(图1A),同时JC-1红光减弱,绿光增强,提示线粒体膜电位下降(图1B),免疫印迹实验结果显示在浓度梯度的HDM刺激下,与对照组相比,当HDM浓度到200 U/mL或400 U/mL的浓度时,VDAC1、GPX4和FTH1的蛋白表达水平变化均无统计学意义(图1C~E);当HDM 浓度达到800 U/mL时,VDAC1的蛋白表达水平显著上调(P=0.005)。同时铁死亡相关蛋白FTH1的表达也上调(P=0.030),而GPX4则出现表达下调(P=0.015)。
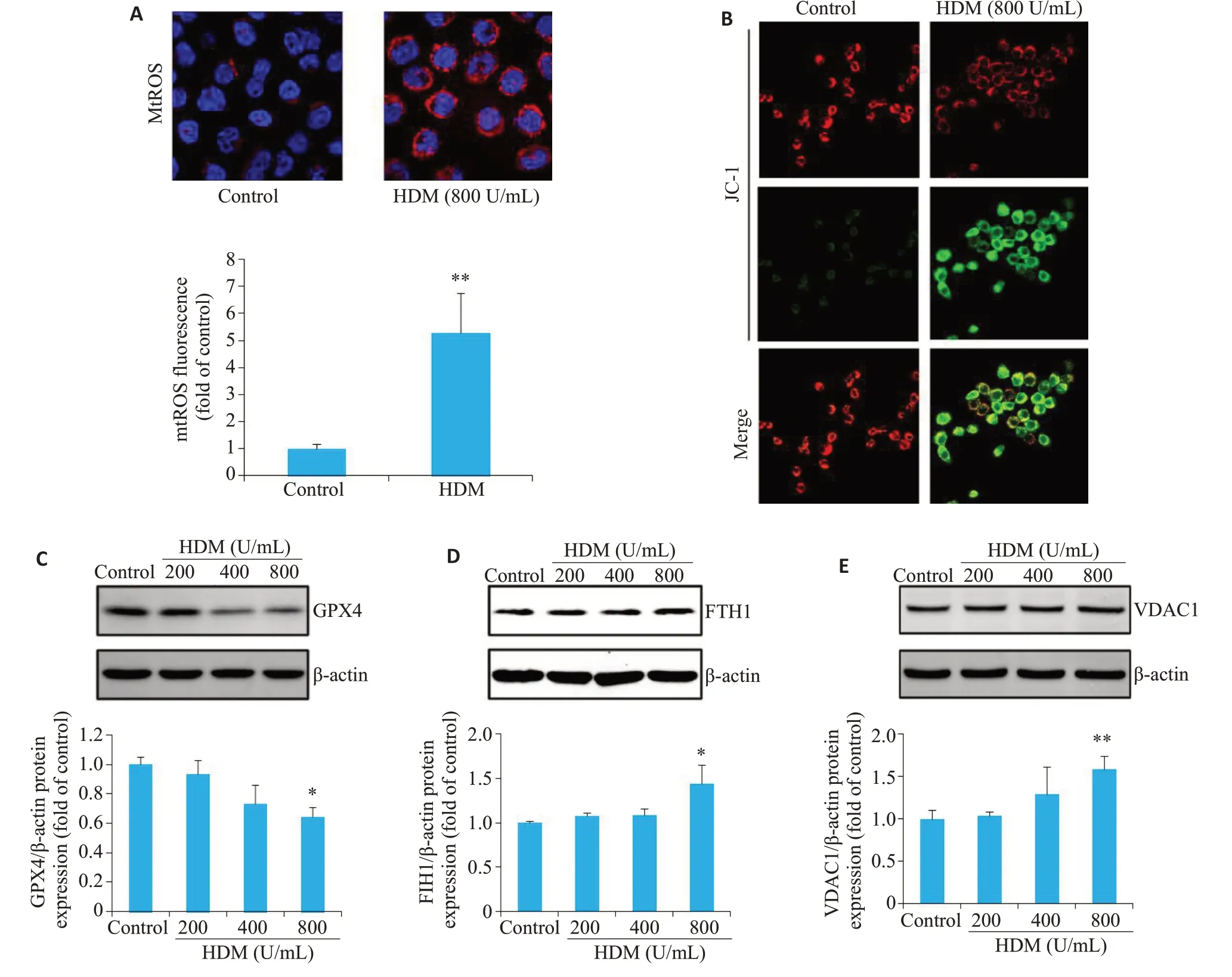
图1 HDM对HBE细胞线粒体功能与铁死亡相关蛋白表达水平的影响Fig. 1 Mitochondrial function and expression of ferroptosis-related proteins in human airway epithelial (HBE) cells exposed to house dust mite (HDM). A: Mitochondrial ROS (mtROS) production assessed by immunofluorescence assay (Original magnification: ×600)and quantitative analysis of fluorescence intensity in each group(n=3).**P<0.01 vs control group(n=3)B:Mitochondrial membrane potential was assessed by JC-1 staining(×400,n=3).C-E:Expression of GPX4,FTH1 and VDAC1 in the treated cells.*P<0.05,**P<0.05 vs control group(n=3).
2.2 使用VDAC1抑制剂VBIT-4可保护线粒体,抑制HBE细胞铁死亡的发生
HDM组的出现表达上调(图2),与HDM组相比,HDM+VBIT-4组中,VDAC1的表达显著下调(P=0.001,图2A),表明VDAC1被抑制,同时,FTH1的表达亦显著下调(P=0.037,图2B)而GPX4表达出现上调(P=0.029,图2C)。免疫荧光提示,在VBIT-4干预下,与HDM组相比mtROS的生成减少(图2D),提示线粒体功能得到改善。
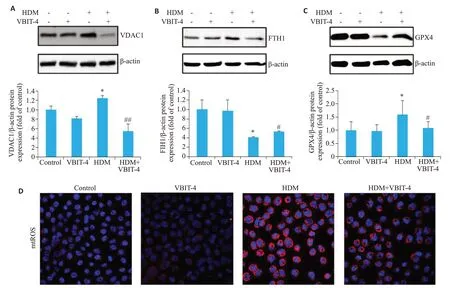
图2 使用VDAC1抑制剂VBIT-4可保护线粒体,抑制HBE细胞铁死亡的发生Fig. 2 VBIT-4 protects mitochondria and inhibits ferroptosis in HBE cells.A-C:Protein expressions of VDAC1,GPX4 and FTH1 in the treated cells.*P<0.05 vs Control group (n=3).#P<0.05 vs HDM group (n=3).##P<0.01 vs HDM group (n=3). D: mtROS assessed by immunofluorescence assay(×400)and quantitative analysis of the fluorescence intensity of each group(n=3).
2.3 在HDM诱导的哮喘小鼠模型中,VBIT-4抑制气道炎症水平
在哮喘小鼠模型中,免疫组织化学染色结果提示,相较于对照组组,HDM组的气道上皮细胞中GPX4的免疫组化染色明显变浅,而使用VBIT-4干预后,GPX4的免疫组化染色明显加深(图4A)。同时HE染色提示给予VBIT-4处理后,HDM诱导的小鼠模型炎症水平得到改善(图3B)而肺泡灌洗液细胞计数与瑞氏-姬萨姆染色结果显示,VBIT-4降低了肺泡灌洗液中细胞总数(P=0.0002)和嗜酸粒细胞的数量(P=0.001,图3C、D)。

图3 在HDM诱导的哮喘小鼠模型中,VBIT-4抑制气道炎症水平Fig. 3 VBIT-4 alleviates airway inflammation in mice with HDM-induced asthma.A:Immunohistochemical staining of GPX4 in mouse airway(×400).B:HE staining showing aggregation of inflammatory cells around the airway(×400).C:Total cell counts in the bronchoalveolar lavage fluid(BALF).*P<0.05 vs Control group(n=3).#P<0.05 vs HDM group(n=3).D:Eosinophil counts in the BALF.***P<0.001 vs Control group(n=3).##P<0.01 vs HDM group(n=3).
3 讨论
目前临床主要采用糖皮质激素或支气管扩张剂缓解哮喘患者的症状[20]。但传统的抗炎药物会引起很多不良反应,损害人体健康,且近年来越来越多的研究表明,糖皮质激素对不同哮喘表型的治疗效果不相同[21],对于激素抵抗型哮喘,糖皮质激素治疗并不能让患者获益。因此,我们需要进一步研究哮喘发生发展的分子机制,以开发最新的治疗方案。本研究从体内外两方面探讨了铁死亡在哮喘发病机制中的启动机制,以及可能的调控机制。
铁死亡是细胞中大量游离铁的积累导致脂质过度氧化,最终导致细胞死亡[22]的过程。谷胱甘肽(GSH)是细胞内主要的抗氧化剂,作为GPX4的还原底物发挥抗氧化作用,从而减少细胞中脂质过氧化物的积累。异胱氨酸谷氨酸转运受体主要作用是将胱氨酸导入细胞,还原为半胱氨酸合成GSH,从而保护细胞免受氧化损伤。当细胞胱氨酸运输受到抑制时,胞内GSH被耗尽,导致GPX4失活,诱发细胞死亡。虽然铁死亡调控机制复杂,目前仍不明确,但上游通路都是通过各种因素导致的GPX4活性下降,从而可诱导脂质过氧化物还原受阻,最终导致细胞发生铁死亡[23]。铁死亡参与了人类的生物过程和多种人类疾病,但是关于哮喘发生铁死亡的证据很少。此前有研究报道,铁死亡诱导剂(FINs)可诱导嗜酸性粒细胞铁死亡,GSH可抑制这种细胞死亡,提示铁死亡参与了气道炎症,抑制铁死亡可能缓解过敏性气道炎症[24]。同时有报道称重度或轻中度哮喘患者肺泡灌洗液中游离铁的水平降低,与肺功能降低相关[25]。所以,铁死亡是一种铁依赖的脂质过氧化的细胞死亡方式,与氧化应激高度相关,线粒体是ROS的主要来源,有研究表明与作用广泛的抗氧化剂相比,特异性靶向线粒体的抗氧化剂在保护细胞免受铁死亡方面更有效[26],使用铁死亡激活剂erastin刺激HT-22和MEF细胞也能观察到线粒体ROS 显著增加[27],这提示我们线粒体ROS参与铁死亡发生的过程。
在本研究中,我们发现线粒体膜电位降低,mtROS水平升高,这反映了细胞的氧化损伤[28]。在哮喘小鼠肺组织或HDM刺激的HBE细胞中,GPX-4的表达同样受到抑制,同时我们还发现主要负责铁储存的铁蛋白FTH1的表达也发生上调,有研究表明,当细胞内铁水平较低时,自噬体可与FTH1结合,并将自噬体转移到溶酶体中降解,释放游离铁离子[29],引起细胞铁离子增加,FTH1的上调表明铁离子的蓄积,为细胞铁死亡的启动做准备。
既往研究表明在肿瘤等[14]疾病中已发现线粒体损伤与铁死亡之间存在关联,但具体的调控机制仍不明,我们研究发现HDM刺激的HBE细胞同样存在这种关系,此外VDAC是锚定在线粒体外膜上的通道蛋白,可以转运线粒体与其他组分之间的离子和代谢产物,这提示了VDAC可能与铁死亡存在关联,VDAC在哺乳动物上有三种亚型:VDAC1、VDAC2 和VDAC3,其中VDAC1表达最广泛[8],既往研究指出erastin可能直接与VDAC结合导致VDAC的构象改变,引起线粒体损伤[30,31],同时有研究表明铁死亡诱导剂erastin可作用于VDAC2 和VDAC3,引起铁死亡,用siRNA 干 预VDAC2/3 表达能抑细胞铁死亡的发生,但是过表达VDAC2和VDAC3却并不能显著引起erastin诱导下的细胞发生铁死亡[32]。而我们研究首次发现,在HDM诱导的体内外模型中,VDAC1的表达都显著上调,炎症细胞浸润明显,肺泡灌洗液中的细胞总数增多,嗜酸粒细胞聚集,而VBIT-4的应用缓解了哮喘引起的上述变化,同时减少了mtROS的积累,恢复气道上皮细胞GPX4的表达,表明抑制VDAC1减轻了氧化损伤对哮喘起到保护作用。但VDAC1在细胞中充当线粒体“看门人”的作用,可调控线粒体与其他组分之间离子和代谢产物的跨膜交换[33,34],功能复杂,有报道指出,VDAC1有多个泛素化位点,不同泛素化方式可让VDAC1执行不同的功能[35-37],因此VDAC1是否直接发生构象改变造成线粒体功能障碍,导致铁死亡从而加重气道炎症反应仍需要进一步研究。
综上所述,本研究通过细胞及动物实验证了VDAC1参与HDM诱导的哮喘气道炎症,并可能通过调控线粒体功能及铁死亡发挥作用。VDAC1可能是哮喘新的靶点,以改善哮喘患者的预后结果。

