顺丁烯二酸二甲酯的合成动力学
苏强德,王红星
1.山东利兴新材料科技股份有限公司,山东 临沂 276000;2.天津科技大学化工与材料学院,天津 300457
顺丁烯二酸二甲酯(DMM)是无色透明的液体,能与多种有机溶剂互溶,可制成多种具有特殊性能的涂料、光学材料、增塑剂、杀虫剂、防锈添加剂等[1]。DMM 的合成以甲醇和顺酐为原料,反应分为两步,第一步在常温或高温下不需催化剂直接生成单甲酯;第二步需要催化剂,在酸催化下,顺丁烯二酸或顺丁烯二酸酐与甲醇反应合成DMM[2]。
合成DMM 常用的均相催化剂有浓硫酸[3]、盐酸和高氯酸等,酸的利用导致设备腐蚀、副反应多等缺点。因此,近年来研究者相继开发固体酸[4-7]、杂多酸[5-7]、沸石分子筛[7-9]、大孔磺酸树脂、颗粒状阳离子交换树脂等作为催化剂,取得了不错的效果,其中阳离子交换树脂是使用最广泛的酯化催化剂。霍稳周等[10]利用耐高温强酸性阳离子交换树脂DZH 催化合成DMM,结果发现,其底物转化率≥99.6%、产物收率≥98.6%。英国戴维公司的专利[3,11]中强调:在顺丁烯二酸烷基酯的制备过程中,应该用阳离子交换树脂作为催化剂,最好是含磺酸基或羧酸基的大孔离子交换树脂,推荐使用Amberlyst-13、Amberlyst-35或Dow C351。
Amberlyst-35 阳离子交换树脂是一种具有强酸性的醚化反应催化剂,它具有比表面积大、含水量高、交联度好、热稳定性好、耐渗透、力学性能好以及抗氧化性好等优点[12-13]。因此,本文在间歇反应釜中,以Amberlyst-35为催化剂,对顺酐和甲醇合成DMM的反应过程动力学进行初步研究,测定反应温度、催化剂用量、醇酯比对反应速率的影响,并通过实验分析及动力学模拟,建立拟均相动力学模型,得到反应速率方程式,并根据文献将Amberlyst-35 与其他同类型催化剂催化效果进行了对比,以期为催化精馏过程的模拟和放大提供基础数据。
1 实验
1.1 主要原料
顺丁烯二酸酐、乙酸乙酯(分析纯),国药集团化学试剂有限公司;甲醇、无水乙醇、NaOH、邻苯二甲酸氢钾(分析纯),天津市福晨化学试剂厂。
1.2 主要设备及仪器
SYC型超级恒温水槽、DW-3型数显恒速搅拌器、METTLER HE20电子天平,巩义市予华仪器有限公司;GC-2014型气相色谱仪,日本岛津公司。
1.3 实验装置与步骤
以阳离子交换树脂为催化剂,进行合成DMM反应动力学数据的测定,采用间歇全混恒温装置,其实验装置如图1所示。

图1 间歇式反应实验装置(催化剂散装)
具体实验步骤如下:准确称量顺丁烯二酸酐、甲醇和催化剂;启动恒温水浴预热,待水浴温度升至所需的反应温度时,将顺丁烯二酸酐和甲醇加入反应器,并启动搅拌器开始搅拌;当顺丁烯二酸酐全部溶解后,迅速加入已准确称取的催化剂;加入催化剂时开始计时,定时取样,用气相色谱仪和碱液滴定分析;当反应达到平衡后,停止实验。
1.4 分析方法
利用NaOH-乙酸乙酯溶液对顺丁烯二酸单甲酯进行定量分析。其余成分采用气相色谱仪进行样品分析,以N,N-二基酰胺为内标物,对反应物进行定量分析。气相色谱条件如下:色谱柱为RT-wax 毛细管柱(柱长30 m、内径0.25 mm、厚度0.25 μm),检测器ID,载气为N2,进样温度为220 ℃,检测器温度为250 ℃。程序升温:初始温度为55 ℃,保持1.00 min,然后以40.0 ℃/min 的速度升温至180 ℃,保持3.00 min,再升温至220 ℃,保持6.00 min。
各物质的色谱如图2所示。
图2 4种物质的气相色谱
在气相色谱中,对各物质浓度进行定量之前必须作出其校正曲线。内标曲线制作过程的具体要求如下:取不同质量的DMM 标准样品,加入不同质量的内标物,分别对其进行色谱分析,可算得被测组分与内标物含量,见式(1)~(2)。
各组分在被测样品中的含量计算见式(3)。
式中:mi为被测组分的质量,g;fi为被测组分校正因子;Ai为被测组分峰面积;mS为内标物质量,g;fS为内标物校正因子;AS为内标物峰面积;fi,S为被测组分与内标物校正因子的比值,fi,s=fi/fS;m为被测样品的质量,g。
基于此,将标样和内标物配成不同质量比的混合样品,进样分析后再求得各配比下标准样品和内标物的面积比,以面积比为横坐标、质量比为纵坐标可作出各物质和内标物的校正曲线。校正曲线的一般形式见式(4)。
式中:y、x分别为标样与内标物的质量比和面积比。
通过上述方法作出DMM 和甲醇的内标校正曲线,如图3所示。由图3(a)可知:DMM内标矫正曲线为y=1.002 6x+0.004 3,相关系数R2=0.999 8;由图3(b)可知:甲醇内标矫正曲线为y=1.038x+0.001,相关系数R2=0.999 5。

图3 内标物的校正曲线
2 结果与讨论
2.1 外扩散与内扩散的消除
多相催化反应是一个非常复杂的表面化学现象,根据Taylor 提出的活性中心的理论,酯化反应中存在着两种类型的传质阻力,一个是整个固液界面,另一个是催化剂粒子的孔道。针对间歇反应器中的液-固反应,研究通常采用增大搅拌转速、增大液体的线速度以减小催化剂外表面的液膜厚度,直至反应速率基本一致的方法来排除外扩散对反应的影响,而内扩散对反应的影响可通过催化剂颗粒尺寸来表征。
通过前期实验研究,本实验在保持反应温度为60 ℃、催化剂用量为129 g/L、醇酐摩尔比为4∶1不变的情况下,通过改变搅拌转速和催化剂粒径来考察外、内扩散对正丁醇转化率的影响,结果如图4所示。
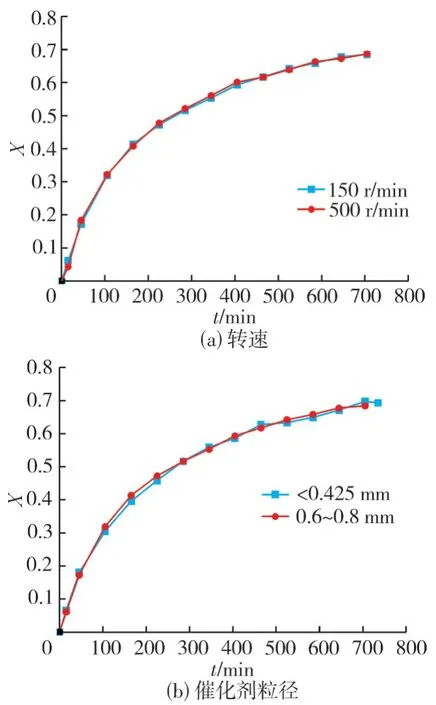
图4 转速和催化剂粒径对顺丁烯二酸单甲酯转化率的影响
由图4(a)可知:当搅拌速度从150 增至500 r/min时,转化率基本不变,说明此时液膜厚度已接近于零,催化剂外表面的反应物浓度近似等于液相主体的浓度,在这种情况下外扩散的影响可以忽略。由此推断,当搅拌速度为150~ 500 r/min时,外扩散对该酯化反应的速率没有影响。为了让反应物充分混合,使反应进行得更完全,故选转速为500 r/min。
由图4(b)可知:当催化剂颗粒粒径小于0.8 mm 时,对顺丁烯二酸单甲酯转化率的影响不大,说明催化剂粒径为0.6~0.8 mm 时,内扩散影响可以忽略。但是如果使用粒径更小的催化剂,会增加成本。
综上所述,当搅拌速度在500 r/min、催化剂粒径为0.6~0.8 mm时,可以消除外、内扩散对酯化反应过程的影响。
2.2 第二级反应过程分析及模型建立
当反应体系中的固体完全溶解后,反应进行到5 min 时,取微量反应液使用气相色谱仪(GC)测得顺酐的质量分数降至1%以下,而此时顺丁烯二酸单甲酯的浓度达到最大,表明第一步反应是快速反应,第二步反应进行缓慢,由此推测顺丁烯二酸单甲酯和甲醇合成DMM 的反应是整个反应的速率控制步骤。
因此,采用拟均相催化反应机制,分析顺丁烯二酸单甲酯和甲醇合成DMM的反应过程,其拟均相二级反应的动力学方程如式(5)所示。
式中:A、B、C、D 分别表示顺丁烯二酸单甲酯、甲醇、DMM 和水;CA、CB、CC和CD分别为相应物质在t时刻的浓度;k'+为正反应速率常数,L/(mol·min);k'-为逆反应速率常数,L/(mol·min)。对于该反应,其计量系数均为1 或-1,且反应产物的初始浓度为0,故有
将式(6)代入式(5),可得
式(7)积分后得
令
则
由此可得
式中:CA0为顺丁烯二酸单甲酯的初始浓度,mol/L;xA为顺丁烯二酸单甲酯的转化率;KE为化学平衡常数;Rm为甲醇和顺丁烯二酸单甲酯的摩尔比。Y为自定义变量,L/mol,是一个随反应时间t变化的自定义变量,通过式(9)定义,与反应体系中各组分的浓度有关。
定义Y的意义在于计算正反应速率常数k'+,即通过计算不同时间t下的Y值,可以得到Y与t之间的关系,当Y值与时间t呈线性关系时,其斜率即为正反应速率常数k'+。
2.3 反应温度对反应速率的影响
在反应搅拌速度为500 r/min、催化剂质量浓度为129 g/L、催化剂粒径为0.6~0.8 mm、醇酯比为4∶1 的反应条件下,考察反应温度(327.65、332.65、338.65、343.65 和346.65 K)对丁醇转化率的影响,结果如图5所示。由图5(a)可以看出:随着反应温度的降低,反应速率逐渐减小,达到平衡所需的时间则变长。
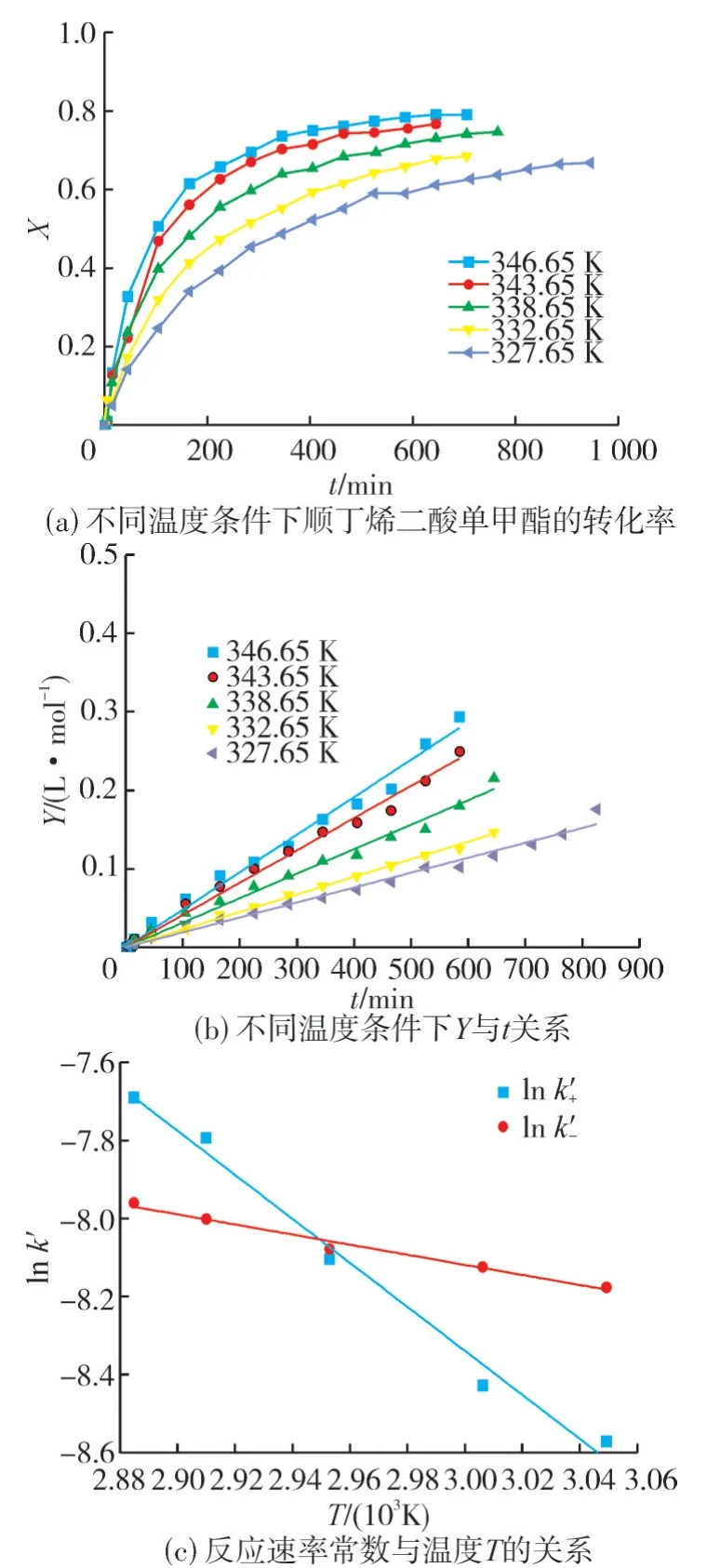
图5 温度对反应速率的影响
不同反应温度条件下,反应平衡常数和正反应速率常数见表1。由图5(a)和表1可知:随着反应温度的上升,平衡转化率随之升高,反应平衡常数也增大,说明该反应为吸热反应。

表1 不同反应温度条件下的反应平衡常数
按式(9)求得不同温度下各组数据的Y值,并以Y对t作图,结果如图5(b)所示。由图5(b)可知:各条曲线均过原点,直线的斜率为正反应速率常数k'+。
由KE=k'+/k'-可得k'-=k'+/KE,从而求出逆反应的反应速率常数。
根据阿伦尼乌斯公式(12),分别将lnk'+和lnk'-对1/T作图,结果如图5(c)所示。
由图5(c)可知:反应体系的温度对正反应的影响比对逆反应的影响更大。对实验数据拟合后,得到正、逆反应的活化能分别为46.91 和10.75 kJ/mol。
2.4 催化剂浓度对反应速率的影响
催化作用最基本的特点在于少量催化剂的存在就能导致反应速率很大变化(加速),但催化剂只能加速反应而不能改变平衡的状态。一般认为,催化剂质量浓度影响指前因子,从而影响反应速率常数。为了更合理地描述催化剂质量浓度对反应速率的影响,将指前因子与催化剂质量浓度之间的关系表达为式(13)。
在反应温度为60 ℃、转速为500 r/min、醇酯摩尔比为4∶1的反应条件下,考察催化剂质量浓度(214.96、171.02、128.59 和89.16 g/L)对反应速率的影响,结果如图6所示。

图6 催化剂浓度对反应速率的影响
由图6(a)可知,当反应温度保持为60 ℃、醇酯比为4∶1 时,随着催化剂质量浓度的增大,反应速率也随之加快。
由图6(b)可知:以催化剂质量浓度为横坐标,A+为纵坐标,拟合得到正反应指前因子与催化剂质量浓度之间的关系如式(14)所示。
由图6(c)可知:以催化剂质量浓度为横坐标,A-为纵坐标,拟合得到逆反应指前因子与催化剂浓度之间的关系如式(15)所示。
将正、逆反应活化能以及与催化剂质量浓度有关的方程式关联起来,获得与催化剂质量浓度有关的最终速率常数表达式。
正反应
逆反应
2.5 醇酯比对反应速率的影响
酯化反应是一种典型的可逆反应,反应物的浓度或摩尔比可能对其整个体系的反应速率有影响。本实验通过保持反应温度为60 ℃、转速为500 r/min、催化剂用量为128.59 g/L,考察醇酯摩尔比(2∶1~5∶1)对顺丁烯二酸单甲酯转化率的影响,结果见图7。

图7 醇酯比对顺丁烯二酸单甲酯转化率的影响
由图7 可知:顺丁烯二酸单甲酯的转化率随着醇酯比的增加而变大,平衡转化率也随之变大。这是因为当醇酯比增大时,反应物浓度也增大,则单位体积内反应物分子间相互碰撞的机会增多,因此,顺丁烯二酸单甲酯的转化率提高。
利用式(11)~(12)拟合可得平衡常数及正反应的反应速率常数,结果如表2 所示。由表2 可知:反应平衡常数和正反应速率常数基本不随醇酯摩尔比的变化而变化,这与理论解释相一致。

表2 不同醇酯摩尔比条件下的反应平衡常数
2.6 Amberlyst-35 与其他同类型催化剂催化效果的对比
国内外学者利用多种不同的催化剂合成顺丁烯二酸二乙酯。
Yadav 等[14]对Amberlyst-15、Amberlyst-36、Amberlyst-18、Amberlite IRA 400 以及Indion-170等催化剂进行了对比研究,结果发现:Indion-170的催化活性与Amberlyst-15 和Amberlyst-36 都很接近;后续又对Indion-170 催化合成顺丁烯二酸二乙酯进行了动力学研究,并建立了拟均相动力学模型,模型假设第一步反应是平衡反应,第二步反应是二级反应,由于乙醇过量很多,可假设这个反应是不可逆反应。
Induri 等[15]对H-Y 沸石分子筛催化合成DMM的动力学建立了拟均相模型、Langmuir-Hinshelwood 模型、Eley-Rideal 模型等多种动力学模型,并对各种模型的误差进行了比较,结果发现:拟均相模型能很好地描述H-Y 沸石分子筛上的催化反应,拟均相模型的建立方式与Yadav 等[14]建立的模型相同,并得出第二步反应的指前因子和活化能分别为5.16×107和44.65 kJ/mol,上述研究均假设第一步反应和第二步反应的转化率相等,但此假设不尽合理。
郝兴仁等[8]在DNW-Ⅰ型催化剂存在的条件下,对DMM 合成的反应宏观动力学进行了研究,结果发现:产物中双酯的含量随温度升高、空速减小而降低,研究只求出了反应的级数,没有给出反应速率常数。
王莹淑[9]对在SK-1A 型阳离子交换树脂的催化下合成DMM的反应进行了动力学研究,并建立了双曲线模型和拟均相模型,并用微粒群法对模型参数进行求解,并求得非均相反应模型的正反应速率常数,结果发现:反应过程受表面反应控制,但并未给出合适的逆反应相关的动力学数据。
潘姣[12]将Amberlyst-35 与其他类型催化剂进行了对比,结果发现:Amberlyst-35 酸性更强,含水量更高,有利于离子扩散,交联度更好。
根据本研究的结果,也能得出类似结论,与前人所用催化剂相比,Amberlyst-35 的催化性能更优异。
3 结论
在间歇反应釜中,以强酸性阳离子交换树脂Amberlyst-35 为催化剂,对顺酐和甲醇合成DMM的反应过程动力学进行了初步研究,测定催化剂用量、反应温度、醇酯比对反应速率的影响。通过实验分析及动力学模拟,得到了以下结论:
1)建立了拟均相动力学模型,确定该反应的第二步反应为二级可逆反应,其正、逆反应活化能分别为46.91和10.75 kJ/mol。
2)随着反应温度的升高,反应平衡常数增大,该酯化反应是一个吸热过程。
3)反应速率与催化剂用量呈线性关系。
4)该酯化反应与催化剂质量浓度相关联的动力学模型为-rA=-dCA/dt=k'+CACB-k'-CCCD,其中,正、逆反应速率常数分别为k'+=(1 447.78+28.12ρ催)exp(-46.91/RT)、k'-=(0.007 4+4ρ催)exp(-10.75/RT)。

