小麦抗性糊精制备工艺优化、结构表征及其体外消化
陈新阳,赵朋辉,刘莹莹,王静静,薛迎春,侯银臣,廖爱美,潘龙,黄继红,3*
(1.河南工业大学 生物工程学院河南省小麦生物加工与营养功能重点实验室,河南 郑州 450001;2.中原食品实验室,河南 漯河 462300;3.河南大学 农学院 作物逆境适应与改良国家重点实验室,河南 开封 475004)
抗性糊精是以食用淀粉为原料,经部分降解及糖基化转移形成的一种可溶性膳食纤维[1]。膳食纤维被誉为“人类第七大营养素”,根据其在水中的溶解性,可分为水溶性膳食纤维和水不溶性膳食纤维[2],高分子质量水溶性膳食纤维由于其黏度高、凝胶性强,在食品工业中的应用受到一定限制[3]。随着研究的深入,低黏性的抗性糊精引起了学者们的广泛关注,其具有高溶解度、低黏性、低分子质量等优点,同时在制备过程中经历了酸热、酶解反应,又具备耐热、耐酸、抗消化等特性[4]。目前国内抗性糊精的工业化生产中仍存在产品得率相对较低、抗性糊精含量不高等问题,同时近年来对抗性糊精的研究重点转向分子结构变化以及杂粮淀粉制备抗性糊精等,以小麦淀粉为原料制备抗性糊精的工艺及理化特性研究较少。张宏伟[5]以小麦淀粉为原料采用酸热法制备抗性糊精,主要探究了其对排便和大鼠脂肪组织的影响。抗性糊精的生理功能与市面上现有膳食纤维相比更为全面,具有减肥、调节血糖、改善肠道菌群及Ⅱ型糖尿病等功能[6-7],广泛应用于乳制品[8]、面制品[9]以及饮料制品[10]等行业。
抗性糊精的制备原料主要有玉米淀粉[8]、木薯淀粉[11]、山药淀粉[12]、燕麦淀粉[4]等,徐佩琳等[12]选用山药淀粉为原料,通过微波预处理-酶法制备山药抗性糊精,其具有溶解性高、热稳定性强、抗消化等特性。竺鉴博等[13]以豌豆渣为原料,利用酸热法制备豌豆抗性糊精,其抗性糊精含量为(42.15±0.16)%,为豌豆渣综合利用提供新思路。Kapusniak 等[14]选用马铃薯淀粉为原料,采用微波辐射的加热方式制备抗性糊精,并探究了间断加热和连续加热对抗性糊精的结构及理化影响,结果显示间断加热比连续加热制备的抗性糊精纯度和溶解度更高。Bai 等[15]通过核磁共振光谱技术研究酸热法制备的焦糊精糖苷键类型,在糊精化过程中,天然蜡质玉米淀粉被水解,并出现大量新的糖苷键分支,焦糊精高度支化。
小麦淀粉是食品工业生产中的重要原料,在直链淀粉与支链淀粉比例、结构和颗粒大小等方面与其它淀粉如玉米淀粉、马铃薯淀粉等存在较大区别。本研究以小麦淀粉为原料,采用酸热法制备抗性糊精,并利用单因素和响应面试验对酸热工艺进行优化,然后通过酶解和醇沉工艺提高其纯度,最后采用扫描电镜、X射线衍射、傅里叶变换红外光谱和凝胶渗透色谱对其结构特征进行表征并分析其体外消化特性,解析其结构变化与理化性质的关系,以期为小麦淀粉的高值化综合开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
小麦淀粉:新乡良润全谷物食品有限公司;葡萄糖、盐酸、氢氧化钠:天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸、四水合酒石酸钾钠、苯酚、磷酸二氢钠、磷酸氢二钠、无水亚硫酸钠:国药集团化学试剂有限公司;耐高温α-淀粉酶(40 000 U/g)、淀粉葡糖苷酶(100 000 U/g):上海麦克林生化科技股份有限公司;猪胰腺α-淀粉酶(5 U/mg):上海源叶生物科技有限公司;葡萄糖含量测定试剂盒:南京建成生物工程研究所有限公司。所用试剂均为分析纯。
1.2 仪器与设备
UV752N 紫外分光光度计:上海佑科仪器仪表有限公司;DZKW-S-4 电热恒温水浴锅:北京市永光明医疗仪器有限公司;SHA-CA 水浴恒温振荡器:常州普天仪器制造有限公司;DHG-9015A 鼓风干燥箱:上海一恒科学仪器有限公司;FEI Quanta250FEG 扫描电子显微镜:捷克FEI 公司;Nicolet iS20 傅里叶变换红外光谱:美国赛默飞公司;D8 Advance X 射线衍射仪:德国布鲁克公司;Prominence 凝胶渗透色谱仪:日本岛津公司。
1.3 试验方法
1.3.1 小麦抗性糊精的制备
参照Bai 等[16]、Zhen 等[17]、Trithavisup 等[18]的方法并进行修改,将10 g 小麦淀粉悬浮在15 mL 盐酸溶液中,搅拌30 min,在4 000 r/min 条件下离心10 min,沉淀40 ℃烘干24 h,将干燥的淀粉研磨、过100 目筛,在一定温度和时间条件下酸解,制备得粗糊精。加入3 倍质量的去离子水溶解,90 ℃保温5 min,调节pH 值至6.0,加入1%的耐高温α-淀粉酶水浴95 ℃振荡2 h,再调节pH 值至4.5,加入0.5%淀粉葡糖苷酶水浴60 ℃振荡1 h,100 ℃灭酶10 min;在4 000 r/min 条件下离心10 min,上清液加入4 倍体积的95%乙醇溶液,边加入边搅拌至沉淀产生,静置4 h 后,沉淀105 ℃烘干至恒重,得小麦抗性糊精。
1.3.2 单因素试验
采用1.3.1 方法对小麦淀粉进行酸热、酶解制备抗性糊精,通过单因素试验,分别考察盐酸浓度(0.02、0.04、0.06、0.08、0.10 mol/L)、酸热温度(150、160、170、180、190 ℃)、酸热时间(60、80、100、120、140 min)对抗性糊精得率的影响,并确定其最优工艺条件。
1.3.3 小麦抗性糊精制备响应面优化试验
依据抗性糊精制备单因素试验并结合Box-Behnken 中心组合试验设计原理,设计三因素三水平的响应面试验。选择盐酸浓度(A)、酸热温度(B)、酸热时间(C)为优化条件,以抗性糊精得率为评价指标,优化抗性糊精制备工艺,响应面因素与水平见表1。
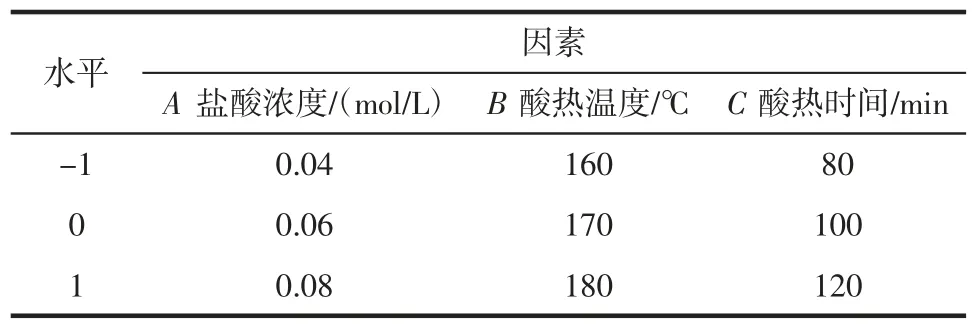
表1 响应面因素与水平Table 1 Factors and levels of response surface analysis
1.3.4 小麦抗性糊精含量测定
采用酶-比色法测定抗性糊精含量,准确称取0.25 g抗性糊精样品(恒重),加入50 mL 浓度为0.05 mol/L、pH6.0 的磷酸盐缓冲液充分溶解,加入1.0 mL 耐高温α-淀粉酶(60 U/mL),振荡混匀,然后于95 ℃水浴加热振荡30 min,冷却至室温,调节pH 值为4.5,加入1.0 mL 淀粉葡糖苷酶(100 U/mL),于60 ℃水浴加热振荡30 min,100 ℃灭酶并定容至100 mL。取稀释液2 mL,加入1.5 mL 3,5-二硝基水杨酸试剂后于沸水浴中加热15 min,流水迅速冷却,定容,摇匀[19]。利用3,5-二硝基水杨酸比色法测定样品中还原糖的含量,采用紫外分光光度计在波长为550 nm 处测定吸光度。抗性糊精含量(R,%)的计算公式如下。
R=100-X×0.9
式中:X 为样品中还原糖含量,%;0.9 为葡萄糖换算系数。
1.3.5 小麦淀粉及抗性糊精的扫描电镜测定
取适量小麦淀粉及抗性糊精样品,均匀分散在导电双面胶上,将双面胶黏附在载物架上,用离子溅射仪喷金,置于扫描电镜下进行观察[20]。
1.3.6 小麦淀粉及抗性糊精的傅里叶变换红外光谱测定方法
准确称取适量小麦淀粉及抗性糊精样品与溴化钾以1∶100 的质量比混合,研磨均匀后取适量样品制成薄片,在室温(22±1)℃条件下,空气为背景,分辨率为4 cm-1,立刻放入光路在4 000~400 cm-1扫描,扫描32 次,进行归一化处理,得到傅里叶变换红外光谱图[21]。
1.3.7 小麦淀粉及抗性糊精的X 射线衍射测定方法
采用X 射线衍射仪对小麦淀粉及小麦抗性糊精的结晶结构进行测定[22],将干燥样品放置玻璃板上,射线衍射在40 kV 和15 mA 的条件下工作,采用广角衍射仪衍射,扫描区域为5°~60°,辐射线为Cu Kα,扫描速率5°/min,扫描步长间隔为0.02°。
1.3.8 小麦抗性糊精的相对分子质量测定方法
参考张婷等[23]的方法并稍作修改,称取适量抗性糊精样品用流动相溶解,定容。流动相:水相(50 mmol/L硝酸钠、0.02%叠氮钠),过0.45 μm 的水系滤膜,采用凝胶渗透色谱仪测定其分子质量分布,流速为1.0 mL/min,进样量为10 μL。
1.3.9 小麦淀粉及小麦抗性糊精的体外模拟消化测定方法
参照Englyst 等[24]的方法中的体外消化模型并略作修改。精确取0.20 g 样品置于装有20 mL 醋酸钠缓冲液(pH5.2、0.5 mol/L)的锥形瓶中,沸水浴振荡糊化30 min,冷却至室温后加5 mL 混合酶液(290 U/mL 猪胰α-淀粉酶和20 U/mL 淀粉葡糖苷酶),置于37 ℃恒温摇床中,190 r/min 充分振荡,采用葡萄糖含量测定试剂盒测定水解0、20、60、90、120、150、180 min 反应产物中葡萄糖含量,计算小麦淀粉及小麦抗性糊精的水解率。
H=[(Gt-G0)/M]×0.9×100
式中:H 为水解率,%;Gt为不同时间葡萄糖含量,mg;G0为初始葡萄糖含量,mg;M 为样品的质量,mg;0.9 为葡萄糖换算系数。
1.4 数据处理与分析
各组试验均进行3 次平行并取其平均值,采用SAS 9.2、Design-Expert 13.0.1.0 软件对数据进行分析,利用ANOVA 对数据进行差异显著性分析(P<0.05);采用Origin 9.9 软件进行绘图。
2 结果与分析
2.1 单因素试验分析
盐酸浓度对小麦抗性糊精得率的影响见图1。
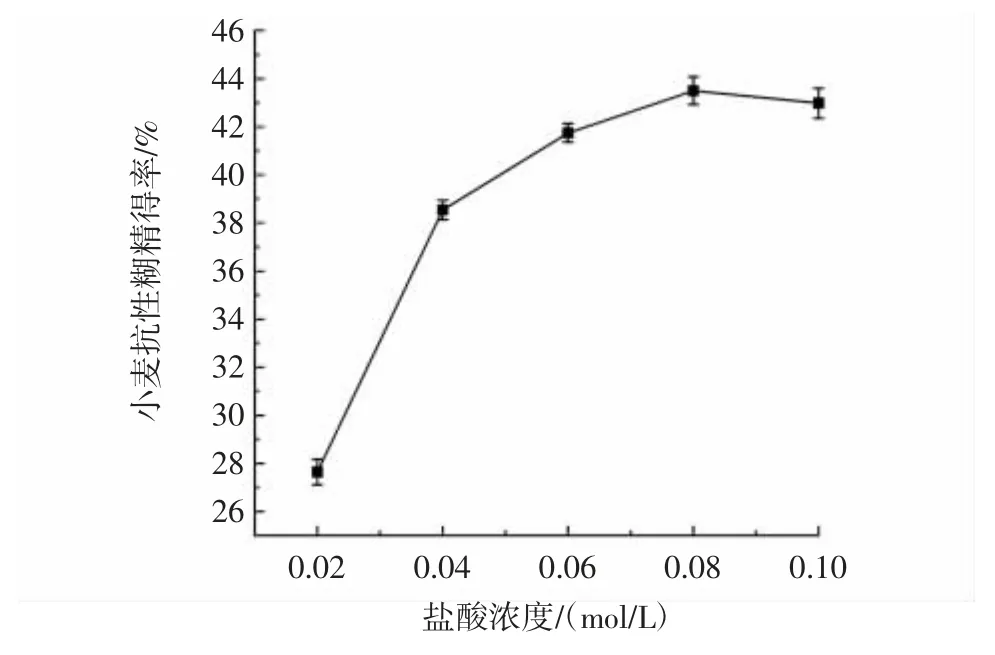
图1 盐酸浓度对小麦抗性糊精得率的影响Fig.1 Effect of concentration of hydrochloric acid on yield of wheat resistant dextrin
由图1 可知,随着盐酸浓度的升高,抗性糊精得率先升高再降低。当盐酸浓度大于0.06 mol/L 时,抗性糊精得率增长缓慢,颜色明显变深,不利于后期进行脱色处理和工业生产应用,因此选择盐酸浓度0.04、0.06、0.08 mol/L 进行响应面试验设计。
酸热温度对小麦抗性糊精得率的影响见图2。
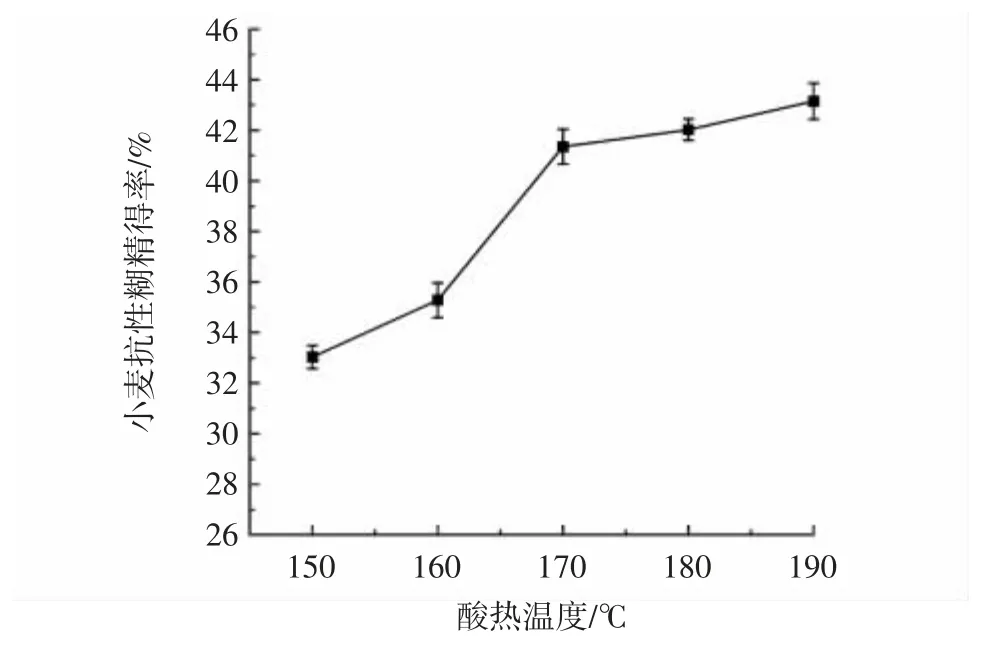
图2 酸热温度对小麦抗性糊精得率的影响Fig.2 Effect of acid-heating temperature on yield of wheat resistant dextrin
由图2 可知,随着酸热温度的升高,抗性糊精得率不断升高。当酸热反应温度大于170 ℃时,抗性糊精得率增长减缓,但颜色明显变深。因此选择酸热温度为160、170、180 ℃进行响应面试验设计。
酸热时间对小麦抗性糊精得率的影响见图3。
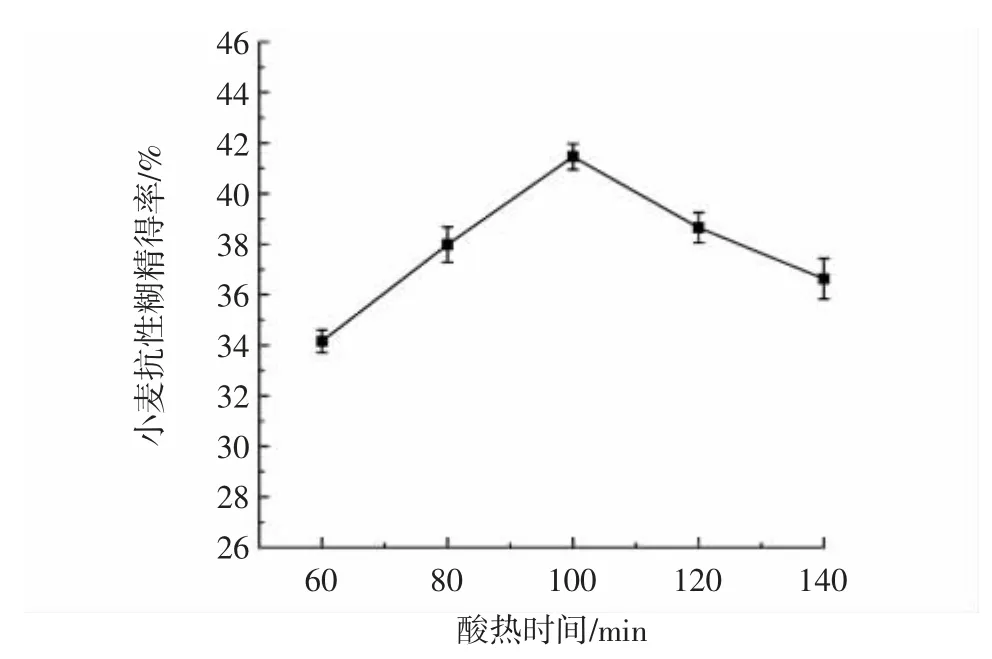
图3 酸热时间对小麦抗性糊精得率的影响Fig.3 Effect of acid-heating time on yield of wheat resistant dextrin
由图3 可知,随着酸热时间延长,抗性糊精得率先升高再降低,当酸热时间大于100 min 时,得率不再增加。因此选择酸热时间80、100、120 min 进行响应面试验设计。
2.2 响应面试验结果
2.2.1 响应面设计及分析
根据单因素试验结果和Box-Behnken 中心组合设计原理,设计三因素三水平的响应面试验。选择盐酸浓度(A)、酸热温度(B)、酸热时间(C)作为优化条件,以抗性糊精得率为评价指标。响应面试验结果见表2。
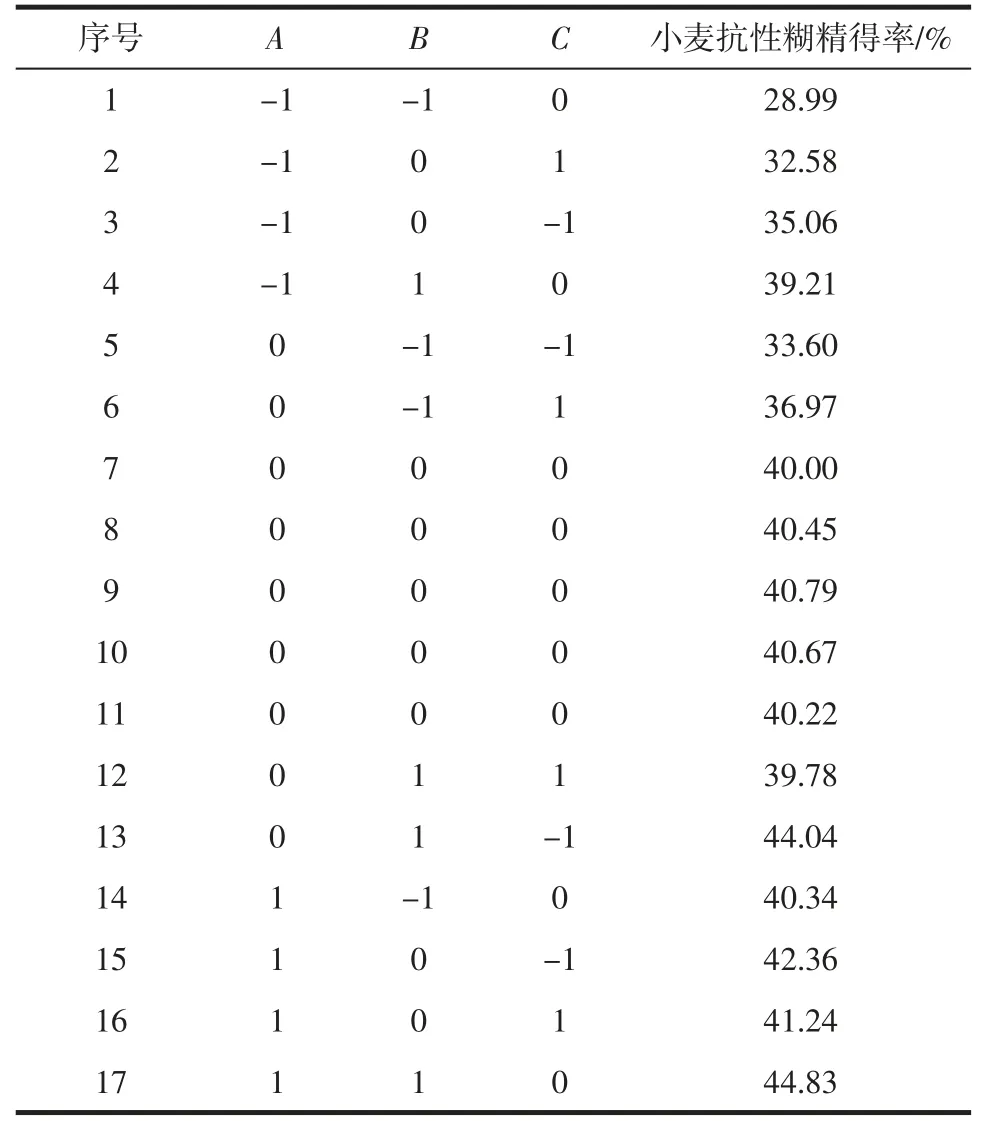
表2 响应面试验结果Table 2 Results of response surface experiment
采用Design-Expert 13.0.1.0 软件对表2 的数据进行分析,构建回归方程:抗性糊精得率Y=40.43+4.12A+3.50B-0.561 2C-1.43AB+0.340 0AC-1.91BC-1.44A2-0.648 0B2-1.18C2。
回归模型方差分析见表3。
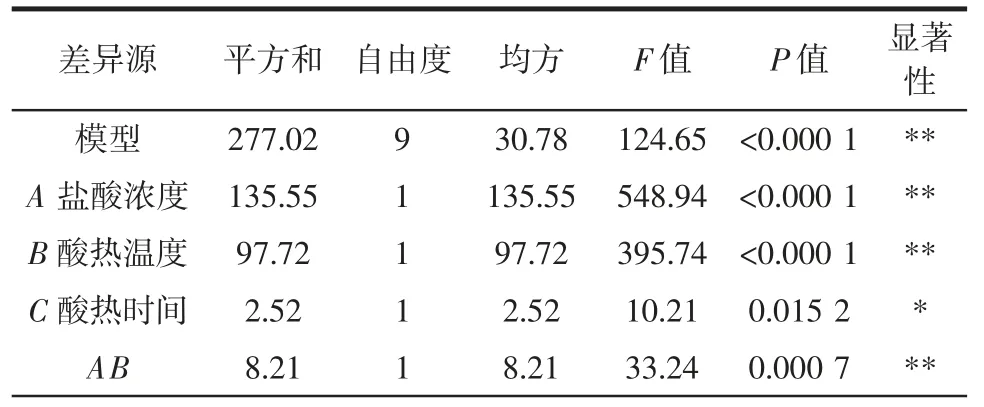
表3 回归模型方差分析Table 3 Variance analysis of the regression model
由表3 可知,该模型显著性高,其决定系数R2为0.993 8,矫正决定系数R2Adj为0.985 8,预测值与试验值相关性较高。除盐酸浓度和酸热时间交互项对抗性糊精得率影响不显著外,其余项影响均达到显著或极显著水平。
盐酸浓度、酸热温度、酸热时间之间的交互作用对抗性糊精得率影响的响应面见图4。
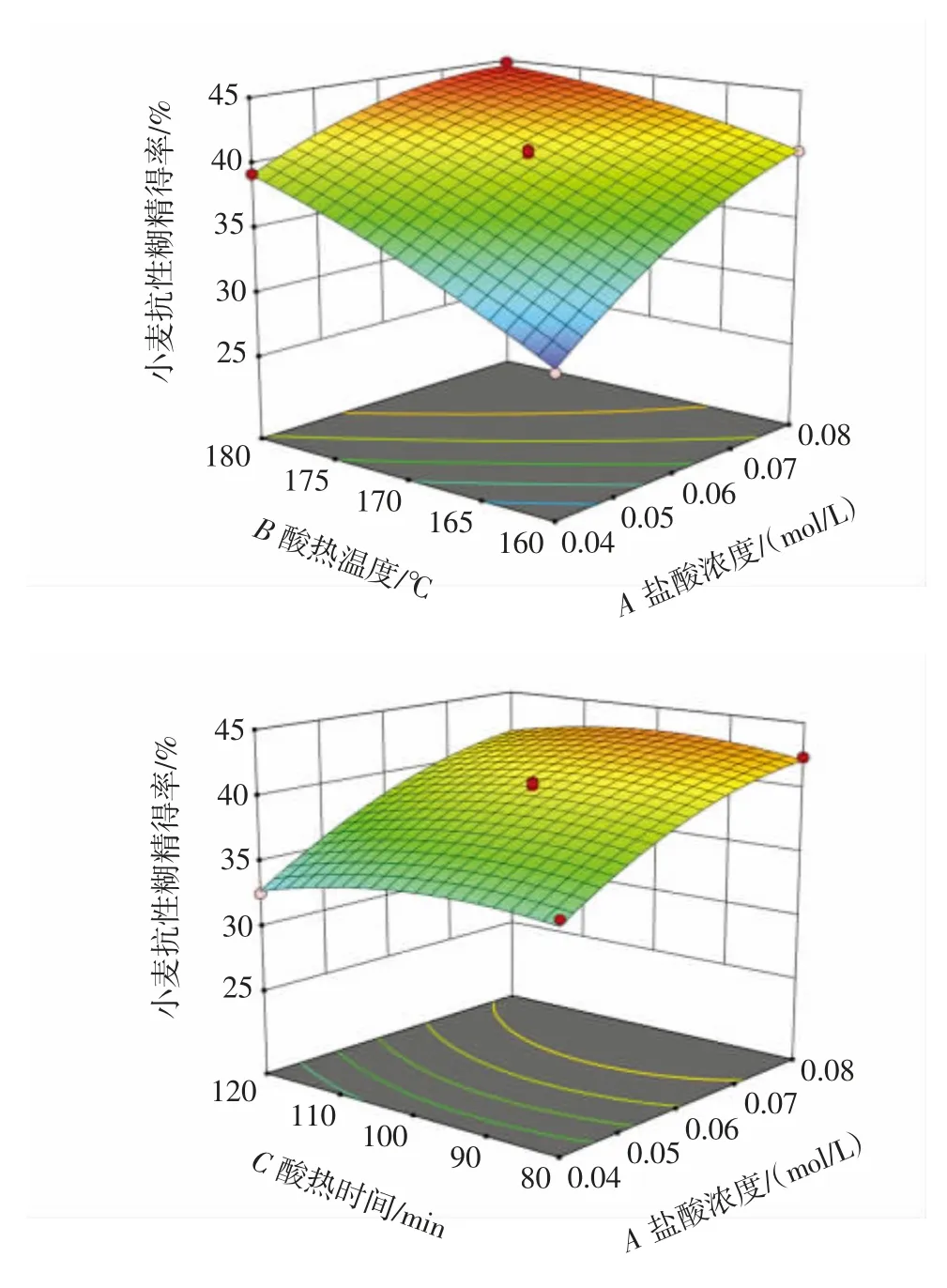
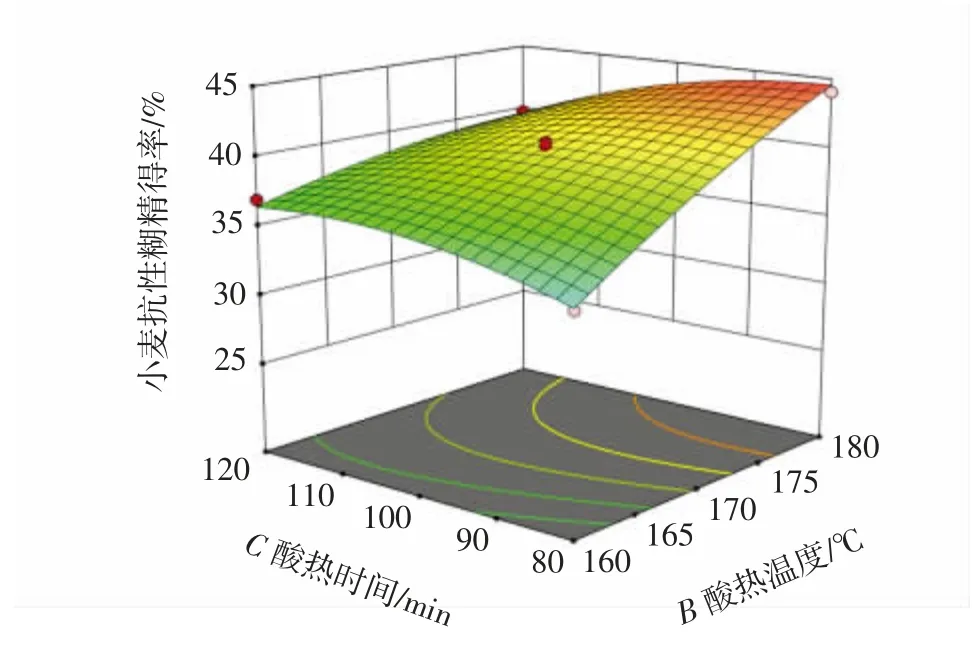
图4 各因素交互作用对小麦抗性糊精得率影响的响应面Fig.4 Response surface plots for the effect of three variables on the yield of wheat resistant dextrin
响应面图陡峭程度越大,表明两因素之间的交互作用越显著。由图4 可知,盐酸浓度和酸热温度(AB)、酸热温度和酸热时间(BC)响应面图坡度趋势陡峭,表明两者的交互作用对小麦抗性糊精得率影响较大,与方差分析结果一致。通过Design-Expert 13.0.1.0 软件对响应面试验结果进行分析,抗性糊精最佳工艺条件为盐酸浓度0.074 mol/L、酸热温度178.76 ℃、酸热时间92.90 min,该工艺下抗性糊精得率理论值为44.85%。
2.2.2 验证试验
为了检验响应面优化试验结果与真实情况的一致性,按照上述分析结果进行验证试验,为便于实际操作,将最佳工艺条件修正为盐酸浓度0.075 mol/L、酸热温度180 ℃、酸热时间95 min,在此条件下进行3 次验证试验,小麦抗性糊精得率为(43.83±0.08)%,并检测其抗性糊精含量为(86.99±0.23)%,试验值和预测值相差较小,模型可靠性强。
2.3 扫描电镜测定结果与分析
通过扫描电镜对小麦淀粉及抗性糊精的结构进行观察,小麦抗性糊精与淀粉的扫描电镜图见图5。

图5 小麦抗性糊精与淀粉的扫描电镜图(1 000×)Fig.5 Scanning electron images of wheat resistant dextrin and starch(1 000×)
由图5 可知,小麦淀粉结构为表面光滑、结构完整的均匀圆球颗粒,这与徐箐等[25]描述一致,然而小麦抗性糊精样品表面呈大量碎片化结构,这说明淀粉在酸热糊精化反应中,淀粉颗粒发生降解,并伴随着小分子的再聚合和糖基化反应,同时由于淀粉酶和糖化酶的酶解反应,形成大小不一,无规则,多孔状结构,此变化有利于水分子渗透,使水溶性增加。在研究燕麦和高粱淀粉制备抗性糊精过程中,淀粉颗粒结构也发现了类似的变化,不规则的结构变化使其具有更强的抗酶解特性,颗粒形态的改变与其消化性密切相关[4],这也印证了小麦抗性糊精具有较高的抗酶解消化特性。
2.4 傅里叶变换红外光谱测定结果与分析
通过对小麦淀粉及抗性糊精红外光谱分析,小麦抗性糊精与淀粉的红外光谱图见图6。
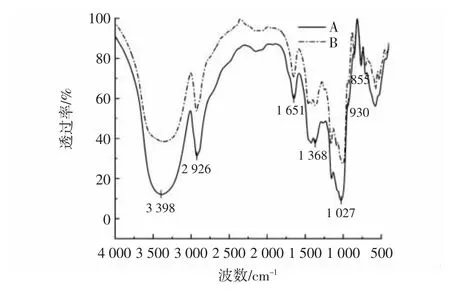
图6 小麦抗性糊精与淀粉的红外光谱图Fig.6 Infrared spectrum of wheat resistant dextrin and starch
由图6 可知,小麦淀粉与抗性糊精的红外光谱特征峰没有明显差异,没有新的官能团产生,但发生了糖苷键的断裂和聚合反应。3 500~3 200 cm-1处是分子间氢键—OH 伸缩振动的吸收带,小麦淀粉及抗性糊精在3 398 cm-1处均存在强吸收峰,此峰为糖类特征吸收峰;2 926 cm-1处的吸收峰为多糖次甲基C—H的伸缩振动;1 651 cm-1的吸收峰为C=O 伸缩振动;1 368 cm-1处的间断吸收峰为C—H 弯曲振动,1 200~1 000 cm-1是多糖的分子指纹区[26],1 027 cm-1处是吡喃糖环的吸收峰;1 000~800 cm-1处的吸收峰代表淀粉和抗性糊精所特有的α-糖苷键和β-糖苷键。在高温酸热条件下淀粉发生糊精化反应以及酶解反应,导致连接淀粉分子主要的α-1,4 糖苷键被破坏,降解的淀粉分子发生诱导解聚,攻击周围分子的羟基和短链交联聚合,诱导分子内新的耐消化糖苷键的形成,使抗性糊精具有较强的抗消化特性[20]。
2.5 X 射线衍射测定结果与分析
通过X 射线衍射对小麦淀粉和小麦抗性糊精的晶型结构进行分析,小麦抗性糊精与淀粉的X 射线衍射图见图7。
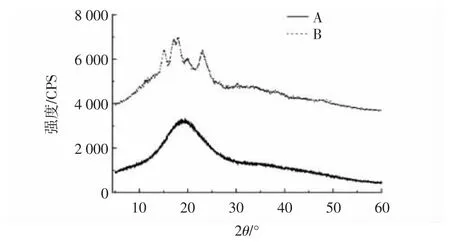
图7 小麦抗性糊精与淀粉的X 射线衍射图Fig.7 X-ray diffraction patterns of wheat resistant dextrin and starch
由图7 可知,小麦淀粉在15.07°、17.14°、17.97°、23.06°时出现衍射峰,且峰尖,为典型的A 型晶型结构,与张玉荣等[27]的研究结果一致。抗性糊精在20°左右出现较宽衍射峰,尖峰几乎消失,经过高温热解、酶解的处理,抗性糊精晶型结构丧失,由晶型转变为非晶型,与小麦淀粉的结构存在明显差异。刘德志等[20]通过酸热、酶解的方法制备的绿豆抗性糊精的衍射结构也发生类似变化,绿豆淀粉有序的结晶结构被破坏导致结晶峰完全消失。说明高温酸热反应过程中,淀粉分子由有序晶体向无序晶体转化,促进了小分子的重新聚合和分子间的糖基转移反应,形成新的糖苷键且高度分支化,极少被消化酶破坏,具有抗酶解消化的特性[16]。
2.6 分子质量测定结果与分析
采用凝胶渗透色谱对小麦抗性糊精的相对分子质量进行测定,其数均分子质量为2.59×103g/mol,重均分子质量为7.39×103g/mol,分散度为2.85。Yang 等[28]测得小麦淀粉重均分子质量为1.64×108g/mol,小麦抗性糊精的分子质量明显远小于小麦淀粉,小麦抗性糊精属于低分子质量的聚合物。Cao 等[29]在淀粉浆pH3.0,热解温度170 ℃,酸热时间2 h 的条件下,所得焦糊精的数均分子质量为3.2×103g/mol,重均分子质量为6.5×103g/mol。Trithavisup 等[1]在研究酸热条件对木薯抗性糊精分子结构变化过程发现,延长酸热反应时间能够显著增加其相对分子质量,经酸热、酶解反应制备的木薯抗性糊精重均分子质量在3.48×103~4.69×103g/mol 之间。然而天然木薯淀粉的重均分子质量为2.19×107g/mol[30]。抗性糊精的分子质量降低是由于较强的酸热、酶解反应,发生水解、变性、糖基化和再聚合从而改变了淀粉的分子结构,生成分子质量较小的糊精[18]。
2.7 体外模拟消化分析结果
小麦淀粉及抗性糊精的体外模拟消化如图8 所示。
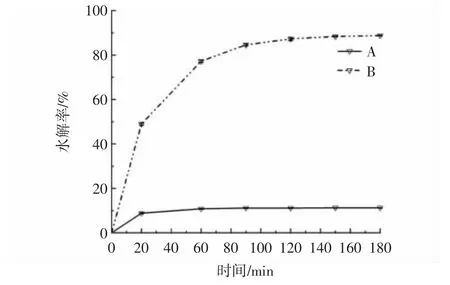
图8 小麦抗性糊精与淀粉的水解率Fig.8 Hydrolysis rate of wheat resistant dextrin and starch
由图8 可知,体外模拟消化过程中,小麦淀粉的消化产物中葡萄糖含量持续提高,并在120 min 逐渐达到稳定,水解率增至82.67%,然而抗性糊精的水解率始终未超过12%,远低于淀粉的水解率。这是因为猪胰腺α-淀粉酶和淀粉葡糖苷酶水解淀粉分子中的α-1,4 糖苷键和α-1,6 糖苷键生成葡萄糖,导致消化反应产物中葡萄糖含量升高,而抗性糊精具有高度支化的结构以及糊精化反应过程中产生耐酶解的糖苷键,导致抗性糊精消化反应产物中葡萄糖含量较少。通过核磁共振波谱法对抗性糊精糖苷键类型进行检测分析,发现其中仍含有大量的α-1,4 糖苷键,并检测到新的糖苷键β-1,2、β-1,4 和β-1,6 等的产生,所以抗性糊精能够耐酶解不仅受新糖苷键产生的影响,还与其高度分支化的结构有关,此外随着盐酸浓度和时间的增加和延长,能够形成更高支化结构的抗性糊精,其膳食纤维含量也随之提高[1,15]。
3 结论
以小麦淀粉为原料,采用酸热法制备抗性糊精并通过单因素、响应面优化试验确定其最佳工艺参数为盐酸浓度0.075 mol/L、酸热温度180 ℃、酸热时间95 min,此时抗性糊精得率为(43.83±0.08)%,抗性糊精含量为(86.99±0.23)%。通过扫描电镜、X 射线衍射、红外光谱、凝胶渗透色谱对其进行表征并探究其体外消化特性,结果表明:小麦抗性糊精表面粗糙、疏松多孔,结晶度低,内部结构无序,其重均分子质量为7.39×103g/mol,是低分子质量的水溶性膳食纤维,具有良好的抗消化特性。这些特性虽然为小麦淀粉制备的抗性糊精提供了理论依据,但是有待进一步研究抗性糊精的形成机理及精细分子结构变化,同时通过动物实验进一步挖掘其低血糖生成指数和益生元特性,探究其改善肠道菌群紊乱、调节糖脂代谢的作用机制,开发低血糖生成指数的绿色功能性食品。

