综合电化学实验NiFeMo/CC析氧反应电催化剂的制备、表征与测试
刘桂华 武兰兰 杜晓航 郭一川 曹书镒
摘要 文章介绍了一种综合电化学实验,NiFeMo/CC析氧电催化剂的制备、表征与测试。实验内容涉及水热合成、材料表征分析、析氧性能测试等。实验通过水热法合成了NiFeMo纳米针,作为电解水中析氧反应的电催化剂。该实验将科研工作与学生实验教学相结合,使学生学习了电催化性能测试以及电化学工作站等仪器的使用操作技能,激发了学生对科研的热情,提高了他们的自主创新意识。
关键词 综合性电化学实验;钼掺杂;析氧催化剂
中图分类号:G642文献标识码:ADOI:10.16400/j.cnki.kjdk.2023.14.014
实验教学是培养理工科本科生能力与素养的重要环节。为加强河北工业大学化工学院本科生对于新能源材料与技术的认识,加深其对基础专业知识的理解,提高其实验操作能力与创新能力,各专业均开设了创新性综合实验。基于此,本文设计了一个综合实验,其集催化剂制备(NiFe/CC和NiFeMo/CC)、物理性质表征及催化性能考察于一体。在电催化剂的制备和性能考查过程中,涉及材料化学、无机化学、仪器分析、电化学等多方面的基础知识。在实验过程中,本科生独立制备材料,进行物理性质表征及电催化性能的考查。因此,本实验对培养本科生的化学应用能力,以及充实应用化学本科实验教学内容均具有良好的补充与拓展作用[1-2]。
1实验简介
1.1实验背景
随着人类社会对能源需求的快速增加,以及传统化石能源燃烧带来的严重环境问题,开发利用环保可再生的新能源逐渐成为研究热点[3-4]。氢能由于其燃烧产物仅为水,是一种无污染、高热值的新能源,而利用电(特别是太阳能、风能等绿色能源产生的电能)解水制取氢气是生产氢能源的一种有前途的方法[5]。电解水中的析氧半反应(OER)由于具有缓慢的4电子转移动力学,成为电解水过程中的主要阻碍。目前,贵金属氧化物IrO2、RuO2等是公认性能最好的OER催化剂,然而它们昂贵的价格使其实用性大大受限[6]。因此,开发廉价高效的OER催化剂成为发展氢能源的迫切需求。
在析氧反应催化剂中,镍铁等过渡金属化合物因其价格低、储量丰富等原因,被广泛研究用作高效的OER电催化剂。异种金属掺杂可通过电子调制效应进一步提高其电催化性能。因此,为了提高学生对新催化剂的制备、表征及对OER反应和电解水机理的认识,本实验以碳布为载体,通过一步水热反应,制备出钼掺杂的NiFeMo/CC纳米针催化剂。实验通过掺杂过渡金属元素催化剂的制备与研究,可以實现电化学类专业的综合实验教学。
1.2实验目的
本实验通过对NiFe/CC和NiFeMo/CC催化剂的合成、物理性质表征及电催化性能考查,达到以下教学目的:
①使学生充分了解电催化制氢行业的发展背景,掌握其基本技术原理。②使学生基本掌握水热合成的操作技能,能够运用电化学工作站进行循环伏安法和线性扫描伏安法等性能测试操作。③使学生能够对X射线衍射及X射线光电子能谱的数据进行处理和分析。
1.3实验原理
1.3.1电解水基本原理
在标准条件下,电解水的电压为1.23V。但在实际电解水过程中,需要施加大于1.23V的电压才能进行。引起过电势的原因有:电解系统中的阻、克服阳极反应能垒所需要的电势和克服阴极反应能垒所需要的电势。制备高效的电催化剂是降低过电势的有效方法之一。电解水过程的实质是通过对两个电极施加电压,从而引发水分子在电极表面发生HER和OER反应来生成H2和O2。
1.3.2循环伏安法(CV)
循环伏安法是利用周期性循环的电位进行扫描,具体先在电极上施加一个线性扫描电压,以恒定速率进行扫描;当达到设定的终止电位时,再进行反方扫描,以同样的速率扫至起始电位。所得的曲线会在特定电位区间出现波峰,表明在该区间内发生了特定的氧化还原反应或表面吸附。
1.3.3线性扫描伏安法(LSV)
线性扫描伏安法是在工作电极与参比电极之间加上一个随时间线性变化的电极电势,同时记录通过工作电极与辅助电极之间的电流,从而获得电极电流与电极电位之间的伏安关系曲线,即线性扫描伏安图。
2实验设计
2.1实验试剂与仪器
①实验试剂:碳布、5%硝酸溶液、5%硫酸溶液、六水硝酸镍(NiCl2·6H2O)、九水硝酸铁(Fe(NO3)3·9H2O)、尿素(CO(NH2)2)、氟化铵(NH4F)、四水合钼酸铵((NH4)6Mo7O24·4H2O)、氢氧化钾(KOH)。
②实验仪器:电子天平、磁力搅拌器、超声波清洗器、移液枪、离心机、电热恒温干燥箱、水热反应釜、X―射线衍射仪(XRD)、扫描电子显微镜(SEM)、X―射线光电子能谱仪(XPS)、电化学工作站。
2.2电极的制备
2.2.1 NiFe/CC的制备
首先用5%的硝酸溶液和5%的硫酸溶液按照体积比3∶1混合来配置混酸溶液,将裁剪好的碳布在其中浸泡12h,对碳布表面进行清洗和活化,之后用蒸馏水进行洗涤,在60℃下烘干。将0.93gNi(NO3)2·6H2O、0.27gFe(NO3)3·9H2O、0.224 g CO(NH2)2和0.075 g NH4F溶解在30 ml水溶液中。后将溶液转移到含有垂直放置碳布基材的特氟隆化不锈钢高压釜中。将反应釜密封后,放置在120℃的烘箱中加热6小时。冷却后取出碳布,用乙醇/蒸馏水冲洗,并在60℃的烘箱中干燥。所得产物命名为NiFe/CC。
2.2.2 NiFeMo/CC的制备
在配置盐溶液时加入0.78 g(NH4)6Mo7O24·4H2O,其他步骤与上述NiFe/CC制备方法相同。所得产物命名为NiFeMo/CC。
2.3电化学测试
3.2 XRD和XPS表征分析
NiFe/CC、NiFeMo/CC的XRD图谱如图2(a)(p44)所示,沉积在碳布(CC)上的催化剂NiFe/CC,出现了NiFe/ LDH的衍射峰。如图2(b)(p44)所示,NiFeMo/CC的特征峰分别归属于MoO3(PDF#21-0569)和NiFe/LDH(PDF#40-0215)。为了研究材料表面的元素价态,对材料进行了XPS的表征。根据图2(c)所示,Ni2p光谱显示出位于854.7和872.9 eV的两个峰,分别对应于Ni2+物种的Ni 2p3/2和Ni 2p1/2状态。而位于857.2和874.6 eV处的另外两个峰,分别对应于Ni3+物种的Ni2p3/2和Ni2p1/2状态。根据图2(d)所示,Fe 2p光谱显示了711.6和724.6 eV处的主峰,分别对应于Fe3+的Fe 2p3/2和Fe 2p1/2。图2(e)所示,Mo3d光谱在230.8eV和234.8eV处显示出两个峰值,分别对应于Mo6+物种的Mo 3d5/2和Mo 3d3/2。O 1s光谱在528.8eV和531.7eV处显示出两个峰值,分别对应于M-O和M-OH(图2(f))。
3.3催化剂的电化学活性

3.4电解水催化性能
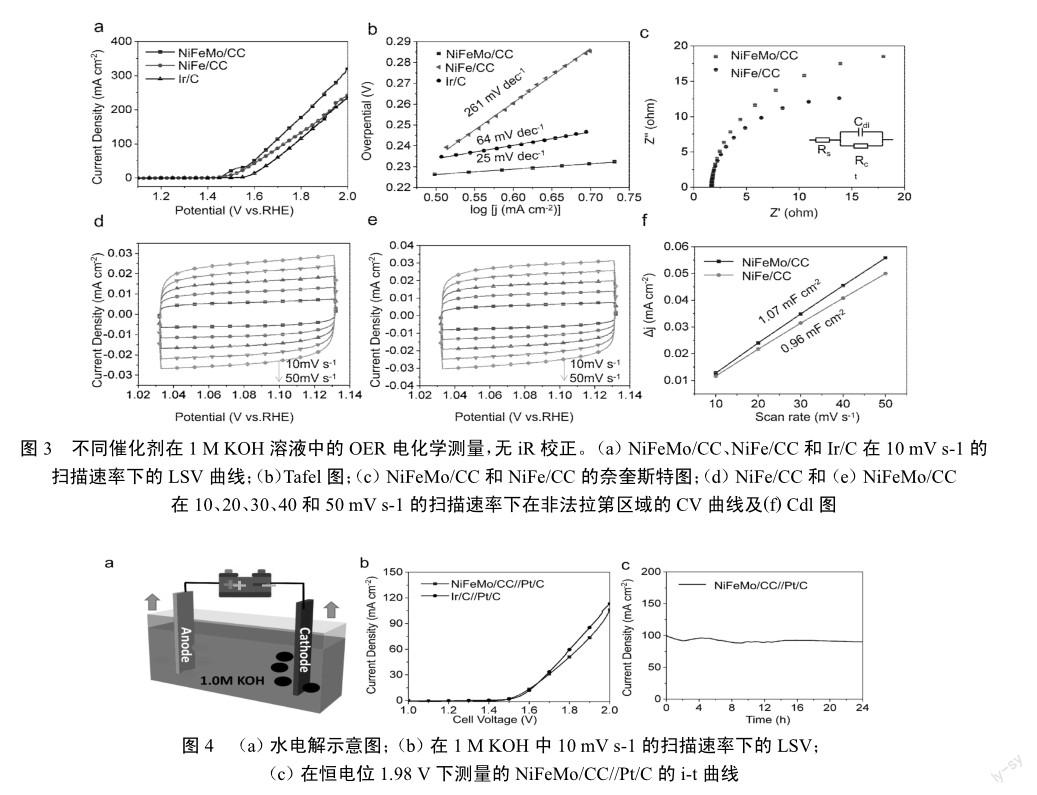
图4(a)(p45)是在1.0 M KOH中的水电解实验的示意图,其中NiFeMo/CC作为阳极,Pt/C作为阴极。LSV曲线由图4(b)(p45)所示,NiFeMo/CC//Pt/C的性能接近商业Ir/C//Pt/C。在10 mA cm-2的电流密度下,仅需施加1.56 V的电池电压,优于Ir/C//Pt/C电池电压(1.58 V)。为了进一步评价NiFeMo/CC//Pt/C催化系统的稳定性,采用了计时安培法进行长时间催化稳定性测试。如图4(c)所示,在恒电位为1.98 V的条件下,经过连续24 h的测试,其电流密度未发生明显变化,说明NiFeMo/CC具有良好的稳定性。
4结论
本综合实验制备了NiFe/CC和NiFeMo/CC两种催化剂,对两种催化剂进行了SEM、XRD、XPS等表征分析,并进行了电化学活性的测试。通过测试发现,相比NiFe/CC来说,NiFeMo/CC材料具有较高的OER催化活性,说明Mo的掺杂使NiFe/CC材料的催化活性得到了提高。通过该综合实验,本科生对电催化剂的设计、材料合成、结构形貌分析以及性能测试等过程的机理与方法均有了较好的了解,同时拓宽了科学眼界,取得了良好的教学成效。此外,本次实验的实践操作内容与学生所学基础理论内容有着很高的契合度,不仅能够实现理论与实践相结合的教育目的,还有助于激发学生的科研兴趣,為学生走上科研之路奠定良好的基础。
*通讯作者:刘桂华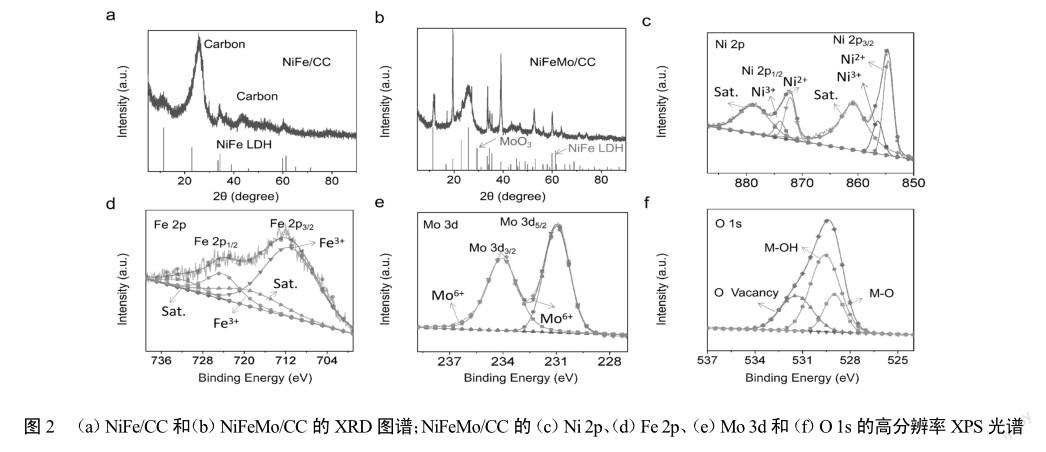
参考文献
[1]陈绮虹,周锦兰.化学实验教学的创新与学生能力的培养[J].实验室研究与探索,2006(11):1429-1432.
[2]崔志民,陈哲.在无机化学教学中渗透科学精神的探讨与实践[J].化学教育(中英文),2017,38(14):15-18.
[3]AricoAS,BruceP,ScrosatiB,etal.NanostructuredMaterialsforAdvanced Energy Conversion and Storage Devices[J].Nature Materials,2005,4(5):366-377.
[4]Gray H B.Powering the Planet with Solar Fuel[J].NatureChemistry, 2009,1(1):7.
[5]ShindeA,JonesRJR,GuevarraD,etal.High-ThroughputScreeningfor Acid-Stable Oxygen Evolution Electrocatalysts in the(Mn-Co-Ta-Sb) O(X)CompositionSpace[J].Electrocatalysis,2015,6(2):229-236.
[6]Cheng F,Chen J.Metal-Air Batteries:From Oxygen Reduction Electrochemistry to Cathode Catalysts[J].Chemical Society Reviews, 2012,43(24):2172-2192.

