金水六君煎对慢性阻塞性肺疾病小鼠气道黏液潴留的影响及机制研究
张 真,杨亿然,王 慧,李剑庆,李爱平,柏正平,刘 雨
(1. 湖南中医药大学,湖南 长沙 410208;2. 湖南省中医药研究院,湖南 长沙 410006;3. 湖南省中医药研究院附属医院,湖南 长沙 410006)
慢性阻塞性肺疾病(COPD)是全球第四大死因,预计到2030年将成为第三大死因[1]。2018年,王辰院士牵头的“中国成人肺部健康研究”调查结果显示,我国20岁及以上成人COPD患病率为8.6%,40岁以上人群患病率高达13.7%,估算我国患者数近1亿[2]。COPD特征是不可逆性的气流受限,其发病与环境和遗传因素有关,吸烟是主要的危险因素,深入研究其病理生理学机制将对COPD的个体化治疗有重大意义。气道黏液潴留是COPD的重要形态学基础[3-6]。囊性纤维化跨膜转导调节因子(CFTR)是一种环腺苷酸(cAMP)依赖的ATP门控性Cl-通道,对气道液体运输和黏液浓度至关重要,与气道慢性炎症及黏液潴留密切相关,CFTR的间接增效剂-罗氟司特治疗COPD患者疗效较好,并成功在欧美等地上市[7]。肺离子细胞是近期发现的一种气道新的细胞类型,CFTR被证实在肺离子细胞中大量表达,破坏促肺离子细胞生成关键因子Foxi1可致CFTR表达丧失和气道黏液潴留[8-9]。金水六君煎出自《景岳全书》,临床上用于治疗COPD咳喘痰多疗效满意,药效学研究显示金水六君煎能显著增加气管液体分泌量,促进痰液排出[10]。本课题组前期研究亦表明,金水六君煎能明显抑制COPD大鼠黏蛋白5ac(Muc5ac)的表达,上调水通道蛋白5的表达,以促进气道黏液排出[11]。本实验以COPD小鼠为研究对象,观察了金水六君煎对气道黏液潴留的干预作用和对CFTR、Foxi1表达的影响,以进一步阐明金水六君煎治疗COPD的可能机制及靶点。
1 实验材料与方法
1.1实验动物 SPF级雄性C57BL/6小鼠72只,体重18~22 g,由湖南中医药大学动物实验中心提供,生产许可证号:SCXK(湘)2019-0004,质量合格证号:ZS-202203150021。饲养环境温度(24±2)℃,湿度50%~60%,昼夜12 h交替照明,自由获取标准食物和水。动物实验经湖南中医药大学动物实验伦理委员会批准(LLBH-202201050001)。
1.2药物及金水六君煎药液制备 罗氟司特(批号:155813)购自MedChemExpress(MCE)公司。根据文献[12-13],确定金水六君煎原方剂量:当归7.5 g、熟地黄15 g、陈皮5.5 g、半夏7.5 g、茯苓7.5 g、炙甘草4 g、生姜10 g,各中药饮片购自湖南省中医药研究院附属医院中药房,并经田其学主任药师鉴定确认。一煎按原药材量加入10倍水,煎煮1 h后过滤,二煎加入8倍量水,煎煮1 h后过滤,合并2次滤液,分别浓缩成0.75 g/mL、1.5 g/mL、3.0 g/mL的药液,并分装存于4 ℃冰箱中备用。
1.3香烟和主要试剂 金圣牌香烟,江西中烟工业有限责任公司生产,含焦油8 mg、烟气烟碱0.8 mg、CO 9 mg。脂多糖(LPS,批号:0000113255)购自Millipore Sigma公司;4%多聚甲醛固定液(批号:22242687)购自北京兰捷柯科技有限公司;苏木素伊红染液(批号:03A220706)购自上海威奥生物科技有限公司;唾液酸试剂盒(批号:20220901)、尿素试剂盒(批号:20220825)购自南京建成生物工程研究所;cAMP ELISA试剂盒(批号:08/2022)购自上海酶联生物有限公司;Muc5ac ELISA试剂盒(批号:U22027015)购自武汉华美生物工程有限公司;V-ATPase ELISA试剂盒(批号:Jul 2022)购自上海茁彩生物科技有限公司;小鼠单抗CFTR(批号:00100501)、小鼠单抗β-actin(批号:10011066)购自美国proteintech公司;兔多抗Foxi1(批号:A90915N)购自Themo Fisher公司;辣根过氧化物酶(HRP)标记羊抗小鼠二抗(批号:02E220621)、HPR标记羊抗兔二抗(批号:01C220617)购自中国Abiowell公司;核酸染料(批号:P1622)购自北京普利莱公司;mRNA反转录试剂盒(批号:10148)购自北京康为世纪公司。
1.4主要仪器 1.6 m×0.5 m×0.25 m亚克力透明烟熏箱(包含顶部和侧面2个直径8 cm的进出气孔),由上海易雕实业有限公司定制;LH-75型管道风机(深圳市世化电器照明有限公司);PFT-MR型肺功能检测仪(上海塔望智能科技有限公司);DYY-6C型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D型转膜仪(北京六一生物科技有限公司);ChemiScope6100型化学发光成像系统(上海勤翔科学仪器有限公司);H1650R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);QuantStudio1型实时定量荧光PCR仪(美国应用生物系统公司);PW-812型全自动酶标洗板机、MB-530型多功能酶标分析仪(深圳市汇松科技发展有限公司);DHP-500型电热恒温培养箱(北京市永光明医疗仪器有限公司);BA210T型生物显微镜(麦克奥迪实业集团有限公司)。
1.5实验方法 小鼠适应性饲养7 d后,采用随机数字表法分为空白组、COPD组、金水六君煎低剂量组、金水六君煎中剂量组、金水六君煎高剂量组、罗氟司特组,每组12只。除空白组外,余各组小鼠采用鼻腔滴注LPS加烟熏的方法建立COPD模型[14],即在连接风机的自制烟熏箱中熏烟,2次/d,每次40min,中途间隔4h,每次使用20支香烟,每熏烟6 d休息1 d,共计60 d。除空白组使用生理盐水滴鼻外,余各组在第1天和第14天使用LPS滴鼻,每只小鼠0.6 μg/μL,均在麻醉状态下进行,当日不烟熏。小鼠给药剂量参考人和动物体表面积折算的等效剂量比率表[15],每只小鼠每千克体重给药量按人(70 kg)的等效量为中剂量,0.5倍等效量为低剂量,2倍等效量为高剂量,换算出小鼠金水六君煎低、中、高剂量分别为3.705 g/(kg·d)、7.41 g/(kg·d)、14.82 g/(kg·d),罗氟司特按照65 μg/(kg·d)的剂量给予[16]。于实验第61天开始,空白组和COPD组给予等量生理盐水灌胃,其他组给予相应剂量药物灌胃,均1次/d,连续14 d。
1.6检测指标及方法
1.6.1肺功能 小鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后,分离暴露气管,进行气管插管固定,使用小动物肺功能检测仪测定每分钟通气量(MV)、呼气峰值流速(PEF)和吸气峰值流速(PIF)。
1.6.2肺组织病理形态 取小鼠左肺组织,于4%多聚甲醛中固定24 h,干燥脱水,石蜡包埋切片,HE染色观察病理形态。根据文献[17]方法,对肺泡结构、肺上皮细胞、管腔情况和炎性细胞浸润4项指标进行肺组织病理半定量评分,按照病变情况评分0~3分,无病变为0分、轻度病变为1分、中度病变为2分、重度病变为3分,累加各项评分的总分作为病理评分。每只小鼠取5个视野的评分均值作为最终结果。PAS染色观察气道黏液及杯状细胞,Image J(v1.53)软件测定阳性着色面积与气道管壁总面积的比值,每只小鼠选取5个支气管的测量数据均值作为最终结果。
1.6.3肺泡灌洗液中唾液酸、尿素和Muc5ac含量小鼠脱颈处死后,立即取出完整肺组织,血管夹夹闭左主支气管,使用0.5 mL PBS溶液灌洗右肺3次,每次反复抽吸2次,回收率超过80%,4 ℃ 1 000 r/min离心10 min,收集上清液,放置在-80 ℃低温冰箱中保存备用。参考Esther等[18]的方法,取部分肺泡灌洗液配制成含有1%浓度的甲酸溶液,并在80 ℃下孵育1 h,再利用比色法检测各组肺泡灌洗液中唾液酸的含量,尿素选取未处理的肺泡灌洗液检测,最后计算两者的比值。肺泡灌洗液中Muc5ac含量严格按ELISA说明书操作检测。
1.6.4肺组织中cAMP和V-ATP酶含量 称取小鼠肺组织100 mg,剪碎后放入组织研磨器(匀浆管)中,然后加入1 mL 1× PBS溶液,制成匀浆,置于-20℃过夜。经反复冻融2次破坏细胞膜,2~8 ℃下5 000 r/min离心5 min,取上清液备用。严格按照ELISA试剂盒说明书检测cAMP和V-ATP酶含量。
1.6.5肺组织中CFTR和Foxi1 mRNA表达情况使用Trizol试剂从小鼠肺组织中提取总RNA,紫外分光光度计测定其浓度与纯度。使用mRNA反转录试剂盒将总mRNA转换为cDNA,以cDNA为模板进行qRT-PCR,体系30 μL,预变性条件:95 ℃ 10 min,循环条件:95 ℃变性15 s,60 ℃延伸30 s,40次循环。以β-actin为内参,空白组为对照,计算2-ΔΔCT,得到目的基因mRNA的相对表达量。在NCBI上搜索目的基因的序列,运用primer5软件设计引物,由北京擎科合成引物,见表1。

表1 基因引物序列
1.6.6肺组织中CFTR和Foxi1蛋白表达情况 采用Western blot法检测:称取25 mg肺组织,加入300 μL RIPA裂解液,在生物样品均质仪中研磨为组织匀浆,冰上裂解10 min,12 000 r/min离心15 min,提取上清液,BCA试剂盒检测蛋白浓度。配置SDS-PAGE凝胶,电泳,转膜,封闭,一抗稀释(CFTR 1∶1 000、Foxi1 1∶500、β-actin 1∶5 000),与膜4 ℃孵育过夜,次日室温放置30 min,1×PBST洗膜3次,每次15 min。二抗稀释(1∶5 000),与膜共同室温孵育90 min,1×PBST洗膜3次,每次10 min。ECL化学发光显影,凝胶成像系统成像。Image J(v1.53)软件测定各条带光密度值,以目的条带光密度值比β-actin条带光密度值代表该蛋白的相对含量。

2 结 果
2.1各组小鼠肺功能指标比较 COPD组的MV、PEF、PIF均明显低于空白组(P均<0.05)。金水六君煎各组和罗氟司特组的MV、PEF、PIF均明显高于COPD组(P均<0.05),且金水六君煎高剂量组和罗氟司特组的MV、PEF、PIF均明显高于其他组(P均<0.05),金水六君煎高剂量组和罗氟司特组各指标比较差异均无统计学意义(P均>0.05)。见表2。

表2 空白组和慢性阻塞性肺疾病各组小鼠肺功能指标比较
2.2各组小鼠肺组织HE染色表现 空白组小鼠肺泡结构完整,少见肺泡萎缩、塌陷和融合,肺泡间隔无增厚和水肿,气道管腔内无脱落上皮细胞和炎性渗出物,黏膜上皮结构完整,管腔外无充血、水肿和炎性细胞浸润;COPD组小鼠肺泡腔可见渗出,肺泡间隔明显增厚和水肿,并伴有炎性细胞浸润,气道管腔内可见上皮细胞脱落,管壁增厚,管腔狭窄,局部塌陷,黏膜各层可见炎性细胞浸润;罗氟司特组和金水六君煎各组的上述病理改变较轻。见图1。

图1 空白组和慢性阻塞性肺疾病各组小鼠肺组织HE染色形态(×200)
2.3各组小鼠气道黏液分泌和杯状细胞增生情况PAS染色可将黏蛋白染为紫红色,阳性染色主要见于气道黏膜表面、杯状细胞和黏膜下腺体。与空白组比较,COPD组小鼠气道有大量杯状细胞增生,金水六君煎各组和罗氟司特组的杯状细胞增生减轻,其中以罗氟司特组最为显著。见图2。

图2 空白组和慢性阻塞性肺疾病各组小鼠肺组织PAS染色表现(×400)
2.4各组小鼠肺组织病理评分和气道阳性着色面积占比比较 COPD组的肺组织病理评分和气道阳性着色面积占比均明显高于空白组(P均<0.05)。金水六君煎各组和罗氟司特组的肺组织病理评分和气道阳性着色面积占比均明显低于COPD组(P均<0.05),且金水六君煎高剂量组和罗氟司特组的肺组织病理评分和气道阳性着色面积占比均明显低于其他组(P均<0.05),罗氟司特组气道阳性着色面积占比明显低于金水六君煎高剂量组(P均<0.05),金水六君煎高剂量组和罗氟司特组肺组织病理评分比较差异无统计学意义(P>0.05)。见表3。

表3 空白组和慢性阻塞性肺疾病各组小鼠肺组织病理评分和气道阳性着色面积占比比较
2.5各组小鼠肺泡灌洗液中唾液酸、尿素和Muc5ac含量比较 与空白组比较,COPD组的唾液酸和Muc5ac含量及唾液酸/尿素均明显升高(P均<0.05),尿素含量明显降低(P<0.05)。与COPD组比较,金水六君煎各组和罗氟司特组的唾液酸和Muc5ac含量及唾液酸/尿素均明显降低(P均<0.05),尿素含量均明显升高(P均<0.05);金水六君煎高剂量组和罗氟司特组各指标变化更为明显,与其他组比较差异均有统计学意义(P均<0.05),但此2组间比较差异均无统计学意义(P均>0.05);金水六君煎低剂量组和金水六君煎中剂量组唾液酸、尿素含量和唾液酸/尿素比较差异均无统计学意义(P均>0.05),但金水六君煎中剂量组中的Muc5ac含量明显低于金水六君煎低剂量组(P<0.05)。见表4。

表4 空白组和慢性阻塞性肺疾病各组小鼠肺泡灌洗液中唾液酸、尿素、唾液酸/尿素和Muc5ac含量比较
2.6各组小鼠肺组织中cAMP和V-ATP酶含量比较 COPD组的cAMP和V-ATP酶含量均明显低于空白组(P均<0.05)。除金水六君煎低剂量组的cAMP含量与COPD组比较差异无统计学意义外(P>0.05),金水六君煎各组和罗氟司特组的cAMP和V-ATP酶含量均明显高于COPD组(P均<0.05),且金水六君煎高剂量组和罗氟司特组的cAMP和V-ATP酶含量均明显高于其他组(P均<0.05),金水六君煎高剂量组和罗氟司特组cAMP含量比较差异无统计学意义(P>0.05),但金水六君煎高剂量组的V-ATP酶含量明显高于罗氟司特组(P<0.05)。见表5。

表5 空白组和慢性阻塞性肺疾病各组小鼠肺组织中cAMP和V-ATP酶含量比较
2.7各组小鼠肺组织中CFTR、Foxi1 mRNA和蛋白表达情况比较 COPD组的CFTR、Foxi1 mRNA和蛋白相对表达量均明显低于空白组(P均<0.05)。金水六君煎各组和罗氟司特组的CFTR、Foxi1 mRNA和蛋白相对表达量均明显高于COPD组(P均<0.05),且金水六君煎高剂量组和罗氟司特组的CFTR、Foxi1 mRNA和蛋白相对表达量均明显高于其他组(P均<0.05);金水六君煎高剂量组的CFTR、Foxi1蛋白相对表达量与罗氟司特组比较差异均无统计学意义(P均>0.05),CFTR、Foxi1 mRNA相对表达量均明显高于罗氟司特组(P均<0.05)。见图3及表6。
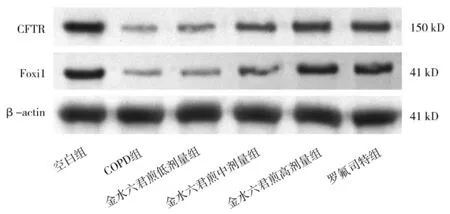
图3 空白组和慢性阻塞性肺疾病各组小鼠肺组织中CFTR、Foxi1蛋白表达条带
表6 空白组和慢性阻塞性肺疾病各组小鼠肺组织中CFTR、Foxi1 mRNA和蛋白相对表达量比较
3 讨 论
COPD归属于中医“肺胀”“喘证”等范畴,其病位在肺,继则影响脾、肾,病性多属本虚标实,痰饮始终是COPD的核心病机。肺主通调水道,通过宣发和肃降对水液的输布、运行和排泄进行调节,痰饮的形成与肺内水道失于通调,水津失布有关,正如《医学正传》言:“津液粘稠,为痰为饮。”金水六君煎出自明代张景岳《景岳全书》“新方八阵·和阵”之首剂,其组方由二陈汤加熟地、当归而成,既可化痰理气,又可补肾养阴,全方标本兼顾,实有增水行痰之功效。
健康的气道表面被覆着一薄层黏液,即气道表面层,包括低黏度的纤毛周围层和覆盖在纤毛表面的黏液层[19]。正常情况下,纤毛周围层的高度大约等于纤毛的高度(约7μm),黏液层则覆盖在纤毛表面,纤毛周围层充当有效的润滑层,促使黏液层在纤毛的摆动下向咽部移动[19-21]。但在COPD患者中,气道表面层的水合不足和(或)黏蛋白分泌过多,纤毛周围层降低,黏液的黏弹性、黏附性和润湿性等物理性质发生改变[22],从而潴留在气道表面难以咳出,诱发感染、炎症、气流阻塞和肺功能下降。一直以来,测量黏液浓度是一种反映气道水合状态的重要方法,但实际操作存在诸多困难。因此,本研究采用了一种替代方式[18],以唾液酸来反映气道表面层中黏蛋白的含量,以尿素作为气道表面层液相的标志物,两者比值即可反映黏液浓度。本实验结果显示,COPD小鼠的肺功能各项指标下降,肺组织炎症评分升高,气道管壁增厚,杯状细胞增生,唾液酸、唾液酸/尿素和Muc5ac含量升高,尿素含量降低,提示气道表面层水合不足和黏液高分泌,存在肺部炎症和黏液潴留。而金水六君煎各组和罗氟司特组的以上指标均有改善,提示气道表面层水合增加,黏蛋白分泌减少,肺部炎症和黏液潴留减轻。
CFTR是一种cAMP依赖的ATP门控性Cl-通道。当CFTR被激活时,Cl-会被分泌到气道腔中,管腔表面增加的盐浓度将产生渗透驱动力,促使水被动地通过水通道蛋白或细胞旁途径进入气道,以补充气道表面层的水合[23],从而促进黏液顺利排出。在本研究中,COPD组小鼠肺组织中CFTR mRNA和蛋白表达明显降低,并存在气道黏液潴留、肺部炎症和肺功能下降。多项研究亦表明[24-26],COPD患者或动物模型中的CFTR获得性缺陷是导致气道黏液潴留和肺功能下降的重要原因,与本研究相一致。罗氟司特是首个成功在欧美等地上市用于治疗COPD的磷酸二酯酶4(PDE-4)抑制剂,其可通过抑制PDE-4来增加cAMP的浓度,进而增强CFTR的磷酸化以促进其开放。既往研究表明,罗氟司特不仅能逆转CFTR活性的降低,还可促进CFTR mRNA的表达,以增加气道上皮气道表面层的水合[27-29],与本研究结果相一致。金水六君煎各组小鼠肺组织中的cAMP浓度升高,CFTR mRNA和蛋白表达增加。既往药理研究表明,陈皮中的主要药效成分包括橙皮苷[30]、柚皮苷[31]、川陈皮素[32]和橘皮素[33]等黄酮类化合物均能直接或间接地激活CFTR的功能和表达,引发黏膜表面Cl-电流变化。据此推测,金水六君煎改善气道黏液潴留的机制可能与增加cAMP浓度和促进CFTR表达有关,方中陈皮可能是主要的药效成分。
肺离子细胞是近年来通过单细胞RNA测序技术发现的一种罕见气道细胞类型,仅占小鼠气道细胞总数的0.42%,却表达了超过50%的CFTR,而数目众多的纤毛细胞在稳态时只表达其中的1.5%[8]。并且这种新型肺细胞还共表达Foxi1、V-ATP酶的多个亚基和CFTR,其中Foxi1属于叉头转录因子家族,其特征在于独特的叉头结构域[34]。相关研究表明,Foxi1是肺离子细胞的关键驱动因子,敲除小鼠肺离子细胞中的Foxi1会导致CFTR表达丧失及气道黏液生理破坏,表现出囊性纤维化的特征[9]。V-ATP酶是一种依赖于ATP的质子泵,广泛存在于真核细胞的胞膜系统中,涉及膜运输、溶酶体蛋白降解、微生物清除和离子的二次转运等细胞过程[35]。V-ATP酶可通过稳定溶酶体膜来维持溶酶体活性,以对抗氧化应激,具有减轻肺损伤的作用[36]。现有研究已经确定[9,34,37-38],V-ATP酶受到Foxi1的调控,包括正确组装和驱动表达等多种形式。综上可知,Foxi1基因是肺离子细胞转录程序的核心,CFTR和V-ATP酶受到Foxi1的调控。本实验结果显示,COPD小鼠的Foxi1、CFTR表达和V-ATP酶含量均减少,金水六君煎各组和罗氟司特组的Foxi1、CFTR表达和V-ATP酶含量增加,提示Foxi1的减少是导致COPD小鼠CFTR表达和V-ATP酶减少的可能原因,而金水六君煎和罗氟司特促进CFTR表达和增加V-ATP酶含量可能与Foxi1有关。本实验初步证实金水六君煎可促进CFTR表达,改善气道水合状态,减轻肺部炎症和气道黏液潴留,并延缓其肺功能下降,其内在机制可能与调控Foxi1有关,为金水六君煎治疗COPD提供了实验支持,但COPD中CFTR表达的降低和金水六君煎的干预作用是否涉及肺离子细胞还有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

