白藜芦醇的生理活性及其研究进展
关正萍,武佳慧,关 正,关正君,廖同兵
(1.山西师范大学食品科学学院,山西 太原 030031;2.北京农学院食品科学与工程学院,北京 100096;3.山西师范大学生命科学学院,山西 太原 030031;4.运城学院生命科学系,山西 运城 044000;5.杭州北千科技有限公司,浙江 杭州 310000)
1992 年Renaud 和DeLorgerils 首次提出将葡萄酒多酚(如白藜芦醇) 与定期或者适度饮用葡萄酒的潜在健康联系起来(所谓的“法国悖论”)。由于白藜芦醇被证明是葡萄酒中导致法国悖论(饱和脂肪摄入量高但冠心病死亡率低) 的关键因素之一,在全世界引起了极大的兴趣,许多流行病学研究调查了白藜芦醇消费和人类健康之间的关系,展开了对其生理功能的研究,并发表了多篇相关文献[1]。1939 年白藜芦醇首次从白藜芦的球根茎中部分离出来,后又于1963 年从何首乌的根部分离出来,在中国和日本传统医学的历史中被用作抗炎和抗血小板的药剂。这种天然多酚目前已在70 多种植物中被检测到,并且在红葡萄酒和各种人类食物中也发现了不少含有白藜芦醇的数量。目前,白藜芦醇工业生产中应用广泛,主要通过化学方法或微生物(如酵母菌) 进行生物技术合成而获得[2]。
白藜芦醇(3,5',-4- 三羟基二苯乙烯),是植物在面临外界影响(机械损伤、紫外线照射和真菌攻击) 时通过自身合成的一种抗菌物质。根据研究结果而知,葡萄中含有较为丰富的白藜芦醇,从新鲜的葡萄皮检测到的白藜芦醇的含量可达50~100 μg/g[3]。科学界在1997 年以后对白藜芦醇相关生理活性的研究迅猛增加,并得出白藜芦醇所表现出的生理作用可在各种疾病的治疗和预防中发挥作用的结论。因此,白藜芦醇具有很重要的药用价值和非常有潜力市场前景,其目前在欧美很多国家,白藜芦醇作为一种营养保健品正在被开发。
白藜芦醇的化学结构式见图1。

图1 白藜芦醇的化学结构式
1 白藜芦醇的主要食品来源
白藜芦醇常见的食品来源包括花生皮、红葡萄、桑葚、蓝莓、山桑子、大豆、石榴、蔓越莓等。根据研究数据表明,白藜芦醇在葡萄里的含量能够达到0.16~3.54 mg/g,干葡萄皮约为24 mg/g。在含有白藜芦醇的浆果中,蔓越莓汁含有0.2 mg/L,其果皮中的白藜芦醇浓度一般来说比果肉中的高[4]。研究结果表明,在红葡萄酒中白藜芦醇的含量能够达到0.1~14.3 mg/L,白葡萄酒中的白藜芦醇只含有0.1~2.1 mg/L,白葡萄酒相对于红葡萄酒的白藜芦醇含量较低[5]。在酿造葡萄酒的糖化过程中,葡萄果皮中的白藜芦醇会被溶解在葡萄汁中,红葡萄酒中白藜芦醇含量比较高,是因为红葡萄的果皮与葡萄汁之间接触时间长,而白葡萄酒酿造过程中的葡萄汁在糖化后,会立即与浆果残留物分离,所以其白藜芦醇的含量低。也就是说,葡萄酒中白藜芦醇含量的决定性因素与葡萄皮接触的发酵时间有关,由于在白葡萄酒和桃红葡萄酒的酿造的早期过程中便去除了葡萄皮,所以其白藜芦醇的含量通常来说会比红葡萄酒的含量要低[6]。
选定食品中白藜芦醇的含量[5]见表1,红葡萄酒中白藜芦醇的平均含量[5]见表2。

表1 选定食品中白藜芦醇的含量
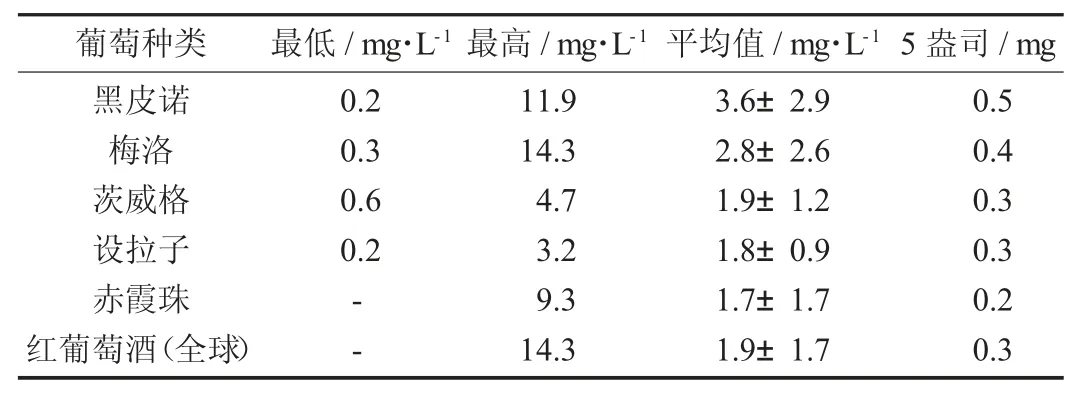
表2 红葡萄酒中白藜芦醇的平均含量
2 白藜芦醇在体内代谢与生物利用度
白藜芦醇在口服后会被肠细胞大量吸收,摄入的白藜芦醇只有一小部分能够到达血液和身体组织。此外,由于复杂的结构和高分子量,导致反式白藜芦醇的口服生物利用度约为12%。白藜芦醇通过被动扩散或载体介导的运输穿过肠细胞顶端膜被吸收,然后迅速而广泛地代谢为白藜芦醇的葡萄糖醛酸盐或硫酸盐。同时,摄入的白藜芦醇有很大一部分(约90%) 以其完整的形式到达结肠,随后进行肠道发酵,一旦通过门静脉吸收,产生的多酚代谢物就会进入肝脏,进一步甲基化、葡萄糖醛酸化或硫酸化,最后这些代谢物将渗透到系统循环中,并到达目标组织和细胞[7]。
在细胞或生化试验中观察到的许多有益影响很难在人体中发挥作用。因此,白藜芦醇仍然需要进一步研究来比较在人体血浆或组织中的最大或平均浓度与在动物和体外模型中实现生理功能作用所需的浓度[8]。
因此,快速吸收、生物利用度差和水溶性低是白藜芦醇在体内代谢的关键性因素和挑战,在应用方面仍然是一个严峻的挑战。为了克服这些挑战,研究者目前正在努力开发改善其水溶性与生物利用度的问题,这些策略包括如开发白藜芦醇的纳米制剂,可以改善白藜芦醇的固有的生物限制,增加其溶解度,防止其降解,同时保留其生物活性。目前有研究表明,改善生物利用度,从而潜在地增强白藜芦醇的化学预防作用的一个合理方法是制造衍生物,在白藜芦醇的甲基化衍生物中,四甲氧基二苯乙烯在肠道中的留存量相对较高。此外,还有研究表明,白藜芦醇还可以通过固体脂质纳米颗粒和纳米结构脂质载体的吸附作用,改进其水溶性和生物利用度的问题[9]。
3 白藜芦醇的生理活性及其作用机制
3.1 白藜芦醇抗氧化活性及其作用机制
白藜芦醇在许多研究中证明有较强的抗氧化特性,主要是通过抑制主要的抗氧剂酶和阻断自由基对DNA 的损伤和各种氧化还原相关的分子途径,使机体免受氧化应激[10]。白藜芦醇能够通过下调由活性氧(ROS) 激活的细胞外信号调节激酶(ERK),进而来调节抗氧化防御系统,从而改善抗氧化防御系统。白藜芦醇还可以通过对丝裂原激活蛋白激酶(MAPK) 途径的激活来进行抑制作用,进而减少由于缺血再灌注损伤所引起的氧化应激,使谷胱甘肽(GSH) 等抗氧化剂的能力显著上升,由此发挥其直接清除自由基的作用[11]。白藜芦醇抗氧化的主要作用机制是通过减少ROS/活性氮物种(RNS) 的产生、直接清除自由基和源性抗氧化剂酶的改善(如超氧化物歧化酶、过氧化氢酶、谷胱甘肽)[12]。
较多的文献报道证实,白藜芦醇是一种较强的抗氧化剂,但其生物利用度低,益处受到阻碍。许多学者试图通过酯化过程产生白藜芦醇衍生物,以改善其亲油性,并应用于基于脂质的食品,目前已经合成了大约12 种不同的酯化酰基氯化物,如丁酰基氯化物等,其酯化酰基氯化物衍生物可有效的降低由于铜离子诱导的低密度脂蛋白的氧化和羟基自由基所引起的DNA 裂解[13]。通过研究结果表明,白藜芦醇衍生物作为抗氧化剂在食品和生物学科中的进一步发展具有很大的潜力。
3.2 白藜芦醇抗炎症作用及其机制
文献报道,体内和体外研究结果表明了白藜芦醇的抗炎症机制通过抑制促炎症细胞因子的产生来体现。白藜芦醇通过抑制如肿瘤坏死因子α(TNF-α)和白细胞介素-1β(IL-1β) 的产生以达到抗炎症的作用。因为白藜芦醇是茋类化合物,所以其具有酸性和两亲性特征和抗炎症活性,其抗炎症机制的许多目标靶向在环氧化酶(COX)、5- 脂氧化酶(5-LOX) 和蛋白激酶B 上,这与其抑制环氧化酶-1和环氧化酶-2 活性的能力有关,不仅同时能抑制转录因子的活性,而且还能直接参与环氧化酶的活性调节[14]。
此外,白藜芦醇还可抑制独立于SIRT1 的核因子卡帕- 轻链- 活化B 细胞增强剂(NF-κB) 的信号传导。其中,NF-κB 是胞内控制炎症基因组表现的重要核转录因子,其受NF-κB 抑制作用蛋白和I-κB 激酶结合体(IKK) 的控制。当NF-κB 和I-κB融合后,使NF-κB 无法进入细胞核内而实现基因功能,在细胞接受脂多糖或其他炎症作用的诱发因子影响下,I-κB 磷酸化之后会使得NF-κB 入核,从而控制了炎症基因的表达[15]。总之,目前相关的研究表明,植物化学物质如白藜芦醇可以与多个目标相互作用,并改变失调的炎症途径和介质,进一步有潜力开发出经济、新颖和安全的药物来治疗慢性疾病的炎症过程[16]。
3.3 白藜芦醇抗菌作用及其机制
白藜芦醇在多项研究中证实了其抗菌活性,白藜芦醇可抑制细菌和真菌的生长,降低毒力因子的表达,减少生物膜的形成,影响细菌对各类常规抗生素的敏感性。对于许多细菌物种,白藜芦醇在质量浓度大于100 μg/mL 时会显示出生长抑制活性。根据对部分病原微生物生长影响的研究结果证实,通过白藜芦醇对革兰氏阳性细菌的抗菌活性和时间杀伤试验表明,白藜芦醇对革兰氏阳/阴性细菌和一些真菌有抑制作用,证实了其抑菌作用。白藜芦醇还已被证明能够有效地抑制白色念珠菌的生长。有研究表明,白藜芦醇在400 μg/mL 时对白喉杆菌有抗真菌活性,从而使白藜芦醇对白喉杆菌引起感染的抗真菌作用降到最低[17]。
根据文献报道,白藜芦醇可影响细胞的活性,使其细胞形态和DNA 含量发生变化。白藜芦醇能够导致大肠杆菌的DNA 断裂,由此诱发SOS 应激反应。白藜芦醇也能诱导细胞避免产生SOS 应激反应,从而通过抑制大肠杆菌中FtsZ(丝状温度敏感蛋白)的表达和Z 环的形成抑制细菌细胞生长。从另一个角度来看,活性氧(ROS)、超氧化物、过氧化物和羟基自由基被认为可辅助各种抗菌剂到达快速杀菌的目的。如果培养大肠杆菌和金黄色葡萄球菌时添加了白藜芦醇,并用抗菌素处理后,可将ROS 浓度降低到致死水平;相反,如果没有添加白藜芦醇时,ROS 浓度高到足以杀死诱变细胞[18]。
通过白藜芦醇联合抗菌剂致死性抑制试验和突变体恢复能力的研究结果证实,抗氧化剂可能有助于一些抗菌剂抗性的出现,特别是如果新的衍生物和白藜芦醇复合制剂可明显增加其生物利用率。根据研究结果表明,白藜芦醇的甲氧基衍生物中的紫檀芪对金黄色葡萄球菌表现出了抗菌活性,而且紫檀芪的最低抑制浓度还优于白藜芦醇(8~16 倍)。除了本身可以作为一种抗菌化合物之外,白藜芦醇还具有同生素结合使用的潜在效果。白藜芦醇可以拮抗环丙沙星、卡那霉素、草酸和莫西沙星的杀菌活性。此外,白藜芦醇还可增强糖苷类药物对铜绿假单胞菌产生的生物膜的活性,可以抑制生物膜的形成并促进生物膜的分散,因有望开发为新的抗生物膜剂,从而提高食品的保质期和其安全性[19]。
3.4 白藜芦醇降血糖作用及其机制
糖尿病是一种严重的代谢性疾病,通过肝脏糖异生代谢途径增加了对糖代谢循环的释放而引起的疾病,目前全世界有2.5%~7.0%的人被诊断患有糖尿病。根据文献报道,白藜芦醇在糖尿病中的作用机制方面的研究,白藜芦醇被证明可激活Sirtuin 1(SIRT1) 的途径,而SIRT1 已被研究证实为影响2 型糖尿病许多因素的一个重要调节器。研究表明,白藜芦醇能够通过控制引起高血糖发生的重要基因的转录,以及产生特异胰岛素途径蛋白质失活,进而提高对葡萄糖的摄取、利用、贮存,以及提高细胞内对胰岛素的敏感度来延缓高血糖的进一步发展[20]。
在文献报道的动物模型的研究中发现由链脲霉素(STZ) 和STZ 与烟酰胺(NA) 结合所诱导的糖尿病大鼠中发现,脲霉素是用来破坏胰腺细胞的因素,从而诱发胰岛素缺失性糖尿病。在暴露于链脲霉素的动物细胞中,DNA 发生断裂,修复机制被激活。患有实验性糖尿病的动物中,白藜芦醇影响磷酸烯醇式丙酮酸羧激酶和标准葡萄糖- 6 - 磷酸酶等葡萄糖异生通路中重要酶的活性,提高己葡萄糖激酶和丙酮酸激酶的表达水平,控制葡萄糖异生,继而促进葡萄糖酵解通路,降低血糖水平[21]。尽管目前的抗高血糖药物和胰岛素增敏剂有显著的效果,目前使用的疗法都伴随着副作用。因此,为了更好地预防和治疗糖尿病,研究者正在不断地测试新的药物和天然化合物,寻找其他更为高效的治疗方法。根据研究结果表明,白藜芦醇单独或与目前的抗糖尿病疗法相结合,具有降糖的作用。
3.5 白藜芦醇对心血管的防御作用及其机制
2019 年Danks L 等人[22]研究者在关于心血管疾病相关的调查报告中显示,发现至今因心血管疾病诱导的死亡百分率已经超过了癌症。根据研究结果表明,由于白藜芦醇的抗氧化和抗炎的生理功能,白藜芦醇通过Nrf2 的激活预防了高血压病理的进一步发展。白藜芦醇的血管保护作用由不同的机制介导,而关键机制之一是因为白藜芦醇能够上调内皮细胞的一氧化氮合成酶(eNOS),最终增加一氧化氮(NO) 介导的血管扩张并增加血流量,降低氧化应激和炎症,增强代谢能力,从而有效预防心血管疾病。
白藜芦醇还可通过减少组织因子,如表现出抗血栓作用,这种作用可通过主动脉内皮细胞来促进。此外,基于白藜芦醇对氧化应激和炎症的保护作用,使动脉粥样硬化中高脂肪、蔗糖饮食引起的中心动脉壁僵化得到改善[23]。研究还发现,白藜芦醇还可改善糖尿病大鼠的心血管功能,其保护作用是通过保持心脏干、祖细胞和成熟心脏细胞的功能的能力,通过减轻炎症状态改善心脏环境,减少糖尿病心脏不利的心室重构,促使心室功能显著恢复。白藜芦醇可改善左心室功能,降低心肌肥厚、收缩功能障碍及重塑、间质纤维化及血浆BNP 水平,对心力衰竭产生有益作用[24]。
4 结语
目前,白藜芦醇因其成本低、副作用小而引起食品行业界和医药学行业诸多学者的广泛关注。正因为白藜芦醇其出色的药理作用,使得如今市场上出现了含有白藜芦醇的补充剂和保健食品,为食品及其相关行业中含白藜芦醇相关产品的兴起和发展提供了思路。另外,由于消费者对天然产物的偏爱,促进了白藜芦醇作为一种膳食补充剂在市场上的吸引力。近年来,白藜芦醇因其生理功能的功效引起了开发者的重视,在欧美市场上有超过400 种含有白藜芦醇的产品。2015 年之后,在世界各地最新上市所含有白藜芦醇的商品中,美国市场占比为76.3%,而在整个欧盟市场只占有了15.1%的份额。据不完全调查统计得出,目前白藜芦醇相关的产品全球需求量正在增速上升中。
此外,许多文献报道了白藜芦醇的体外试验和动物模型试验研究并证实了白藜芦醇通过多种不同的途径发挥抗氧化、抗炎症、抗菌、降血糖和改善心血管疾病的作用机制。目前,白藜芦醇在体内代谢迅速及生物利用度低等方面的问题仍然存在,需要进行大量的研究来克服其局限性。不过,通过若干研究表明,白藜芦醇采用纳米制剂可改善其生物利用度及对白藜芦醇的衍生物进行研究,证实了白藜芦醇不仅在制药领域具有优势,同样在食品领域也具有开发潜力。

