ROO·氧化对核桃蛋白结构的影响
王旭敏,陈洁如,王瑞,狄建兵
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
蛋白质氧化第一次出现在人们的视野中是在医学领域,后来慢慢引入食品领域,在医学上,血浆、组织细胞中的蛋白质被氧化后,蛋白质的结构被破坏,发生变化,导致细胞功能受损[1]。在食品领域中,蛋白质氧化是指在直接或间接氧化作用下,蛋白质内部发生变化,原本的共价结构被破坏,发生改变,并且有分子间的链接、肽链断裂等现象发生,使蛋白质的功能特性进一步恶化,风味下降,营养损失[2]。
近年来,使用植物蛋白代替动物蛋白引起人们的广泛关注,植物蛋白对人体健康有生理调节作用,具有降低心血管疾病风险、延长慢性肾病患者生命周期、预防糖尿病等作用[3]。我国是核桃种植及生产大国,2021年,我国核桃种植面积达1.2亿亩,产量达540.4万吨[4]。核桃蛋白营养均衡,深受大众喜爱,是人们重点关注的植物蛋白资源,核桃蛋白富含活性肽,具有很好的抗氧化活性[5]。近年来,许多水解后的植物蛋白被加工成各种增加产品风味的调味品[6],榨油后的核桃粕保留了核桃的主要营养成分,以核桃粕为原料生产核桃酱油,提高了核桃的综合利用率,也为生产高档酱油提供了方向[7]。
脂质过氧化是一个非常复杂的反应过程,其主要的中间产物包括R·、RO·、ROO·等,在不同的氧化过程中,都有ROO·的存在与参与,它的存在使脂质过氧化与蛋白质氧化密切相连,而且ROO·的扩散距离远、半衰期长,造成的损害也较大,因此常研究ROO·氧化对核桃蛋白的影响[8]。
为了了解ROO·氧化对核桃蛋白的影响,本文利用不同浓度AAPH形成的不同程度的脂质过氧化系统对核桃蛋白进行了不同程度的氧化,对氧化后的不同指标进行了一系列分析,为抑制核桃蛋白氧化、提高核桃的综合利用率提供了理论依据。
1 材料、试剂与设备
1.1 主要材料
核桃粕粉:秋香核桃榨油后的粕粉。
1.2 主要试剂
实验试剂见表1。其他试剂均为实验室用分析纯。
表1 实验试剂Table 1 The experimental reagents
1.3 主要设备
实验仪器与设备见表2。
2 实验方法
2.1 核桃分离蛋白的制备
根据刘岩等[9]的方法略加修改,脱脂核桃粉与水按1∶26的比例混合,调节蛋白溶液的pH至11,磁力搅拌1.5 h,离心(5 000×g,20 min),用盐酸调节上清液的pH,当pH达到4.5时停止,室温下磁力搅拌1 h,离心(9 000×g,20 min),得沉淀,用氢氧化钠溶液将沉淀的pH调节至7.0,倒入液氮快速冷冻,在超低温冰箱中放置24 h,取出放入真空冻干机进行干燥,得到核桃分离蛋白,于4 ℃冰箱中保存。
2.2 ROO·氧化蛋白的制备
将2.1制得的分离蛋白用磷酸缓冲液配制成25 mg/mL的溶液备用,加入浓度分别为0,0.04,0.2,1,5,25 mmol/L的AAPH,放入恒温振荡器中,37 ℃、避光条件下振荡24 h,取出后迅速放于冰浴中,使温度快速降至4 ℃以下,将不同溶度的溶液各取出5 mL备用,随后将溶液透析72 h,期间每6 h换一次水,目的是除去未参与反应的AAPH,透析结束后用液氮快速冷冻,随后放入冻干机中,获得ROO·核桃氧化蛋白,于4 ℃冰箱中贮藏备用。
2.3 回收率的测定
取5 mL 2.2中的溶液进行回收率的测定,将样品离心(4 ℃、10 000×g、30 min),测定上清液中蛋白含量,计算回收率。
2.4 溶解度的测定
将2.2制得的核桃氧化蛋白配制成10 mg/mL的溶液,离心(25 ℃、10 000×g、20 min),取出上清液备用,测定上清液中蛋白含量,进一步计算其溶解度。
2.5 巯基含量的测定
采用DTNB比色法[10]。称取15 mg核桃ROO·氧化蛋白加入5 mL Tris-Gly-8 mol Urea缓冲液中,使用漩涡振荡仪在高速模式下对其进行振荡分散,然后加入4 mg/mL的DTNB溶液50 μL,迅速摇匀,保温30 min,以缓冲液为空白对照,测定其A412 nm,公式如下:
式中:SH为巯基含量,μmol/g;c为蛋白质溶液的浓度,mg/mL。
2.6 粒径、电位的测定
将2.2制得的核桃氧化蛋白用配好的磷酸盐缓冲液进行溶解,得到0.02%的蛋白溶液,离心(25 ℃、10 000×g、20 min),取上清液,过0.45 μm水膜,用纳米粒度及Zeta电位分析仪进行测定。
2.7 表面疏水性的测定
将2.2制得的ROO·核桃氧化蛋白溶解于PBS缓冲液中,配成1%的溶液,搅拌,离心(25 ℃、10 000×g、20 min),取上清液,测定其蛋白含量,继续用磷酸盐缓冲液对上清液进行稀释,稀释后在其中再加入5 μL 8 mmol/L的ANS溶液,设定激发波长与吸收波长分别为395 nm和470 nm,测定荧光强度,用荧光强度对蛋白质浓度作图,曲线斜率即为蛋白质表面疏水指数。
2.8 二级结构的测定
称取0.01 g核桃氧化蛋白,加入溴化钾,研磨,压片,采用傅里叶红外光谱仪对核桃氧化蛋白进行全波段扫描,对蛋白进行结构分析[11]。
2.9 内源荧光光谱的测定
将2.2制得的核桃氧化蛋白样品溶解于10 mmol/L、pH 7.0的PBS缓冲液中,配制成1%的蛋白溶液,25 ℃离心(10 000×g,20 min),以PBS缓冲液为空白对照测定其光谱。荧光光谱为295 nm,发射光谱为300~400 nm[12]。
2.10 数据处理分析
每个实验进行3次平行实验,使用SPSS 26.0、Origin 21.0对数据进行分析绘图。
3 结果与分析
3.1 蛋白质氧化对核桃氧化蛋白回收率的影响
蛋白质的回收率是影响其能否广泛应用于食品行业的关键因素之一[13]。由图1可知,当样品中不加入AAPH时,回收率为77.79%,AAPH浓度为0.04,0.2 mmol/L时,即低浓度氧化时,回收率略微升高,分别为80.67%、79.98%;当核桃氧化蛋白中AAPH浓度达到1 mmol/L时,蛋白回收率达到最高,为87.56%;随着AAPH浓度的进一步提高,蛋白回收率出现快速下降的现象,下降到41.11%;当浓度为25 mmol/L时,蛋白回收率降到最低值,为25.54%。由此可知,低浓度氧化能够提高核桃蛋白的回收率,但是随着氧化程度的逐渐加深,蛋白回收率明显降低,蛋白结构被破环,蛋白变性,产生了不溶性聚集物,进一步影响核桃蛋白在食品工业中的应用。
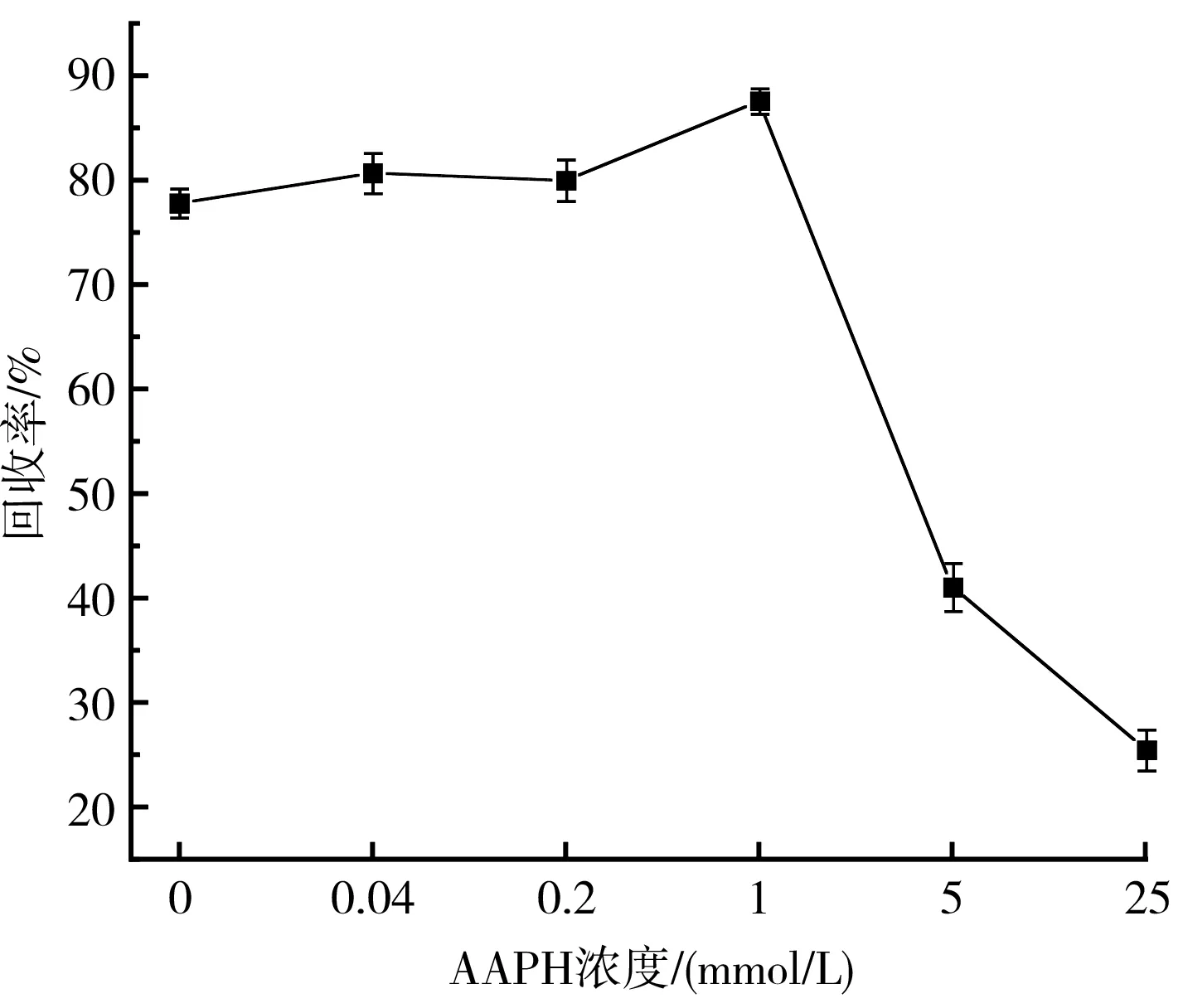
图1 不同AAPH浓度对回收率的影响Fig.1 Effect of different AAPH concentrations on the recovery rate
3.2 蛋白质氧化对核桃氧化蛋白溶解度的影响
溶解度通常指某种物质在溶剂中的溶解程度,对功能特性有重要的影响,也常常被用来表示核桃蛋白的聚集程度。不同AAPH浓度对核桃氧化蛋白溶解度的影响见图2。
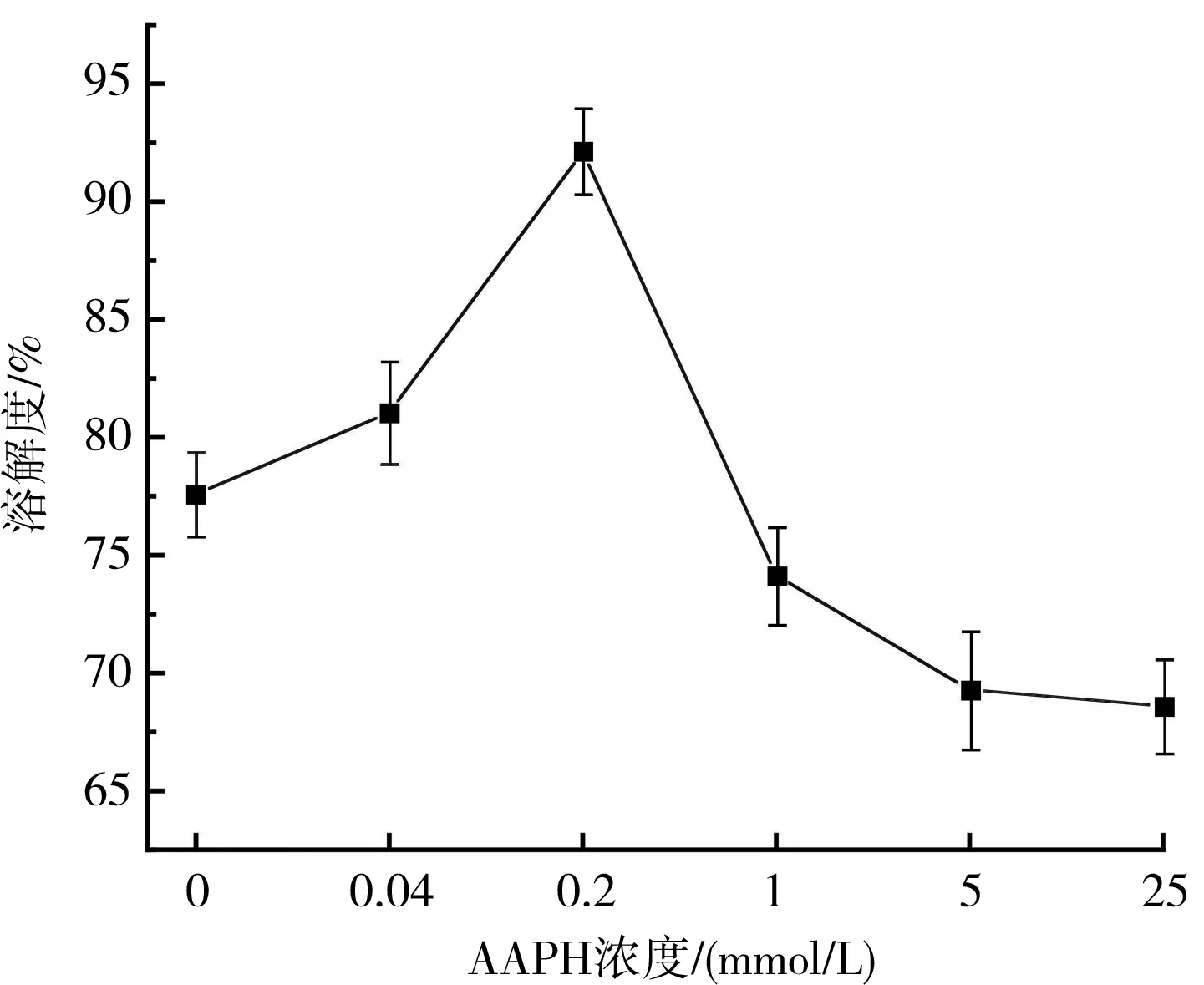
图2 不同AAPH浓度对溶解度的影响Fig.2 Effect of different AAPH concentrations on the solubility
由图2可知,核桃氧化蛋白中不加入AAPH时,溶解度为77.59%,低浓度氧化时,蛋白溶解度升高,在AAPH浓度为0.2 mmol/L时溶解度达到最高,为92.12%;当AAPH浓度进一步增加,氧化程度进一步加深,溶解度开始降低,最终下降到68.60%。由此可知,低浓度氧化可以提高溶解度,氧化进一步进行,溶解度开始降低。这可能是因为ROO·可以氧化主肽链以及侧链基团,使得疏水作用被改变,暴露出来的基团相互作用,形成聚集体,继续氧化,聚集体会再度聚集,溶解度上升;而当AAPH浓度高、氧化加深时,聚集体会转变成不溶性聚集物,溶解度会随之降低。
3.3 蛋白质氧化对核桃氧化蛋白巯基含量的影响
巯基在蛋白质结构中是一种比较重要的官能团,它不仅可以维持蛋白质的三级结构,而且可以反映蛋白质的变性程度[14],所以经常用来评判蛋白质的氧化程度。不同AAPH浓度对核桃氧化蛋白巯基含量的影响见图3。
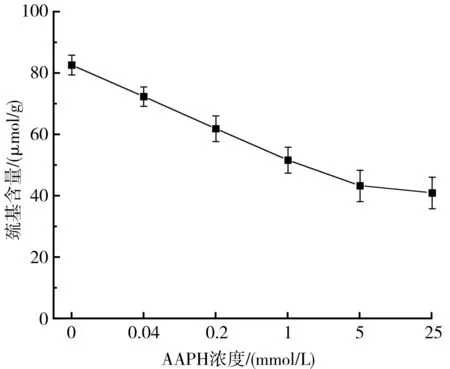
图3 不同AAPH浓度对巯基含量的影响Fig.3 Effect of different AAPH concentrations on the sulfhydryl content
由图3可知,当核桃氧化蛋白中AAPH浓度越来越大时,巯基含量呈现下降的趋势,从82.593 μmol/g最终下降到40.983 μmol/g。可能是因为AAPH裂解,产生ROO·,其与游离巯基发生反应后会生成一种新的物质——亚磺酰基自由基,然后与氧分子结合,诱导蛋白质氧化,巯基含量下降。
3.4 蛋白质氧化对核桃氧化蛋白粒径的影响
粒径通常用来反映蛋白的聚集程度[15]。由图4可知,核桃蛋白粒径峰值都出现在300 nm左右。当AAPH浓度为0.2 mmol/L时,峰值的范围变宽,此时颗粒分布比较分散;当AAPH浓度从0.2 mmol/L上升至1 mmol/L时,小的可溶性聚合体发生断裂,生成了更小的小分子物质,出现粒径变小的现象,氧化浓度增加时,可溶性部分发生共价交联和非共价聚合,转化为不溶性物质,粒径变大;当AAPH浓度达到25 mmol/L时,在接近1 000 nm处出现一个小峰,说明在高浓度氧化时,会导致不溶性物质的出现,聚集在一起,粒径变大。

图4 不同AAPH浓度对粒径的影响Fig.4 Effect of different AAPH concentrations on the particle size
3.5 蛋白质氧化对核桃氧化蛋白电位的影响
由图5可知,当AAPH浓度从0 mmol/L上升到0.04 mmol/L时,Zeta电位并未发生显著变化,当AAPH浓度上升到1 mmol/L时,Zeta电位明显降低,达到了-11.09 mV,AAPH浓度为5 mmol/L时,Zeta电位发生小幅度变化,上升为-7.53 mV。当AAPH浓度为1 mmol/L时,Zeta电位绝对值最大,此时体系最稳定,随着氧化的进一步加深,绝对值逐渐变小,吸引力明显超过了排斥力,核桃蛋白体系的分散被破坏,发生凝聚现象,体系变得不稳定。
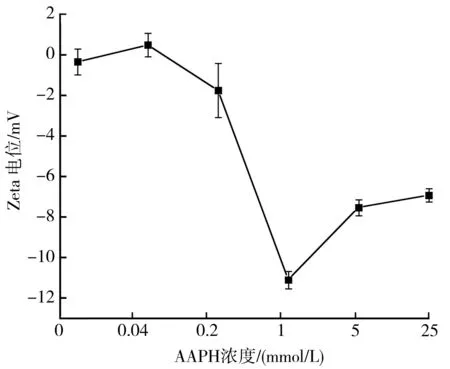
图5 不同AAPH浓度对电位的影响Fig.5 Effect of different AAPH concentrations on the potential
3.6 蛋白质氧化对核桃氧化蛋白表面疏水性的影响
疏水基之间的相互作用对于维持蛋白质的三级结构是不可或缺的一环,在天然蛋白质中,疏水键的生成起到了避免水相的作用,从而疏水作用在蛋白质的稳定性和构象中起着非常重要的作用[16]。通过对表面疏水性的测定与分析,可以得到疏水性氨基酸在其表面的分布情况[17]。不同AAPH浓度对核桃氧化蛋白表面疏水性的影响见图6。
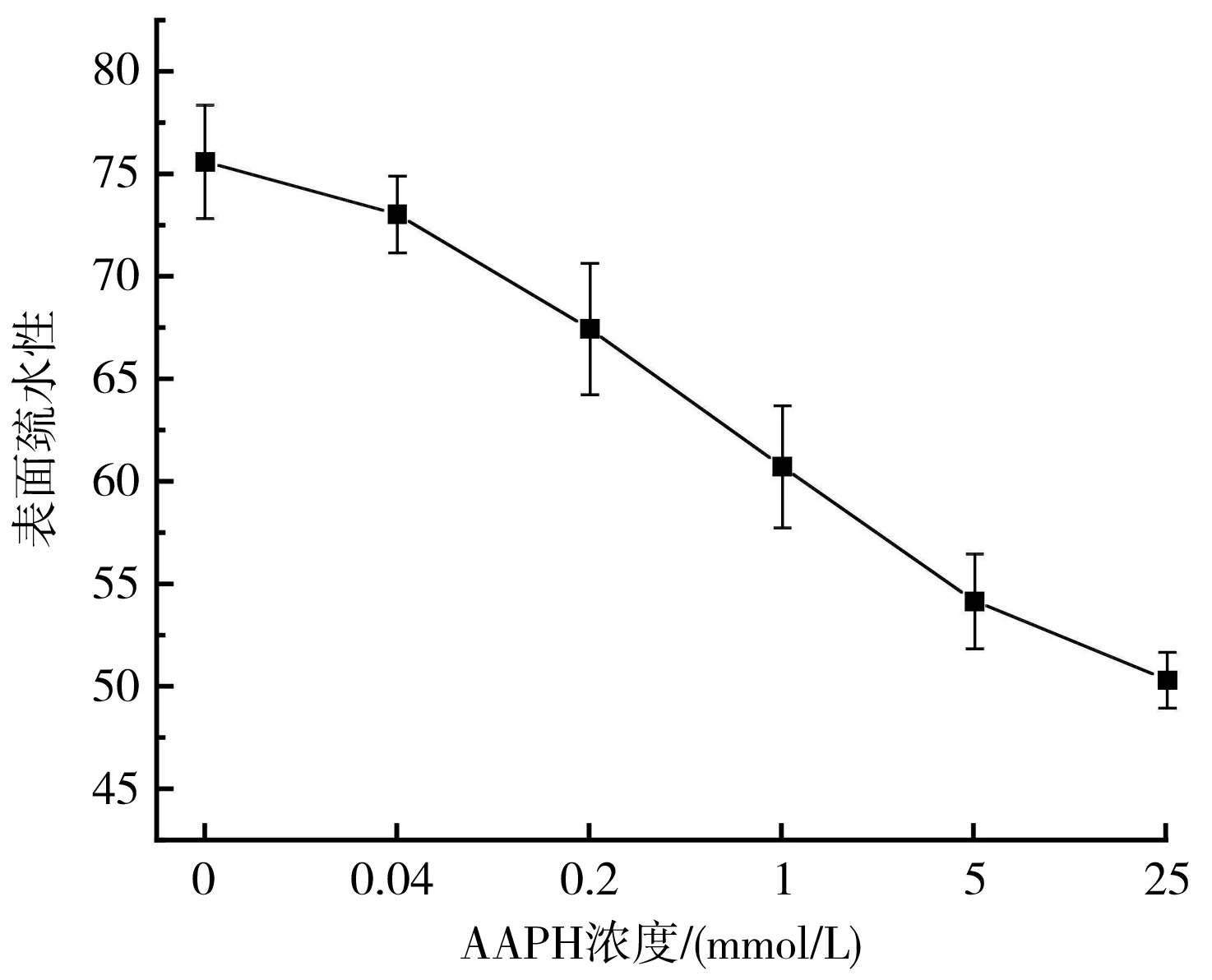
图6 不同AAPH浓度对表面疏水性的影响Fig.6 Effect of different AAPH concentrations on the surface hydrophobicity
由图6可知,表面疏水指数与AAPH浓度成反比。其原因可能是蛋白质氧化导致构象破坏、结构展开、疏水基暴露,疏水基相互作用形成聚集体,疏水指数下降;或者氧化作用使核桃蛋白的结构展开和重组,疏水基嵌入并形成新的亲水基团,疏水指数下降[18]。
3.7 蛋白质氧化对核桃氧化蛋白二级结构的影响

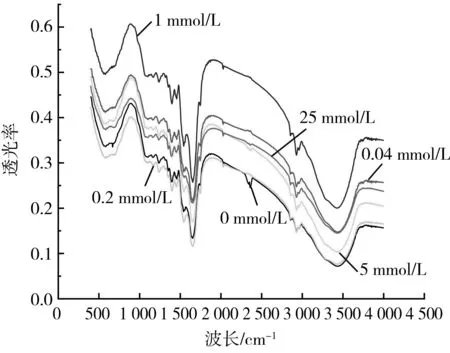
图7 不同AAPH浓度对二级结构的影响Fig.7 Effect of different AAPH concentrations on the secondary structure
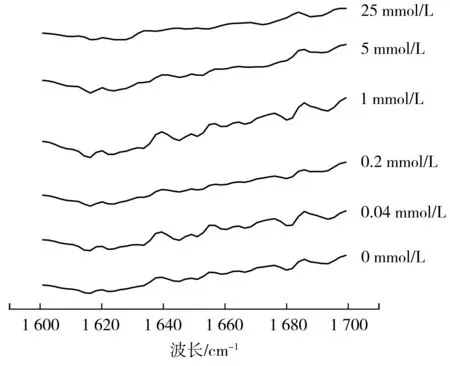
图8 不同AAPH浓度在酰胺I带处的影响Fig.8 Effect of different AAPH concentrations on the amide I band
由图7可知,不同AAPH浓度对红外谱图的走势没有大的影响,说明不同程度的蛋白质氧化并未改变核桃蛋白中的特定基团。对酰胺I带进行二阶求导,可以得到各个特征峰,其中1 612~1 641 cm-1处为β-折叠;1 641~1 656 cm-1处为无规则卷曲;1 656~1 664 cm-1处为α-螺旋;1 664~1 678 cm-1处为β-转角;1 678~1 687 cm-1处为β-折叠;1 687~1 700 cm-1处为β-转角[20]。
由图8可知,随着AAPH浓度的增加,图中的峰越发明显,说明蛋白质的氧化可以形成核桃蛋白聚集体,但当AAPH浓度达到5,25 mmol/L时,即高浓度氧化时,图谱发生变化,可能是因为高浓度氧化使得核桃蛋白肽链发生变化,破裂,结构进一步发生变化。
3.8 蛋白质氧化对核桃氧化蛋白内源荧光的影响
内源荧光光谱通常通过反映色氨酸残基的微环境变化来表示蛋白质的结构变化[21]。用芳香族氨基酸暴露的程度来表示荧光强度,并进一步反映蛋白质的三级构象变化,当芳香族氨基酸暴露较多时,荧光波长转移到长波长处;当更多发色团嵌入时,荧光波长转移到更短波长处[14]。不同AAPH浓度对核桃氧化蛋白内源荧光的影响见表3。
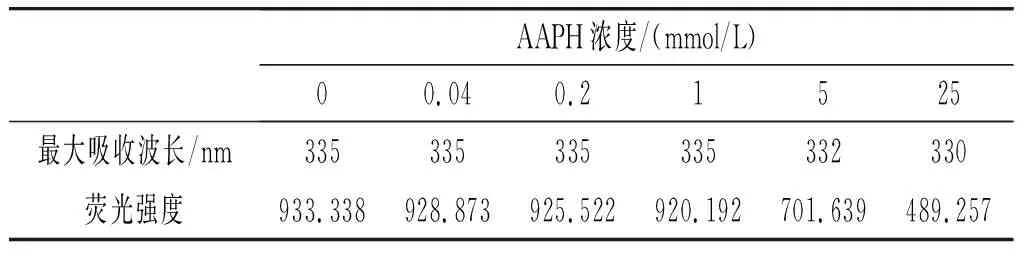
表3 不同AAPH浓度对内源荧光的影响Table 3 Effect of different AAPH concentrations on the endogenous fluorescence
由表3可知,当AAPH浓度低于1 mmol/L时,最大吸收波长均在335 nm处,随着AAPH浓度的增加,最大吸收波长发生蓝移,可能是因为随着氧化的加深,色氨酸发生转移,进入到更加疏水的环境中。当AAPH浓度增加时,荧光强度呈现持续降低的趋势,这可能是因为蛋白质中的烷过氧自由基发生反应,使得分子聚集在一起,色氨酸残基被包埋,显示不出来,也有可能是因为烷过氧自由基对色氨酸残基有荧光淬灭作用[22]。
4 小结
ROO·氧化改变了蛋白质结构。随着AAPH浓度的增加,巯基含量与表面疏水指数呈现降低的趋势,蛋白质构象被破坏,内部结构展开,发生结合,数值下降;回收率与溶解度均先上升后下降,都在1 mmol/L时达到最大值,说明低浓度氧化对核桃蛋白的回收率与溶解度都有一定的提升作用,但在高浓度氧化作用下,可溶性聚集物转化成不溶性聚集物,回收率与溶解度开始降低;由粒径结果可以看出,低浓度氧化时粒径变小,这是由于小的可溶性聚集体断裂,变成更小的小分子,随着氧化浓度的增加,粒径变大,可能是其中可溶性的部分通过共价交联和非共价聚集转变成不溶性物质;Zeta电位绝对值先升高后降低,说明适当的氧化使得核桃蛋白体系更加稳定;高浓度氧化时,吸引力大于排斥力,核桃蛋白体系分散被破坏;由红外光谱图可以看出,低浓度氧化可以形成核桃蛋白聚集体,所以图谱中的峰变得越发明显,而在高浓度氧化时,蛋白质肽链断裂,结构发生变化;由荧光结果可以看出,高浓度氧化时蛋白质最大吸收波长发生蓝移,蛋白质内部的色氨酸转移到更加疏水的环境中,荧光强度呈现持续降低的趋势,说明烷过氧自由基导致蛋白质分子发生聚集,蛋白质结构变化。
近年来,对于核桃的研究都围绕着的核桃蛋白进行,张雪春等[23]研究了没食子酸、儿茶素、杨梅素对核桃蛋白氧化稳定性的影响,经过氧自由基氧化后,核桃蛋白的功能性质下降,经过3种多酚干预后,一定程度上降低了核桃蛋白的氧化程度,其中儿茶素的效果最明显。张雪春等[24]建立了羟自由基氧化体系,对核桃蛋白结构的变化进行研究,结果表明适度的氧化可以改善核桃蛋白的乳化性能及起泡性能。孙领鸽等[25]采用不同浓度的丙二醛处理核桃蛋白,结果表明适度的氧化可以改变核桃蛋白的界面性质,过度氧化对核桃蛋白的泡沫性质产生负面影响。本研究表明ROO·氧化对核桃蛋白的结构产生了一定的影响,对核桃蛋白的综合利用及贮藏有一定的理论意义。

