藤茶黄酮对阿尔兹海默症作用机制的研究进展
颜潇娜,王泽,李荣芳
(湖南农业大学动物医学院,湖南长沙 410128)
阿尔兹海默症(Alzheimer’s Disease,AD),又称为老年痴呆症,现已成为严重危害全世界人类健康的重大神经退行性疾病,尤其是针对65岁以上的老年人发病,临床表现以记忆障碍、语言认知障碍、执行功能障碍以及人格和行为改变等全面性痴呆为特征,会随着年龄增长而出现特定的认知和功能衰退,最终导致死亡[1]。流行病学显示,随着当今世界人口老龄化的加剧,AD的发病率也在随之升高[2]。据相关统计,目前全世界每3 s就会确诊1例新的AD病例,并且平均每20年就呈翻倍增长的趋势[3],到2050年将达到1.52亿。AD严重影响个人生活质量,其治疗负担影响家庭和社会经济,据估计全球每年的成本为1万亿美元,给人类健康和社会经济带来严重威胁[4,5]。目前AD的发病机制尚不明确,但相关研究者已提出多种假说,主要包括β淀粉样蛋白(AmyloidβProtein,Aβ)沉积[6]、微管相关蛋白(Microtubule-Associated Protein Tau,Tau蛋白)异常磷酸化、氧化应激损伤、神经性炎症反应、乙酰胆碱酯酶(Acetylcholinesterase,AChE)活性升高等[7]。目前,有几类药物被批准治疗AD,它们分别为胆碱酯酶抑制剂和N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)拮抗剂以及靶向脑-肠轴的甘露特钠胶囊(代号:GV-971)。虽然前两类药物也是治疗药物,但它们只对AD的症状有轻微改善作用,并不能治愈[8,9],同时还可能产生头晕、头痛、意识混乱、腹泻和便秘等不良反应[10]。而GV-971能够有效地修复肠道微生物群,降低粪便和血液中氨基酸的异常浓度,并减缓大脑中与外周辅助型细胞(Helper T cell,Th细胞)中Th1细胞相关的神经炎症[11]。中国最近完成的3期临床试验中证明GV-971可以逆转轻度至中度AD患者的认知障碍,这是中国原创、国际首个靶向脑-肠轴的AD治疗新药,但与此同时,饶毅教授针对GV-971研发团队的“一种药物可以有这么多的靶点来治疗或缓解同一种疾病”等问题提出质疑,此药疗效尚存在不少争议[12]。
因此,近年来,许多研究人员另辟蹊径,试图寻找天然的、副作用小的、具有神经保护作用的抗氧化植物源性化合物,以期更好地治疗AD[13]。藤茶,葡萄科蛇葡萄属,是一种传统的可食用藤本茶叶和中草药。据中医古籍记载,藤茶具有清热利湿、活血通络的作用[14],经民间长期饮用实践和现代科学研究证实,藤茶黄酮具有抗氧化[15]、抗菌[16]、抗肿瘤[17]、抗炎[18]、保肝[19]等功效,被医学界誉为“血管清道夫”。也有研究表明,藤茶黄酮能够显著改善阿尔茨海默病动物模型的学习和记忆能力[20]。因此,本文将从藤茶黄酮抗Aβ沉积、抗氧化、抗炎以及抑制AChE的活性作用出发,阐述藤茶黄酮干预AD的作用机制,以期为其在功能性食品及保健品领域的开发和综合应用提供理论支持。
1 藤茶黄酮的主要成分及其生物活性
藤茶以泡茶和保健功效出名,目前已作为新资源食品投入使用,包括黄酮类、酚类、氨基酸类、多糖、甾体类、挥发油等成分[21]。藤茶中总黄酮含量极高,为银杏叶的110倍、蜂胶的45倍,素有“自然界植物黄酮大王”之称,主要包括二氢杨梅素(Dihydromyricetin,DMY)、杨梅素(Myricetin,MYR)、杨梅苷(Myricitrin)等(其结构式见图1)。DMY作为最主要的活性成分[22],具有抗氧化、抗炎和神经保护特性,并已被证明可以改善运动和记忆,所有这些都有助于治疗与大脑衰老有关的功能障碍和一些神经退行性疾病,如AD等[23]。MYR的生物学功效也非常多。据报道,MYR及其衍生物具有保肝护肝、镇痛抗炎、降血糖、抗氧化、抗肿瘤等多种生物活性[24,25]。杨梅苷是一种多酚羟基黄酮糖苷,在增加细胞的抗氧化能力、降低炎症因子表达、抑制细胞凋亡等方面发挥重要作用[26-28]。
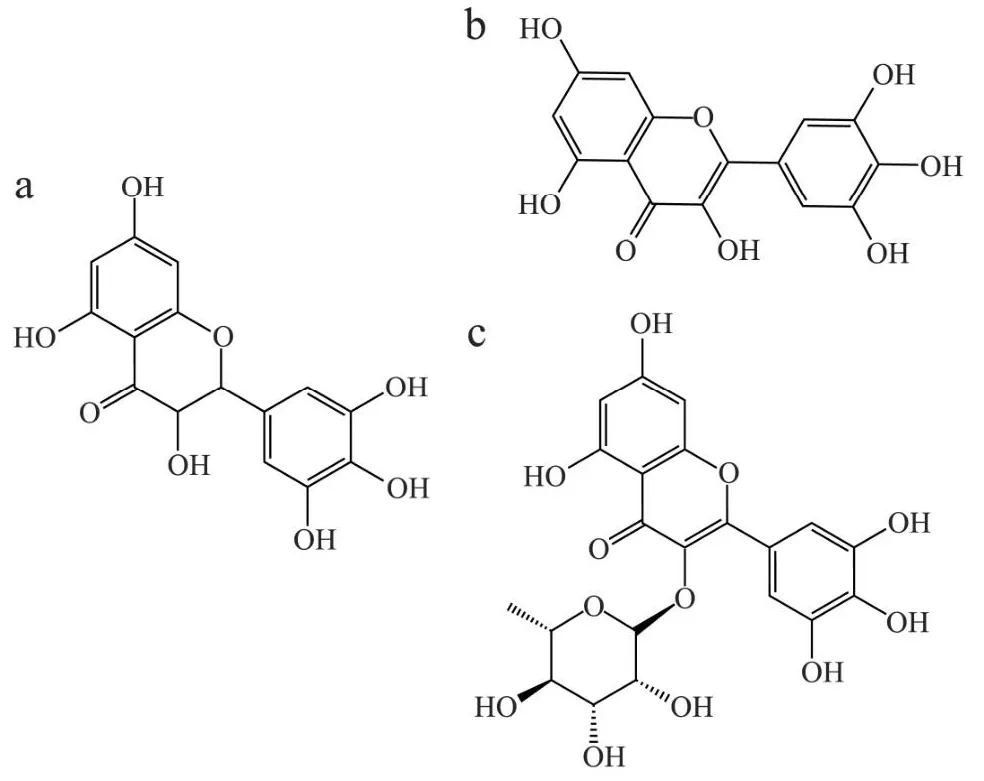
图1 二氢杨梅素、杨梅素、杨梅苷的分子结构式图Fig.1 The structures of dihydromyxin, myricetin and myricitrin
2 藤茶黄酮对阿尔兹海默症的主要作用机制
2.1 抗β淀粉样蛋白沉积作用
Aβ作为AD中三大病变之一老年斑的主要成分,是诱发AD的主要因素[29],也是其他脑部病变疾病发生的前提[30]。β淀粉样前体蛋白裂解酶(β-site Amyloid Precursor Protein Cleavage Enzyme-1,BACE-1)是其中的关键蛋白酶,参与淀粉样前体蛋白(β-amyloid Precursor Protein,APP)的水解,产生Aβ。而原纤维高分子量β淀粉样蛋白低聚体(High Molecular Weight Amyloidβ-protein Oligomer,HMW-Aβo)被认为是AD疾病修饰治疗的重要靶点[31-33]。
藤茶黄酮中的DMY可与β淀粉样蛋白40(Amyloidβ-protein 40,Aβ40)三聚体相互作用,通过破坏其分子内氢键,延迟聚合体的构象转化,抑制Aβ40的聚集,从而阻碍Aβ原纤维的形成,并且能够保护大鼠肾上腺嗜铬细胞瘤细胞12(Pheochromocytoma 12,PC12)细胞免受Aβ40诱导的细胞毒性[34]。同时,DMY因其分子结构具有特殊的空间构型,很容易与Cu2+发生络合配位[35],对Cu2+诱导的Aβ的沉积发挥抑制作用,同时解沉已形成的Aβ-Cu2+沉积物[36],对AD病变过程进行干预。而MYR也能够抗淀粉样变作用,一方面可优先和可逆地结合Aβ的淀粉样纤维结构[37],分离和破坏该结构[38];另一方面直接抑制BACE-1的活性,阻碍Aβ的产生[39]。小鼠体内研究也证实,MYR降低了大脑中Aβ低聚物的数量,并阻止了AD病理的发展[40]。另外,有实验研究了MYR对Aβ的抗聚集作用,结果表明,MYR通过与Aβ42结合可有效抑制Aβ原纤维的形成与扩展,降低Aβ寡聚物诱导所表现出的细胞毒性[41]。
2.2 抗氧化作用
自由基和氧化应激产生的细胞损伤被认为在AD的发病机制中发挥关键作用[42]。机体在代谢过程中会不断产生内源性过氧化物和自由基,正常生理情况下,低浓度的过氧化物和自由基能被机体抗氧化系统所清除;但当它们之间的平衡被破坏时则会产生氧化应激,影响氧化还原信号,导致细胞和组织损伤。Aβ可以明显增加神经元和脑组织脂质、核酸以及蛋白质的过氧化程度,促进大量过氧化物和自由基的生成[43],使细胞膜流动性和相关酶活性等性质发生改变,最终导致细胞死亡。另外,Aβ和APP的氨基端金属结合域中含有Cu2+和Fe3+等金属离子的高亲和力结合位点,Cu2+和Fe3+能加重AD的神经元损伤,诱导氧化应激[44]。因此,当人体内Aβ大量异常沉积时,会导致老年斑中大量的金属离子聚集并参与氧化过程,损害神经细胞的线粒体膜结构[45],加速神经细胞凋亡[46],使AD患者病情恶化[47]。
藤茶中黄酮类化合物DMY、MYR以及杨梅苷是天然的抗氧化剂[48],均具有较强的清除1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH)自由基的能力[49]。其中,DMY可显著影响细胞内超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)和过氧化氢酶(Catalase,CAT)水平以有效减轻细胞的氧化损伤[50];也可通过调节腺苷酸活化的蛋白激酶抑制氧化应激反应[51];其抗氧化活性甚至显著高于抗氧化剂叔丁基对苯二酚(Tert-Butyl Hydroquinone,TBHQ)[52]。MYR可通过增加细胞内SOD活性、降低丙二醛含量来维持细胞内氧化和抗氧化系统之间的平衡,降低谷氨酸对神经细胞的氧化应激反应[53];通过增加锰超氧化物歧化酶(Manganese-Superoxide Dismutase,Mn-SOD)和三磷酸腺苷生成,降低线粒体膜磷脂过氧化和膜通透性,增加膜流动性和膜阻力,提高线粒体膜电位,来抑制HMW-Aβo诱导的线粒体功能障碍,提供神经保护作用[54-56]。并且,MYR是抑制铜-β淀粉样蛋白1-20(Cuprum-amyloidβ-protein 1-12,Cu-Aβ1-20)对儿茶酚和多巴胺的有氧氧化的有效抑制剂,可降低活性氧对神经元造成的病理损伤[57];同时,MYR还是一种理想的铁离子螯合剂,可通过抑制转铁蛋白受体1的表达,提高抗氧化酶活性,降低脂质过氧化,从而改善小鼠的认知功能障碍[58]。这些结果表明藤茶黄酮可通过多种抗氧化功能抑制氧化应激反应,减少Aβ和活性氧的产生,发挥神经保护作用,有望开发用于治疗AD的新药[59]。
2.3 抗炎作用
研究认为,AD的发病机制与神经炎症密切相关。Aβ与神经小胶质细胞的相互作用在AD炎症机制中起着关键性作用。作为中枢神经系统中固有的免疫细胞,小胶质细胞可以吞噬和清除Aβ[60];但是,AD患者大脑皮质和海马体中过沉积的Aβ会反向引起小胶质细胞过度激活、增殖,并释放白细胞介素-1(Interleukin-1,IL-1)、IL-6和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)等炎症细胞因子[61-63],对周围神经元产生毒性,导致神经元变性[64]。并且,AD患者体内通常还同时伴有轻度的促炎辅助型T1细胞的増加以及抗炎辅助型T2细胞的相对减少[44]。此外,在Aβ的刺激下,小胶质细胞特异性核苷酸结合寡聚化结构域(Nucleotide-binding Oligomerization Domain,NOD)样受体蛋白3(Nod-Like Receptor Protein 3,NLRP3)免疫酶体被激活[65],促进AD中活性Caspase-1的产生[66]和炎症因子IL-1β、IL-18等的分泌,寡聚Aβ也可通过线粒体活性氧和还原型烟酰胺腺嘌呤二核苷酸磷氧化酶酸(Nicotinamide Adenine Dinucleotide Phosphate Oxidase,NADPH)衍生的活性氧的表达增加,诱导NLRP3和Caspase-1的高表达[67],最终导致细胞焦亡和神经细胞死亡[68]。另外,科学研究者对AD患者粪便中炎症相关肠道微生物丰度与血液中炎症细胞因子的表达水平进行了测定,发现其肠道内抗炎性菌群丰度降低,而促炎性菌群的丰度和炎症细胞因子水平都有明显升高[69]。研究表明,肠道微生物失调会导致Aβ沉积和脂多糖分泌,影响胃肠道的通透性和血脑屏障作用,从而调节炎症信号通路,引发神经元损伤和神经炎症,并最终导致AD神经元死亡[70]。
藤茶黄酮中的DMY、MYR和杨梅苷可调控相关抗炎因子,发挥神经性炎症保护作用。核转录因子κB(Nuclear Factor-κB,NF-κB)是一种可以控制细胞因子产生的蛋白复合物,参与包括炎症、细胞凋亡和血管生成炎在内的很多生理过程,而DMY被认为是一种有效的NF-κB抑制剂,能够抑制TNF-α的活化,下调炎症基因的表达[71]。同时,经研究证明由DMY包裹的纳米硒颗粒可以修复肠道屏障,并调节与炎症相关的肠道微生物平衡,参与下调NLRP3炎症小体的蛋白表达和炎症细胞因子的浓度,通过肠道微生物-NLRP3炎症小体-大脑轴改善神经炎症[72],这对研究DMY修饰药物进而改善AD神经炎症有一定的指导意义。除此之外,MYR可以抑制NLRP3炎症小体的组装、调节线粒体中活性氧的产生[73],并促进胶质细胞的分化和增殖以及海马齿状神经元的成熟[74],从而减缓AD进程。杨梅苷可以通过抑制NF-κB和激活蛋白-1(Activator Protein-1,AP-1)活性来调控下游基因蛋白的表达[75],进而减缓炎症因子的表达,达到缓解炎症的效果。
通过慢性给药D-半乳糖(D-galactosamine,D-gal)构建大鼠衰老模型可使动物表现出免疫反应差、学习和记忆缺陷等脑衰老迹象,而DMY可通过调节海马神经元的过度凋亡和自噬,以及星形胶质细胞的增生,来改善认知障碍和衰老[76]。另外,DMY能明显改善β淀粉样前体蛋白/早老蛋白-1(β-Amyloid Precursor Protein/Presenilin-1,APP/PS1)小鼠(一种阿尔茨海默病小鼠模型)的认知与记忆功能障碍,减少海马和皮层小胶质细胞的活化数量,从而在抗慢性脑部神经炎症疾病中发挥作用[77]。DMY可以显著抑制诱导型一氧化氮合成酶(Inductible Nitric Oxide Synthase,iNOS)和环氧合酶-2(Cyclooxygenase-2,COX-2)的表达,同时下调促炎细胞因子的表达[78];通过激活一磷酸腺苷(Adenosine Monophosphate,AMP)激活蛋白激酶(Adenosine 5’-Monophosphate (AMP)-activated Protein Kinase,AMPK)/烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD+)依赖蛋白修饰酶(NAD+-Dependent Histone Deacelyase,SIRT1)通路,抑制炎症反应和海马神经元凋亡,从而改善AD大鼠的学习缺陷与认知功能,为AD的临床治疗提供了新的靶点[79]。

表1 藤茶黄酮对AD不同作用机制的实验模型Table 1 Experimental models of different mechanisms of flavonoids from Ampelopsis grossedentata on AD
2.4 抑制乙酰胆碱酯酶(AChE)活性
早在1960年,研究人员就发现老年AD患者大脑中枢神经系统中ACh会显著降低,于是AD的胆碱能假说首次被提出。后续的实验研究证实乙酰胆碱(Acetylcholine,ACh)在动物学习和记忆等高级行为中发挥了关键作用[80]。胆碱能神经的失衡变性能够引发Aβ的沉积[81],而AChE能够直接与Aβ产生的关键酶位点早老素-1(Presenilin-1,PS-1)结合,进一步增加Aβ的沉积,从而导致患者严重的认知功能障碍[82]。中枢胆碱能的变性还能诱发Tau蛋白异常磷酸化、神经性炎症、细胞凋亡以及神经递质和神经激素调节失衡等多种病理现象[83]。根据该假说,现AD临床5种药物中有3种是AChE抑制剂,通过抑制AChE对ACh的水解作用[84],提高机体内ACh水平,从而减轻胆碱能神经的损伤[85]。有趣的是,黄酮类化合物DMY、MYR、杨梅苷对AChE活性均有一定的抑制作用[51,86]。体外研究表明,DMY是AChE的非竞争性抑制剂,可通过抑制小鼠脑内AChE活性来减轻胆碱能损伤[87]。也有研究发现MYR可以通过抑制AChE显著逆转东莨菪碱诱导的小鼠认知缺陷[58]。同时,由于IL-1等炎性因子可提高AChE水平,加速ACh分解[88],因此藤茶黄酮的抗炎作用也可间接降低AChE活性。
3 结语与展望
藤茶黄酮具有广泛的生物活性,其抗Aβ沉积和破坏Aβ纤维作用能有效干预AD的老年斑;其抗氧化作用可清除机体内代谢产生的过氧化物和自由基,减轻线粒体损伤,抑制氧化应激对脑组织的损伤;其抗炎作用可抑制NLRP3炎症小体的组装、调节线粒体中活性氧的产生并促进胶质细胞的分化和增殖,以及海马齿状神经元的成熟,通过抑制NF-κB和AP-1活性进而减缓炎症因子的表达,实现对神经性炎症和神经退化性疾病的干预;其对AChE活性的抑制作用可在一定程度上减轻胆碱能损伤和机体的认知功能障碍,同时抗炎作用能够间接降低AChE活性。以上说明藤茶黄酮在治疗人类衰老和神经退行性疾病方向有一定的临床意义。但目前国内外关于藤茶黄酮直接干预AD的深入研究仍较少,还需要进一步的研究来评估DMY等的临床潜力。例如,一些研究表明,DMY经胃肠道吸收后可穿透血脑屏障,且没有毒性作用,这表明它对大脑有正向影响,而不会产生毒性风险,需要更多相关研究来为此提供更有力的证据。虽然对藤茶黄酮影响大脑神经退行性疾病有了一定了解,但并不完全理解其神经保护机制以及神经元、胶质细胞直接干预AD的相关机制,例如,MYR能显著增加AD大鼠脑内海马体神经元的恢复以改善学习和记忆障碍,但内在机制我们尚不清楚。除此之外,衰老细胞也总是存在于衰老和神经退行性疾病中,需要知道藤茶黄酮是否可以作为调节细胞衰老过程的诱导剂。同时,DMY稳定性差、溶解度低、代谢吸收快,往往导致其生物利用度较低、药效低,限制了其潜在的药用价值。但相信随着研究的不断完善,AD的具体发病机制和DMY等藤茶黄酮具体生理活性机制也会愈加明确,这将对改善AD的研究有指导意义。
综上所述,藤茶黄酮有望作为改善AD的潜在天然化合物,具有很大的开发前景,并被认为是未来临床研究的候选药物。目前,市场对天然抗氧化剂仍有较大的需求,而藤茶黄酮提取成本低、毒性小,适合作为天然抗氧化剂进行研究,以期更多地开发出其潜在的药用价值,研发出能够预防或改善AD的功能性食品以及保健品并投入市场使用,以提高人类生命质量和健康水平。

