小肠结肠炎耶尔森氏菌分子生物学检测技术研究进展
钟月明,王涓,丁郁,吴清平,张菊梅,刘鸣,汪智
(1.华南农业大学食品学院,广东广州 510642)(2.广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,农业农村部农业微生物组学与精准应用重点实验室,广东广州 510070)(3.暨南大学理工学院食品科学与工程系,广东广州 510632)
小肠结肠炎耶尔森氏菌是一种革兰氏阴性杆菌或球杆菌[1],主要存在于牛奶及奶制品[2]、生肉[3]、家禽[4]、鸡蛋[5]、蔬菜和海鲜[6]中,具有“嗜冷性”,是在冷藏温度下能生长的少数致病菌之一[7]。同时,小肠结肠炎耶尔森氏菌是一种胃肠道病原体,经食物、水感染人类后可导致耶尔森氏菌病。这种致病菌的感染,不仅是导致人胃肠道疾病的因素之一,而且对呼吸系统、心血管系统、骨骼结缔组织等相关疾病的发生和发展也有一定的影响,有时也会导致败血症,甚至死亡[8]。2020年,欧洲食品安全局(European Food Safety Authority,EFSA)和欧洲疾病预防和控制中心(European Centre for Disease Prevention and Control,ECDC)有关耶尔森氏菌的报告指出,该致病菌所引起的耶尔森氏病是仅次于弯曲杆菌和沙门氏菌感染病的第三大最常见的人畜共患性疾病[9]。此外,本研究团队对我国食源性致病菌流行和污染的长期监测结果表明,小肠结肠炎耶尔森氏菌在全国多地的零售食品均有检出[10,11],应当引起大家重点关注。
小肠结肠炎耶尔森氏菌按照生化鉴定分为六种生物型,分别是1A、1B、2、3、4和5。除了第一种生物型1A以外,其他五种生物型的菌株均含有携带重要毒力基因的毒力质粒(pYV)。最常见的染色体编码毒力决定簇是ail,参与抵抗人类血清杀伤的抗性;ystA和ystB编码的酸热稳定肠毒素,可能会引起腹泻;inv对入侵宿主细胞至关重要[12]。另外,基于常规血清型分型,已鉴定出70多种小肠结肠炎耶尔森氏菌的血清型;基于脂多糖可鉴定常见的五种血清型分别是O:1,2、O:3、O:5、O:8、O:9,部分血清型如O:3、O:8、O:9被认为与人类疾病密切相关[13]。
目前,小肠结肠炎耶尔森氏菌的现有检测方法主要依赖生化反应,具体检测产品包括生化鉴定管、API鉴定试纸条等。常规检测方法主要是参照食品安全国家标准《食品微生物检验》GB 4789.8-2016进行分离鉴定[14]。虽然常规的分离鉴定方法仍然是目前检测该菌的主要方法,但是检测过程耗时费力(大约1周),而且不能准确地确定分离株是否具有致病性。此外,当病原体浓度较低时很难在复杂的样品环境中检测到。为了克服这些局限性,急需开发出更快速、灵敏、特异的分子生物学手段对小肠结肠炎耶尔森氏菌进行检测[12]。现在的分子生物学检测方法主要是基于小肠结肠炎耶尔森氏菌分子检测靶标来进行方法构建。已报道的小肠结肠炎耶尔森氏菌核酸检测靶标主要分为两类:一类是基于毒力基因的致病性小肠结肠炎耶尔森氏菌检测靶标,包括ail[15]、ystA、ystB、inv[16]和outL[17];另一类是基于保守基因的小肠结肠炎耶尔森氏菌种检测靶标包括16S rDNA[18]、tufA[19]、foxA[20]、phop[21]、gyrB[22]和FR729477 locus[23]。
本文将围绕近几年小肠结肠炎耶尔森氏菌基于多种检测靶标的分子生物学检测方法进行综述(图1),旨在为该致病菌即时检验(Point-of-Care Testing,POCT)的后续研究及发展提供理论依据和技术支持。
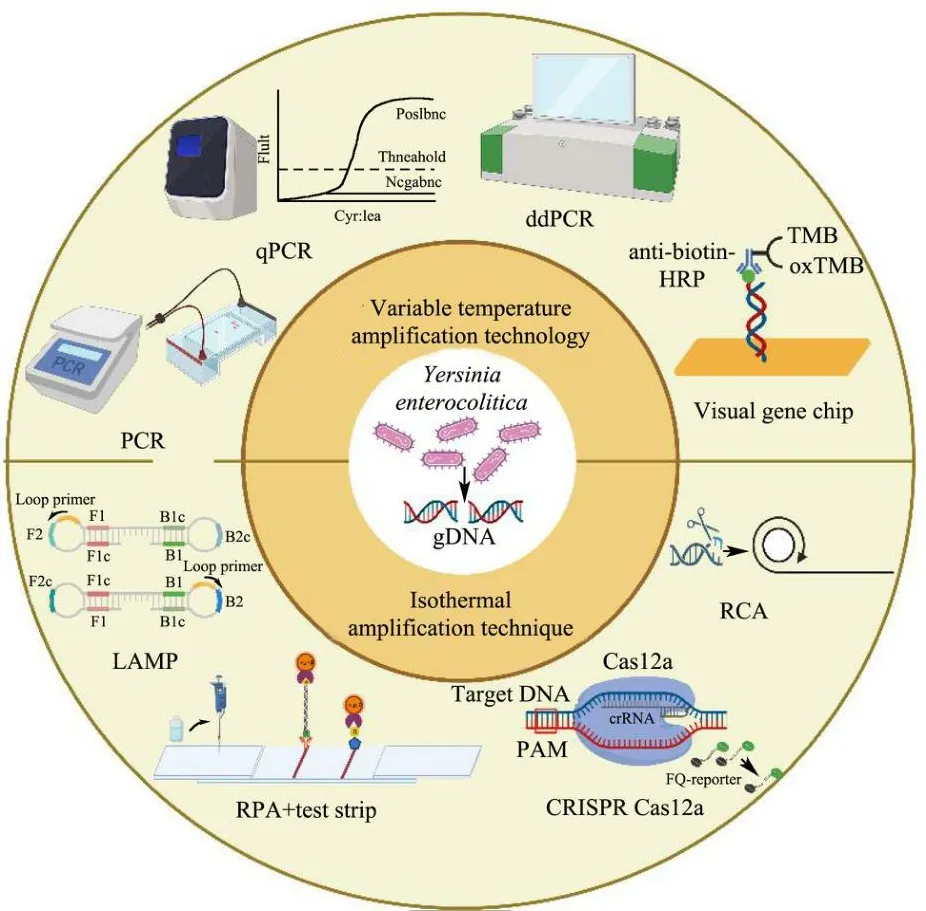
图1 小肠结肠炎耶尔森氏菌分子生物学检测技术的示意图Fig.1 Schematic diagram of the molecular biology detection technology of Y.enterocolitica
1 变温扩增技术
1.1 聚合酶链式反应
聚合酶链式反应(Polymerase Chain Reaction,PCR)是对特定区域DNA片段进行扩增的分子生物学技术[24]。它的最显著的特征是能够大规模地复制微量DNA,具有特异性强、灵敏度高、操作简便等特点。郑宇等[32]基于小肠结肠炎耶尔森氏菌靶标foxA、ail、ystA、ystB建立一种多重检测方法,并成功利用单重PCR方法和所建立的多重PCR方法对145份实际样品进行检测和分析。Bui等[15]利用多重PCR方法基于4种检测靶标(fyuA、ail、inv和virF)鉴别小肠结肠炎耶尔森氏菌致病性强弱。除鉴别该菌的致病性外,Rusak等[19]基于靶标rfbC构建双重PCR方法来快速鉴定小肠结肠炎耶尔森氏菌血清型O:3,这极大缩短了鉴定血清型的时间。相比于分离纯化和生化鉴定方法,虽然多重PCR方法能提高检测效率,但是该检测结果需要经过繁琐的电泳分析,且灵敏度有待进一步提高。
1.2 实时荧光PCR技术
荧光定量PCR(Quantitative Real-time PCR,qPCR)是利用特定荧光染色或荧光标记技术实时监测PCR产物,通过计算样品模板浓度,达到定量的目的[25]。为了实时监测小肠结肠炎耶尔森氏菌,国际ISO标准(ISO 10273:2017)规定了使用实时荧光PCR技术用于检测小肠结肠炎耶尔森氏菌[33]。Foley等[16]基于靶标yadA、ystB和inv通过多重qPCR熔解曲线分析检测不同生物型的小肠结肠炎耶尔森氏菌,用于605个临床样本检测,准确率达到99%。Shi等[34]基于抗OmpF抗体-免疫磁珠捕获该菌(捕获率达到80%),结合靶标foxA建立qPCR技术,能够检测人工污染猪肉样品中的小肠结肠炎耶尔森氏菌,灵敏度低至64 CFU/g。Liu等[35]基于多重qPCR定量检测包括小肠结肠炎耶尔森氏菌在内的12种常见病原体,结果表明不同病原体之间无交叉反应,能同时快速检测多个病原菌,具备高通量检测的潜力。目前基于小肠结肠炎耶尔森氏菌qPCR检测大多使用是荧光染色法(SYBR Green I)进行检测。该方法可与所有双链DNA结合,因此可能无法辨别出PCR产物中存在的引物二聚体等,从而给实验结果带来误差。未来,研究人员可通过小肠结肠炎耶尔森氏菌检测靶标来设计适用于qPCR检测的特异性荧光探针。
1.3 数字PCR
为了提高检测的灵敏度,数字PCR(Droplet Digital PCR,ddPCR)逐渐进入大众的视线,该反应体系能够实现核酸的绝对定量分析[26]。该技术将单个DNA分子分布到孤立的反应中,扩增后可以检测和分析带有荧光信号的产物。Cristiano等[36]利用qPCR和ddPCR用于评估小肠结肠炎耶尔森氏菌在不同温度下孵育11 d中污染绿叶蔬菜中的检测率,通过比较两种方法,结果只有ddPCR可以在以低于1 log CFU/g接种的样品中检测到,说明ddPCR灵敏度远远优于其它检测方法。但常规PCR、qPCR、ddPCR等检测方法往往需要专业的检测仪器,因此这些方法通常只用于实验室检测,不能广泛应用于现场检测。
1.4 基于变温扩增的生物传感器
以往报道显示,结合变温扩增和芯片的检测技术可以实现高通量可视化检测。胡瑞[27]将PCR反应变性后的单链产物与芯片上的荧光微球探针结合,利用两束激发光对待测物进行检测,结合软件分析即可直接获得检测结果,建立了对小肠结肠炎耶尔森氏菌等四种病原菌xMAP(Flexible Multi-Analyte Profiling)液态芯片方法。该检测技术能够对单通道多反应同时检测,具有多重、重复性好以及检测动态范围宽等优点。赵金毅[37]将PCR反应变性后的单链产物与芯片表面探针杂交之后,利用辣根过氧化酶(HRP)催化形成沉淀在芯片表面发生沉积,通过芯片颜色变化分析检测结果,建立了包括小肠结肠炎耶尔森氏菌在内的9种食源性致病菌的可视化基因芯片检测技术。该技术具有准确、高通量等特点。为了解决芯片制备成本高且检测过程繁琐等缺点,张宏伟等[38]利用PCR结合试纸条建立了一种快速检测小肠结肠炎耶尔森氏菌的检测方法。结果表明该检测体系灵敏度高(检测限为100CFU/mL),准确快速,可用于样品快筛。目前针对小肠结肠炎耶尔森氏菌的芯片制备技术尚未成熟,所以该检测技术未能广泛推广使用。
2 等温扩增技术
2.1 环介导等温扩增技术
环介导等温扩增(Loop-mediated Isothermal Amplification,LAMP)是一种灵敏度高、反应速度快、不受热循环仪器限制的恒温扩增技术[39,40]。该技术能针对靶基因的六个区域设计四种特异引物,在链置换DNA聚合酶的作用下,仅需15~60 min就能够将核酸的扩增量达到原来的109~1010倍[41,42]。Ranjbar等[23]基于新挖掘检测靶标FR729477 locus建立LAMP检测小肠结肠炎耶尔森氏菌的方法,结果表明该方法比PCR的灵敏度高10倍。徐云明等[43]基于靶标outL建立一种能够肉眼可视化检测小肠结肠炎耶尔森氏菌的LAMP方法。该检测体系只需增菌1 h,加标鸡肉检测限为700 CFU/g。虽然LAMP具有很多优点,但该反应体系的配制对环境条件要求严格,需要在无菌的超净台中操作,否则会因为气溶胶而导致假阳性,而且LAMP无法进行多重扩增,这限制了其在高通量检测方面的发展[28]。
2.2 滚环扩增技术
滚环扩增(Rolling Circle Amplification,RCA)是能在DNA聚合酶的催化下使用环状模板生成数千个重复的DNA序列[44,45]。与变温核酸扩增相比,RCA更适合现场检测[46]。张建等[31]用核酸外切酶Ι将小肠结肠炎耶尔森氏菌靶标16S rDNA序列由双链变成单链,然后锁式探针与模板单链结合延伸一周后,再进行下一个延伸。第二个延伸过程是在phi29聚合酶链置换条件下进行的,从模板上将扩增产物置换出来,用于扩增信号的检测,进而实现对小肠结肠炎耶尔森氏菌的检测。该方法在稳定性、特异性和灵敏度方面具有明显优势,具有很高的应用价值。与此同时,RCA也具有一定的应用弊端,即成本高、对实验人员的技术门槛要求高等[47]。主要原因是:①锁式探针直接合成成本以及phi29聚合酶成本高;②在实验的过程中,实验人员需要优化反应体系,以减少未成环锁式探针和未结合探针的模板所产生的背景信号对实验结果的影响。
2.3 重组酶聚合酶扩增
重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)主要有3种酶参与反应。1、重组酶:其主要作用是结合引物并对同源区域进行识别;2、单链结合蛋白:它能够结合置换出来的单链,以便于后续反应;3、DNA聚合酶:该酶能够在常温下催化延伸反应,以生成新的DNA链[48,49]。目前,该扩增技术所需的引物以及对应的反应条件,还需要实验人员进行摸索、设计和优化,适用于RPA技术的相关软件还有待于进一步开发。刘婧文等[49]建立的实时荧光RPA技术,具有成本低,操作简单,不受人员、仪器、场地等人为和环境因素限制的特点,为致病小肠结肠炎耶尔森氏菌快速初筛定性检测提供了数据支持和新的方向[50]。郑宇[29]将SYBR Green I和RPA结合荧光可视化检测小肠结肠炎耶尔森氏菌,构建了基于量子点检测探针的RPA结合试纸条检测体系,将该菌在实际样品中的检测也实现体温触发和快速可视化。此外,核酸等温扩增方法可通过结合不同方法实现信号放大,Xiao等[51]建立基于靶标ail的CRISPR/Cas12a-RPA体系来检测生猪肉中的小肠结肠炎耶尔森氏菌,检测限为1.7 CFU/mL,比qPCR灵敏100倍。本实验室此前成功开发了基于CRISPR/Cas12a的检测体系用于单增李斯特菌的检测[52,53]。
3 总结与展望
目前已报道的可用于小肠结肠炎耶尔森氏菌检测的方法有传统培养法,免疫学和分子生物学方法。传统培养法(例如使用CIN-1和改良Y琼脂培养基)对小肠结肠炎耶尔森氏菌进行鉴定,但这些方法繁琐、耗时、无法快速鉴定菌株是否具有毒性。而免疫学检测方法中所需特异性单克隆抗体制备过程周期长、成本高。因此,通过使用分子生物学方法来检测小肠结肠炎耶尔森氏菌成为主流。
在分子生物学检测方面,除了PCR、qPCR和LAMP检测方法较为成熟外,ddPCR、RPA、RCA、变温扩增的生物传感器等方法都有很好的应用前景,尤其是针对小肠结肠炎耶尔森氏菌的快速便携式检测,已开发的检测方法汇总于表1。值得注意的是目前该菌的检测和鉴定方法往往侧重于检测已知的致病菌株,而往往忽略生物型1A菌株。然而,生物型1A的菌株还存有潜在的未知风险,在检测过程中故意忽视可能导致调查或诊断结果出现偏差。因此建立基于特异性分子靶标的小肠结肠炎耶尔森氏菌快速检测方法是十分必要的。

表1 总结和比较小肠结肠炎耶尔森氏菌的分子生物学检测方法Table 1 Summary and comparison of molecular bioassays for Y.enterocolitica
此外,开发针对小肠结肠炎耶尔森氏菌血清型的检测方法也尤为重要。目前常用的血清型分型方法是玻片凝集法。然而,该方法需要5~8 d才能确定血清型,极大地阻碍了其应用。为了克服传统诊断血清型方法的不足,基于分子生物学检测方法已被开发,但仍存在一定局限性。例如血清型靶标覆盖率不高,因此还有更多小肠结肠炎耶尔森氏菌的血清型靶标有待开发。
针对小肠结肠炎耶尔森氏菌的检测已有较多检测方法的报道,但现有检测方法存在普遍问题有:检测设备昂贵、灵敏度不足、样品预处理复杂等。这些方法的不足就导致对大量且复杂的食品样品难以有效监测。因此现有的小肠结肠炎耶尔森氏菌检出率可能被低估。
未来小肠结肠炎耶尔森氏菌分子生物学检测的研究重点是种靶标和血清型靶标挖掘、新检测方法的开发验证。以期克服上述不足的同时为相关食品生产、零售和监管提供可切实可行的技术基础。

