锦带花组培快繁体系的建立
李得萍,许丁帆,何远秦,杨森茹,黄俊轩,刘艳军
(天津农学院 园艺园林学院,天津 300392)
锦带花(Weigela florida)为忍冬科(Caprifoliaceae)锦带花属(Weigela)丛生灌木植物。主要分布于我国黑龙江、吉林、辽宁等地区,其花色艳丽、叶色多变、抗逆性强,是北方重要的园林观花植物[1-3]。同时,锦带花还具有抑菌、抗流感、镇痛等多种药用功效[4-5],也可为纺织品染色[6],以及作为防火树种[7]。
锦带花因种子微小不易采集,且种子出芽率低,生产中极少采用播种法进行大规模繁殖。其种苗繁育多采用扦插、压条或分株等繁殖方法[8],但以上方法繁殖效率较低,且长期无性繁殖会导致病虫害的积累,影响苗木的质量。组培快繁技术具有速度快、繁殖系数大等优点,且能维持原有品种的优良特性,适应周年工厂化生产,使苗木繁殖不受自然环境中季节和恶劣气候的影响[9]。
目前,关于锦带花组培快繁方面的研究报道较多,前人在锦带花组培快繁研究中,一般先通过外植体诱导愈伤组织,进而分化出不定芽,采用不定芽再生的方式进行增殖[10-12]。然而愈伤组织诱导过程周期较长且可能产生变异[13],导致锦带花变异植株发生频率相对较高。本试验采用茎段为外植体,通过诱导腋芽萌发增殖的方式进行离体快繁,腋芽繁殖出来的后代遗传稳定性较高,以此建立一种高效且遗传稳定的锦带花组培快繁体系,为锦带花工厂化育苗奠定基础。
1 材料与方法
1.1 试验材料
供试材料为天津农学院东校区内生长健壮、无病虫害‘红王子’锦带花植株。
1.4 统计学方法 采用SPSS 20.0统计学软件进行处理。计量资料以x±s表示,采用配对t检验;计数资料采用χ2检验。以P<0.05为差异有统计学意义。
1.2 试验方法
外植体污染率(%)=污染外植体数/接种外植体数×100;
中国市场已经是浩亭最大的潜力之一,十几年来,中国客户需求的变化正呈现一个明显的趋势:以前对价格灵敏,现在更重视的是品质和服务,其次才是有比较优势的价格。马艾伦博士指出,“中国制造对品质的关注度已经接近日本客户的要求,中国市场的增长潜力将超过世界平均水平,中国市场增长潜力和速度变化很快,我们正是看到这个趋势,将与德国总部紧密合作,加大在生产、研发、销售网络方面的服务投入。”据悉,浩亭计划投资1.5亿元人民币在珠海扩建新工厂,预计3年内产能实现翻倍。
剪取植株上当年生新梢中上部茎段,每个茎段带有1~2 个腋芽。用70%乙醇溶液浸泡30 s,无菌水冲洗30 s,再分别采用含有效氯1%、2%、4%的次氯酸钠溶液消毒,消毒时间设置为5、10 min,消毒后无菌水冲洗3 次,每次冲洗10 min,再用无菌滤纸吸干外植体表面水分,并剪去外植体两端褐化部分,分别接种至MS、MS+125 mg/L羧苄青霉素培养基上。试验重复3 次,每个处理接种10 瓶,每瓶接种3 个外植体。15 d 后观察并统计不同处理的外植体污染率、腋芽萌发率及腋芽生长情况。
随着当今社会的不断发展,学校对生物学科的学习是非常重视的,生物学科的学习不仅可以帮助学生培养学习的能力,也可以为同学打开一所与外界沟通的桥梁.在生物教学的学习中,应该培养学生的核心素养,日后不近可以帮助学生对生物知识的学习,还可以培养学生的思考能力,高中生物教学的基本内容主要包括:引导学生正确看待生物科学和把生活与生物合理的进行运用和联系,因此,这三个方面培养对学生的生物学习有着非常重要的意义.
采用Excel 统计数据,并用SPSS20.0 分析软件进行显著性分析。
平均株高(cm)=同一处理株高之和/外植体数;
Te=150 nm,t=20 nm,Dn=25 cm2/s,α和β分别取自参考文献[22]和[23]。
振威展览的主营业务是作为展会的主办方或承办机构,具体负责整体策划、市场营销、展台搭建、招展招商、现场组织等工作,收入来源则是展位费、广告宣传费、展会承办费、展台搭建费、会议服务费等。
将锦带花组培苗作为外植体,将其剪成2~3 cm 小段,每个茎段带有2 个腋芽,接种到不同的增殖培养基上。增殖培养基以WPM 为基本培养基,添加不同质量浓度的BA 和IAA,7 种增殖培养基分别为:WPM;WPM+0.5 mg/L BA;WPM+1 mg/L BA;WPM+2 mg/L BA;WPM+0.5 mg/L BA+0.5 mg/L IAA;WPM+1 mg/L BA+0.5 mg/L IAA;WPM+2 mg/L BA+1 mg/L IAA。每个处理接种15 瓶,每瓶接种3 个茎段。30 d 后观察并统计每种处理增殖系数、增殖芽平均高度及增殖芽生长情况。
1.2.3 锦带花的增殖培养
1.2.4 培养条件
以上培养基均采用7 g/L 琼脂粉,30 g/L 蔗糖,pH 值5.8~6.0,培养温度(25±2)℃,光照强度2 000~2 500 lx,连续照明。
1.2.5 数据统计及方法
1.2.1 锦带花的外植体消毒
将肉泥分为4组,每组5份,每份10 g,每份添加0.03 g食盐和0.005 g山梨酸钾,每组肉泥添加一类发色剂,浓度分别为0.002%,0.004%,0.006%,0.008%,0.010%。烘烤温度180 ℃,时间15 min。采用色差计测定成品肉脯的红度值a*。
腋芽萌发率(%)=萌发外植体数/接种外植体数×100;
将萌发后长至1.5~2.0 cm 的腋芽从外植体上切下,取生长状况一致的组培苗接种到不同种类的初代培养基上。初代培养基分别采用MS、B5、WPM、Anderson、White 为基本培养基。每个试验处理接种15 瓶,每瓶接种3 个腋芽,试验重复3次。30 d 后观察并统计不同基本培养基中锦带花平均株高、平均茎粗及腋芽生长情况。
平均茎粗(cm)=同一处理茎粗之和/外植体数;
由表1 可知,随着次氯酸钠质量分数和消毒时间的增加,外植体污染率逐渐减小,外植体腋芽萌发率逐渐上升,但并非质量分数越高越好,使用4%次氯酸钠消毒10 min 后,在植株死亡的情况下MS 培养基仍出现外植体污染,污染率为10%,均为细菌污染,考虑是植株内生菌所造成。因此在处理组中加入质量浓度为125 mg/L 的羧苄青霉素进行试验,2%次氯酸钠消毒10 min 消毒效果最好,外植体污染率1.67%,腋芽萌发率98.3%。由此可知,次氯酸钠浓度过高会对植物产生毒害作用,从而影响其正常生长,甚至死亡。综合考虑外植体污染率和腋芽萌发率,最适合消毒方法为:2%次氯酸钠溶液消毒10 min,接种到MS+125 mg/L 羧苄青霉素培养基中。
1.2.2 锦带花初代培养基筛选
适中院二班生徒,多戏迷者。乃就校舍中所悬粉板,大书特书其向日所读 《新闻报》戏广告之戏目。因之有人提议,不如即在校内演习。诸生均极赞成,即于是晚演六君子(戊戌政变纪事)。当时并无后台化装之室,更无预定脚本,即今日新剧所谓幕表者。同校他班诸生,来参观者,均赞美不置。自此一演之后,遂兴致勃勃,即于次晚又将小说《经国美谈》排演。当时排演情形,殊属可笑,一面将小说阅看,一面即付演习。事虽草率,而大致不错。故再接再厉,又连演一晚。至第三晚参观者更众,即教员亦均列席。同校生来者,均预购洋烛,持赠演员,以助膏火。演员乃取洋烛尽燃,室内通明如白昼焉。[5]38
2 结果与分析
2.1 不同消毒处理方法对外植体消毒效果的影响
增殖系数=有效芽数/接种新梢数(有效芽为芽高≥1 cm)。
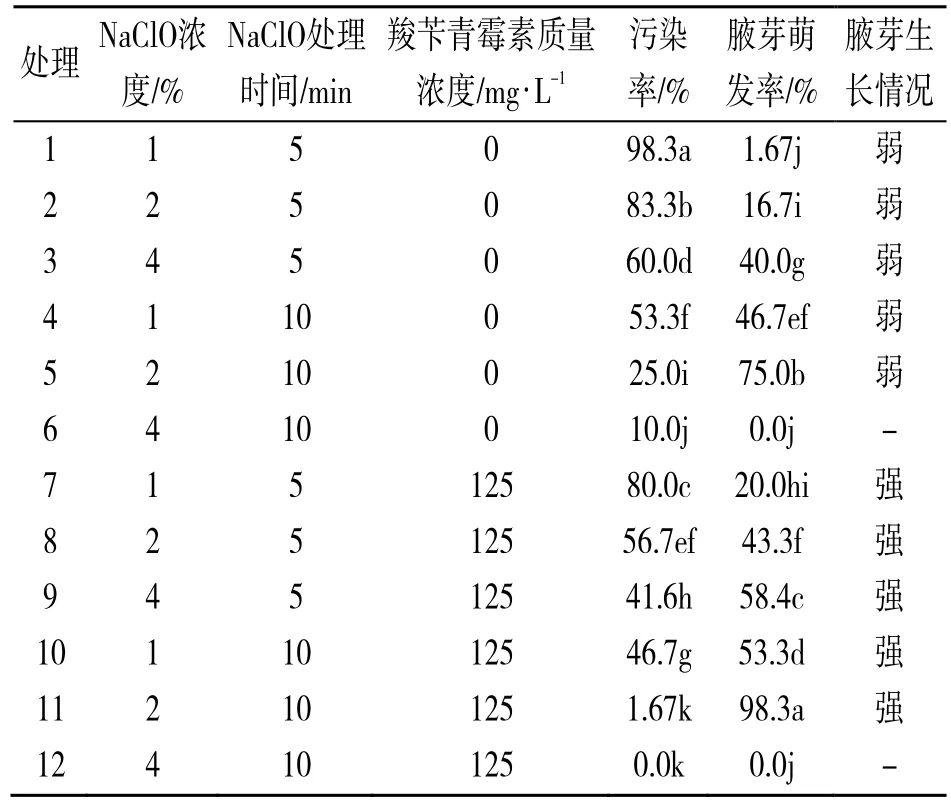
表1 不同消毒处理方法对锦带花消毒效果的影响
2.2 不同基本培养基类型对锦带花生长的影响
由表2 可知,锦带花腋芽在5 种基本培养基中生长30 d 后,其平均株高、茎粗均差异显著(P<0.05),其中Anderson 培养基中长势最弱,平均株高0.6 cm,平均茎粗2.50 cm,显著低于其他4 种培养基中的水平,不适于锦带花组培苗木的生长;基本培养基为MS 和B5 时,其平均茎粗没有显著性差异,显著高于Anderson 和White 培养基所培养组培苗,但显著低于WPM 培养基所培养的组培苗,且植株生长情况一般;当基本培养基为WPM 时植株平均株高和平均茎粗均显著高于其他基本培养基培养,且植株生长势较强。综上所述,WPM 基本培养基最适合锦带花组培苗生长,培养30 d 后,植株的平均株高为5.58 cm,平均茎粗1.7 cm,植株生长旺盛,生长情况较强(图1)。
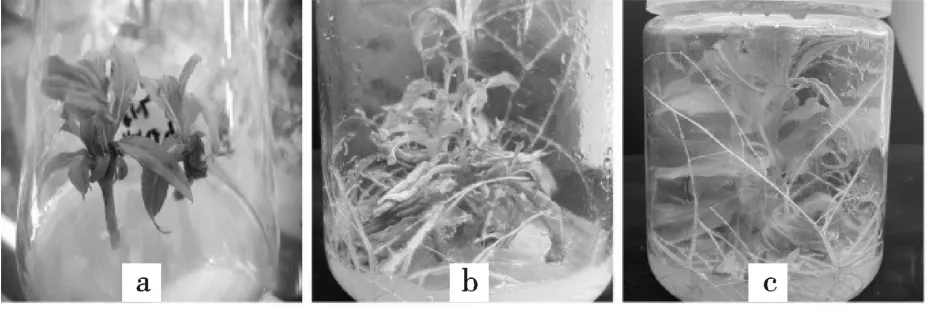
图1 ‘红王子’锦带花组织培养和快速繁殖
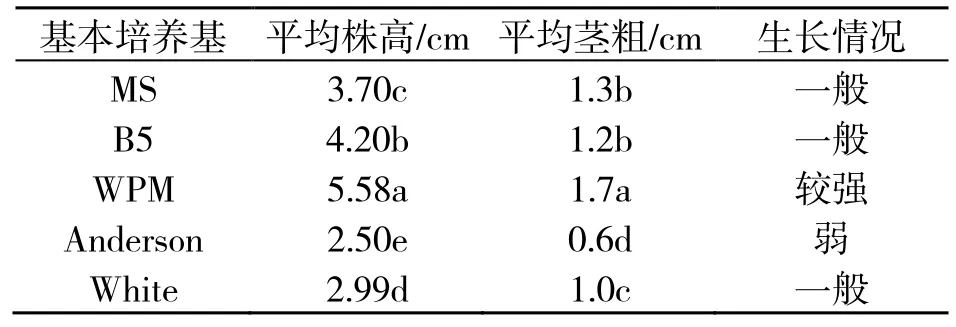
表2 不同基本培养基类型对组培苗生长的影响
2.3 不同激素质量浓度配比对锦带花增殖培养的影响
不同激素处理对锦带花增殖影响不同。由表3可知,当单独加入BA 时,各处理的增殖系数均大于对照组ck,随着BA 质量浓度的增加,增殖系数由高到低再升高,当BA 质量浓度达到1.0 mg/L 及以上时生长势减弱并出现玻璃化,增殖芽的平均高度逐渐下降。因此,单独添加BA 时,0.5 mg/L 的质量浓度条件下增殖效果最好,增殖系数3.9,增殖芽平均高度1.8 cm;在同时添加BA与IAA 时,各处理的增殖系数、增殖芽平均高度进一步提升,均大于未加IAA 的处理组,其中添加1.0 mg/L BA+0.5 mg/L IAA 的增殖效果最好,增殖系数为8.0,增殖芽高度为1.7 cm,生长势强且未出现玻璃化。其次是添加0.5 mg/L BA+0.5 mg/L IAA 的处理组,增殖系数为6.9,增殖芽高度为3.2 cm,增殖芽平均高度显著高于其他处理;2.0 mg/L BA+1.0 mg/L IAA 条件下效果最差,增殖芽平均高度低于对照组,可见此条件并不适用于锦带花腋芽增殖生长。因此,综合考虑得出,‘红王子’锦带花最适的增殖培养基为WPM+1.0 mg/L BA+0.5 mg/L IAA。

表3 不同增殖培养基对锦带花增殖培养的影响
3 讨论与结论
植物组织培养过程中,外植体消毒是建立锦带花组培快繁体系的关键步骤。前人多采用升汞进行锦带花外植体消毒[14-18],但升汞有剧毒、易残留,且管制较严不易获取,而次氯酸钠使用较为安全。本试验采用次氯酸钠溶液作为消毒液,使用2%次氯酸钠溶液消毒10 min 后,将外植体接种到含125 mg/L 羧苄青霉素的MS 培养基上,其污染率为1.67%,腋芽萌发率达98.3%,且腋芽生长势强。
在锦带花外植体消毒试验结果中发现,使用2%次氯酸钠消毒10 min 后接种到MS 培养基中其消毒效果并不理想,污染率达25%,然而在提高次氯酸钠溶液有效氯浓度后,外植体出现死亡现象,并且仍存在细菌污染现象,推测为锦带花植株内生菌所造成,因此试验采用添加抗生素的方法来抑制内生菌污染。通过在培养基中添加125 mg/L 羧苄青霉素后,锦带花茎段污染率显著低于未加羧苄青霉素的处理组。黄俊轩等[19]在北美海棠脱菌组培试验中,使用含有250 mg/L 羧苄青霉素和50 mg/L 卡那霉素的MS 培养基取得了理想的内生菌抑制效果。侯淑婧等[20]在花叶锦带花组织培养试验中,在初代培养基中添加480 mg/L 羧苄青霉素也有效抑制了花叶锦带花内生菌的污染。因此,抗生素在组培中对植株脱菌以及生长具有明显的促进作用,而其抗生素浓度使用差异可能与取材植株的生理状态、外植体的取材部位及老嫩程度等有关,在试验前应先进行预试验来确认使用抗生素的浓度范围。
本试验得出WPM 基本培养基更适合锦带花组培苗生长,这一结论与多位学者不一致[15,21]。WPM 培养基是经过MS 培养基改良后的低盐培养基,主要用于木本植物的培养,因此,对于锦带花组培苗的培养也适用。B5 培养基是一种低盐培养基,也有利于锦带花组培苗的生长,且生长效果优于高盐MS 培养基培养,因此,锦带花适合较低盐培养基培养。Anderson 培养基研制之初主要用于牡丹属植物组织培养[22-23],锦带花属植物培养没有相关报道,本试验结果也表明,锦带花在Anderson 培养基中生长效果最差,不适合生长。
增殖培养常用的增殖方法有不定芽增殖和腋芽萌发增殖[24-25]。不定芽增殖通常需脱分化形成愈伤组织,再经过再分化过程形成不定芽。而在诱导愈伤组织过程中,一般会使用大量的外源植物激素促使外植体脱分化,且愈伤组织脱分化与再分化过程中,其过程复杂,激素浓度使用不当时可能会导致组培苗遗传变异的产生。本研究采用诱导腋芽萌发增殖的方式进行离体快繁,这种方式具备遗传稳定性较高、成苗速度快等优点。
本研究以锦带花带腋芽茎段为外植体,通过不同的消毒方式获得无菌苗,筛选适合锦带花组织培养的基本培养基和合适的增殖培养基,通过腋芽萌发的方式初步建立起了锦带花组培快繁体系。试验结果显示,外植体最佳消毒方法为2%次氯酸钠溶液消毒10 min 后,接种至添加125 mg/L羧苄青霉素的MS 培养基中,此方法外植体污染率仅1.67%,萌发率可达98.3%;初代培养最适基本培养基为WPM,组培苗平均株高可达5.58 cm,茎粗1.7 cm;最适增殖培养基为WPM+1.0 mg/L BA+0.5 mg/L IAA,增殖系数8.0,增殖芽高度1.7 cm,生长势强且未出现玻璃化现象。

