菠萝蛋白酶的提取纯化工艺研究
梁雪 方欢乐 刘建利

摘 要:为降低环境污染,提高菠萝蛋白酶的附加值以及延长菠萝的产业链,以菠萝废弃物为原料,采用盐析浓缩-透析提纯-乙醇有机溶剂沉淀相结合的方法提取菠萝蛋白酶。实验考察料液比、缓冲液温度、搅拌时间、缓冲液pH值、盐析浓度以及透析时间对菠萝蛋白酶酶活性和酶活回收率的影响。结果表明,菠萝蛋白酶的最佳工艺条件为料液比1.0∶1.5(m∶v)、缓冲液温度30 ℃、搅拌时间40 min、缓冲液pH值7、盐析浓度30%和透析时间28 h,该条件下菠萝蛋白酶酶活回收率为68.45%。
关键词:菠萝蛋白酶;盐析法;透析提纯;有机溶剂沉淀
Abstract: In order to reduce environmental pollution, increase the added value of bromelain, and extend the industrial chain of pineapple, a method combining salt precipitation concentration dialysis purification ethanol organic solvent precipitation was used to extract bromelain from pineapple waste as raw material. The experiment investigated the effects of material liquid ratio, buffer temperature, stirring time, buffer pH value, salting out concentration, and dialysis time on bromelain enzyme activity and enzyme recovery rate. The results showed that the optimal process conditions for bromelain were material to liquid ratio of 1.0∶1.5(m∶v), buffer temperature of 30 ℃, stirring time of 40 minutes, buffer pH of 7.0, salt out concentration of 30%, and dialysis time of 28 hours. Under these conditions, the recovery rate of bromelain enzyme activity was 68.45%.
Keywords: bromelain; salting out; dialysis purification; organic solvent precipitation
菠蘿蛋白酶为白色至淡棕黄色无定形粉末,是我国目前大规模生产的植物蛋白酶之一[1]。菠萝俗称凤梨,是重要的水果之一。菠萝成熟之后,除果实之外,大部分皮渣被丢弃,造成了资源浪费。本文以菠萝废弃物为原料,提取菠萝蛋白酶,不仅可以降低环境污染,还能提高菠萝蛋白酶的附加值以及延长菠萝的产业链。
菠萝蛋白酶能分解酰胺、酯、肽和蛋白质等进行各种生化反应,因此在食品、医药、美容以及畜牧生产方面有着重要的作用[2-5]。近年来,国内外科研工作者对菠萝蛋白酶的提取纯化方法进行了大量的研究,旨在寻找酶活回收率以及蛋白质含量较高的工艺。传统的提取纯化方法有高岭土吸附法、单宁沉淀法以及超滤浓缩法[6-13]。其中,高岭土吸附法和单宁沉淀法具有操作烦琐、酶活回收率低以及环境污染较大等缺点。超滤浓缩法虽然会掺杂较多其他蛋白,但其操作简单,无污染,因此被广泛使用。目前,出现了越来越多的新方法,如双水相(ATP)萃取、反胶束萃取、离子交换色谱层析法以及固定化金属离子亲和色谱等[14-18]。新方法虽然能提高酶活回收率,但不适合大规模生产,故需要进一步优化。
本实验以菠萝废弃物为原料,从中提取菠萝蛋白酶,并对影响菠萝蛋白酶提取纯化的各个因素进行优化,从而得到菠萝蛋白酶的最佳提取纯化工艺。
1 材料与方法
1.1 材料与试剂
菠萝废弃物:水果超市收集;L-酪氨酸(BR):天津市光复精细化工研究所;三(羟甲基)氨基甲烷、冰醋酸、三水醋酸钠、三氯乙酸、乙二胺四乙酸二钠、盐酸、硫酸铵、95%乙醇、L-半胱氨酸均为分析纯。
1.2 仪器与设备
HH-2数显恒温水浴锅:金坛市华峰仪器有限公司;H-1600A高速离心机台式:上海立鑫坚离心机有限公司;752型紫外可见分光光度计:上海舜宇恒平料学仪器有限公司;DF-101S集热式恒温加热磁力搅拌器:郑州科丰仪器设备有限公司;SL-250型高速多功能粉碎机:浙江省永康市松青五金厂。
1.3 实验方法
1.3.1 提取
取一定质量的菠萝加工下脚料,洗净,晾干,放入榨汁机中,加适量Tris缓冲液搅拌,汁液用200目的纱布过滤,备用。
1.3.2 纯化
采用盐析浓缩-透析提纯-乙醇有机溶剂沉淀相结合的方法对菠萝蛋白酶进行纯化。取滤液加入硫酸铵粉末,边加边搅拌,搅拌至完全溶解,静置,待蛋白酶沉淀完全,将含有沉淀的蛋白酶溶液于1 600 r·min-1离心30 min,然后在得到的蛋白酶沉淀中加入BaCl2进行透析,取透析液加有机乙醇沉淀即得。
1.3.3 酶活测定
菠萝蛋白酶酶活性采用F.I.P法[19]。准确移取2.5 mL底物溶液于15 mL比色管中,并置于35 ℃水浴中调温后,再加入2.5 mL经预热的酶溶液,混合均匀,精确保温10 min后,立即加入5.0 mL蛋白质凝固剂,终止反应。此后将样品继续放在水浴中静置30 min,过滤。用紫外可见分光光度计在275 nm波长下,测定其吸光度,空白值的做法为在加入蛋白质凝固剂之后再加酶溶液。菠萝蛋白酶酶活性定义为在规定条件下[(35±0.20)℃,pH=7],每分钟水解酪蛋白释出的三氯乙酸可溶物肽在275 nm下测得的吸光度与1 μmol酪氨酸(相对分子量为181.20)所产生的吸光度相等。酶活回收率按公式(1)计算。
酶活回收率=条件改变后的总酶活/条件改变前的总酶活×100%(1)
1.4 单因素试验设计
1.4.1 料液比
缓冲液温度为30 ℃,搅拌时间为40 min,缓冲液pH值为7,盐析浓度为30%,透析时间为28 h,研究料液比(m∶v)(1.0∶1.1、1.0∶1.3、1.0∶1.5、1.0∶1.7、1.0∶1.9和1.0∶2.0)对菠萝蛋白酶酶活回收率的影响,确定最佳料液比。
1.4.2 缓冲液温度
搅拌时间为40 min,缓冲液pH值为7,盐析浓度为30%,透析时间为28 h,料液比为1.0∶1.5,研究缓冲液温度(10 ℃、20 ℃、30 ℃、40 ℃、50 ℃和60 ℃)对菠萝蛋白酶酶活回收率的影响,确定最佳缓冲液温度。
1.4.3 搅拌时间
缓冲液温度为30 ℃,缓冲液pH值为7,盐析浓度为30%,透析时间为28 h,料液比为1.0∶1.5,研究搅拌时间(10 min、20 min、30 min、40 min、50 min和60 min)对菠萝蛋白酶酶活回收率的影响,确定最佳搅拌时间。
1.4.4 缓冲液pH值
缓冲液温度为30 ℃,盐析浓度为30%,透析时间为28 h,料液比为1.0∶1.5,搅拌时间为40 min,研究缓冲液pH值(4、5、6、7、8和9)对菠萝蛋白酶酶活回收率的影响,确定最佳缓冲液pH值。
1.4.5 盐析浓度
缓冲液温度为30 ℃,透析时间为28 h,料液比为1.0∶1.5,搅拌时间为40 min,缓冲液pH值为7,研究盐析浓度(10%、20%、30%、40%和50%)对菠萝蛋白酶酶活回收率的影响,确定最佳盐析浓度。
1.4.6 透析时间
缓冲液温度为30 ℃,盐析浓度为30%,料液比为1.0∶1.5,搅拌时间为40 min,缓冲液pH值为7,分别在6 h、10 h、14 h、18 h、24 h、28 h、32 h、36 h观察沉淀的消失时间,确定最佳透析时间。
2 结果与分析
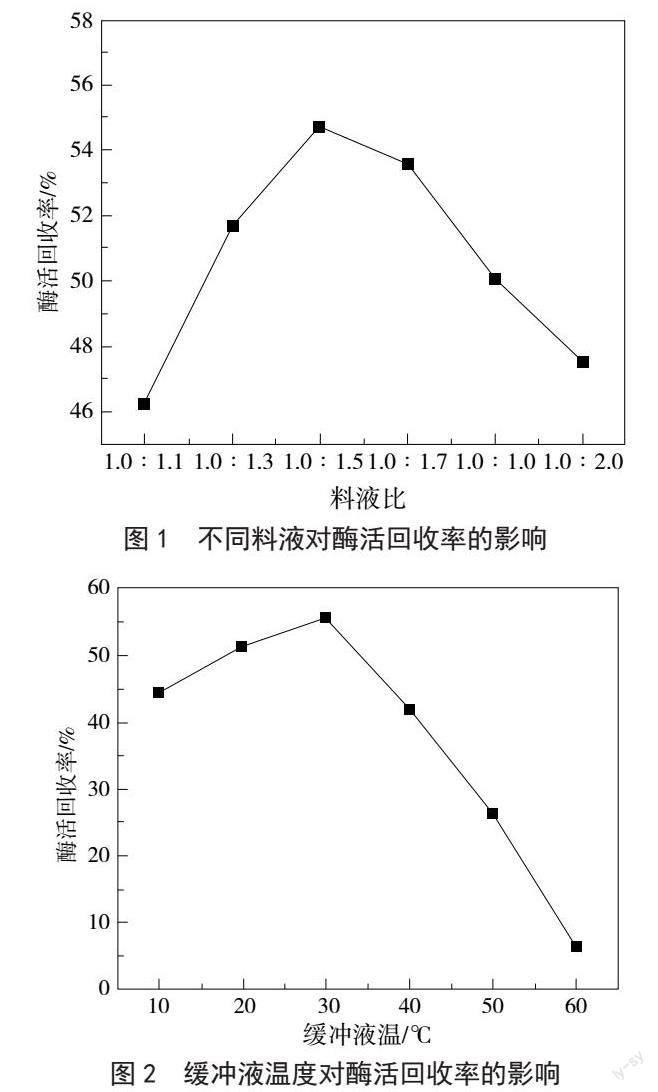
2.1 料液比对菠萝蛋白酶酶活回收率的影响
由图1可知,料液比对酶活回收率有明显影响,酶活回收率随着提取液的增加而出现先上升后降低的趋势,当料液比为1.0∶1.5时,酶活回收率达到最高。故料液比为1.0∶1.5为最佳料液比。
2.2 缓冲液温度对菠萝蛋白酶酶活回收率的影响
由图2可知,缓冲液温度对酶活回收率有明显影响,酶活回收率随着缓冲液温度的升高呈先上升后下降的趋势。缓冲液温度为30 ℃时,酶活回收率最高,为最佳缓冲液温度。缓冲液温度高于30 ℃时,菠萝蛋白酶活性受损,菠萝蛋白酶酶活回收率迅速下降;缓冲液温度低于30 ℃时,酶活回收率随着温度的升高而增大。故在实验时必须合理控制缓冲液的温度,以保证菠萝蛋白酶活性。
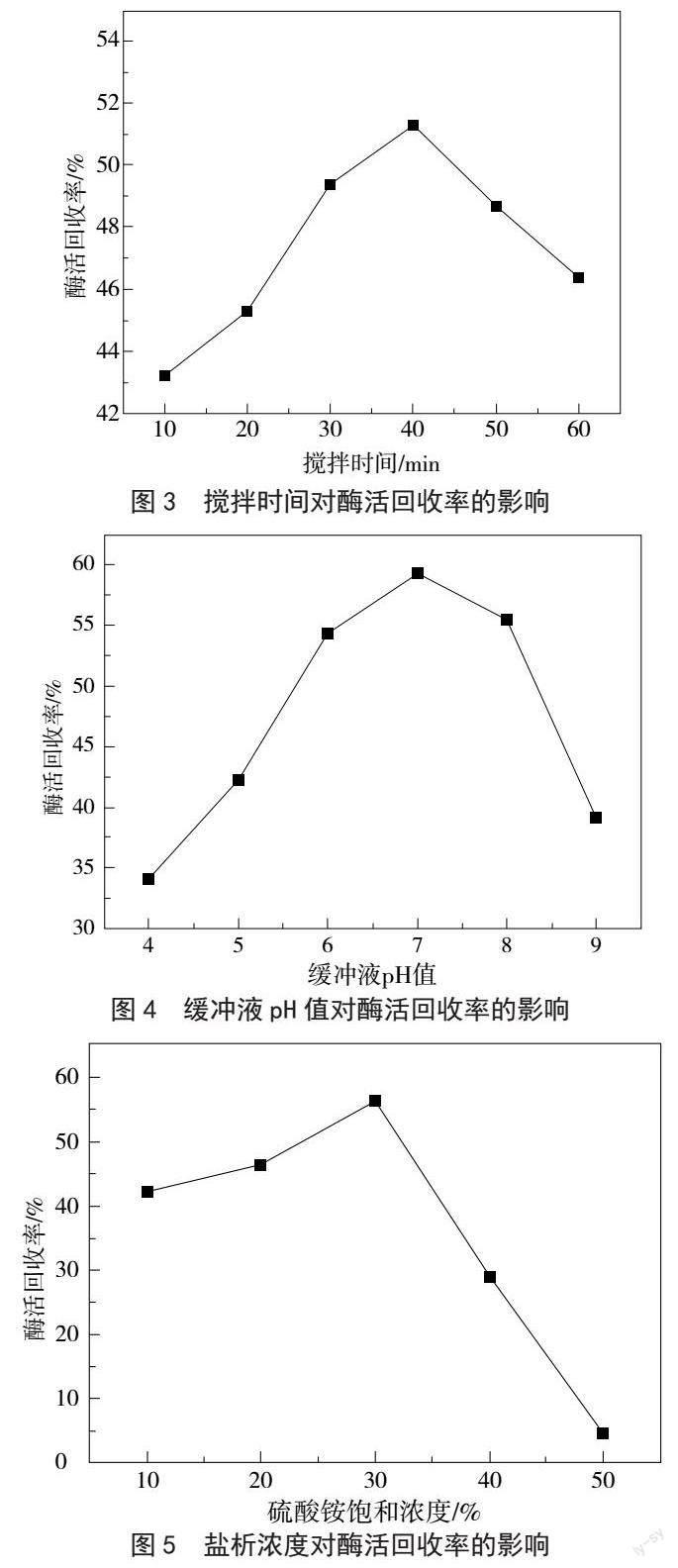
2.3 搅拌时间对菠萝蛋白酶酶活回收率的影响
由图3可知,搅拌时间小于40 min时,酶活回收率随着搅拌时间的延长而逐渐升高,搅拌時间大于40 min时,酶活回收率随着搅拌时间的延长而降低,搅拌时间为40 min时,酶活回收率最高。故搅拌时间40 min为最佳搅拌时间。
2.4 缓冲液pH值对菠萝蛋白酶酶活回收率的影响
由图4可知,缓冲液pH值对酶活回收率有明显影响,酶活回收率随着缓冲液pH值的增大呈先上升后下降的趋势。缓冲液pH值小于7时,酶活回收率随着缓冲液pH值的增大而增大,缓冲液pH值大于7时,酶活回收率随着缓冲液pH值的增大而减小,缓冲液pH值为7时酶活回收率达到峰值。故缓冲液pH值为7是最佳缓冲液pH值。
2.5 盐析浓度对菠萝蛋白酶酶活回收率的影响
由图5可知,盐析浓度对酶活回收率有明显影响,酶活回收率随着盐析浓度的增大呈先上升后迅速下降的趋势。盐析浓度为30%时,酶活回收率最高,为最佳盐析浓度;盐析浓度小于30%时,酶活回收率随着盐浓度的增大而升高,但相对平缓;盐析浓度大于30%时,盐析浓度过高,菠萝蛋白酶活性受损,开始失活,酶活回收率迅速减小,故实验过程中必须合理控制硫酸铵饱和浓度。
2.6 最佳透析时间的确定
由表1可知,透析时间低于28 h时,菠萝蛋白酶的透析外液均有沉淀析出,透析时间高于28 h时,菠萝蛋白酶的透析外液中几乎观察不到沉淀,故确定透析时间28 h为最佳透析时间。
3 结论
通过实验可知,料液比、缓冲液温度、搅拌时间、缓冲液pH值以及盐析浓度均对菠萝蛋白酶酶活回收率有较大的影响。提取菠萝蛋白酶的最佳工艺条件为料液比1.0∶1.5、缓冲液温度30 ℃、搅拌时间40 min、缓冲液pH值为7.0、盐析浓度为30%饱和硫酸铵溶液、最佳透析时间28 h,此条件下菠萝蛋白酶的回收率为68.45%。此工艺条件除具有菠萝蛋白酶活性较高的优点外,还具有环境污染小、能耗低以及能够规模化生产等优势。本次研究对于提高菠萝整果的利用率、提升其附加值至关重要,能够为菠萝蛋白酶的产业链发展奠定坚实的基础,对今后菠萝蛋白酶的进一步研究与发展具有重要意义。
参考文献
[1]吴茂玉,马超,乔旭光,等.菠萝蛋白酶的研究及应用进展[J].食品科技,2008(8):17-20.
[2]吴鑫颖,邱树毅,凌秀梅.啤酒废酵母酶法制备生物活性肽的工艺研究[J].酿酒科技,2008(2):110-113.
[3]BAHDE R,PALMES D,MININ E,et al.Bromelain ameliorates hepatic microcirculation after warm ischemia[J].Journal of Surgical Research,2006,139(1):88-96.
[4]CHOBOTOVA K,VERNALLIS A B,MAJID F A A.Bromelains activity and potential as an anti-cancer agent:current evidence and perspectives[J].Cancer Letters,2010,290(2):148-156.
[5]林晨,李诺,韩琦.菠萝蛋白酶的药用功能及其在畜牧业的应用前景[J].中國畜牧兽医,2005(1):14-16.
[6]王燕,赵力超,陈洁兰,等.菠萝蛋白酶工业化提取工艺的改良及酶学性质研究[J].食品工业科技,2011,32(10):353-357.
[7]王平诸,孙君社,李魁.菠萝蛋白酶三种生产工艺的比较[J].河南化工,2002(7):1-3.
[8]刘凤瑶,廖劲松,齐军茹,等.木瓜蛋白酶与菠萝蛋白酶的产业开发[J].食品工业科技,2008(7):289-293.
[9]田欣,张艺凡.菠萝蛋白酶的提取及应用[J].食品安全导刊,2017(33):121.
[10]胡莉娟.提取菠萝蛋白酶工艺的研究[J].陕西林业科技,2009(3):20-21.
[11]马超,吴茂玉,宋烨,等.吸附结合超滤技术制备高活性菠萝蛋白酶的工艺研究[J].中国食品学报,2009,9(6):116-120.
[12]韩志萍,黄茂芳,静玮,等.超滤分离纯化菠萝蛋白酶的研究[J].食品工业科技,2013,34(8):282-286.
[13]万婧,王明繁.蛋白酶的纯化方法及其研究进展[J].粮食与食品工业,2012,19(4):38-40.
[14]徐长波,王巍杰.双水相萃取技术研究进展[J].化工技术与开发,2009,38(5):40-44.
[15]COELHO D F,SILVEIRA E,JUNIOR A P,et al.Bromelain purification through unconventional aqueous two-phase system (PEG/ammonium sulphate)[J].Bioprocess and Biosystems Engineering,2013,36:185-192.
[16]蔡云凤.双水相浮选体系的设计构建及其在分离纯化菠萝蛋白酶和融合β-葡萄糖苷酶中的应用研究[D].镇江:江苏大学,2019.
[17]万静.Gemini阳离子表面活性剂反胶束液液提取菠萝皮中菠萝蛋白酶的研究[D].扬州:扬州大学,2016.
[18]董瑞兰.菠萝蛋白酶的分离纯化及部分应用性质的研究[D].福州:福建农林大学,2010.
[19]梁宏宇.菠萝蛋白酶提取方法的研究[D].南宁:广西民族大学,2012.

