河鲀毒素及其在河鲀体内积累研究进展
张瀚元,李卫东,张海恩,刘英杰
(1.中国水产科学研究院农业农村部水生动物基因组学重点实验室,北京 100141;2.唐山海都水产食品有限公司河北省海水鱼产业技术研究院,河北 唐山 063000)
河鲀肉质鲜美,营养丰富,是我国重要的特色海水养殖鱼类,但因体内含有毒性极强的河鲀毒素(tetrodotoxin,TTX),一度成为禁食鱼类。2016 年9月5 日,农业农村部和国家食品药品监督管理总局联合下发了《关于有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀加工经营的通知》。红鳍东方鲀(Takifugu rubripes)和暗纹东方鲀(Takifugu obscurus)是我国河鲀的两个主要养殖物种,成为首批有条件放开的河鲀物种。有条件放开是指消费者食用的河鲀应当是有经备案的河鲀鱼源基地加工企业加工后,可追溯、有检验合格证的产品。被检河鲀产品的TTX 含量以鲜品计不得超过2.2 mg/kg。随着我国养殖河鲀市场的有条件放开,河鲀产业的发展迎来新的机遇和挑战。近几年河鲀产量位居我国海水鱼养殖产量前十位[1];我国也是世界上最大的养殖河鲀生产国,占全球养殖总量的88%[2],具有巨大的发展潜力。但TTX 的毒素来源和机制不清晰,致使食用河鲀仍存在一定的安全隐患。TTX 广泛分布于多种不同进化水平的生物中,是一种钠离子通道类海洋神经毒素。近年来,关于河鲀TTX 来源和积累的研究已有一定进展,为深入研究河鲀积累代谢TTX 的调控机制提供了理论基础。本文综述了TTX 的特征分布、检测方法、毒性机制及其在河鲀体内积累的研究进展,展望了今后的研究方向,为防控养殖河鲀TTX 积累提供参考。
1 TTX 的特性、分布和检测方法
1.1 TTX 的理化特性
TTX 是一种氨基全氢喹唑啉化合物的海洋生物神经毒素,分子量小、生物活性高、毒性强、作用机理独特。TTX 的分子结构复杂,含有笼形原酸酯结构,碳环中的每个碳原子均具有不对称取代(图1)。TTX 呈弱碱性,微溶于水和浓酸,极易溶于稀酸溶液,不溶于无水乙醇、乙醚、苯等有机溶剂。其纯品为无嗅无色固体结晶,易吸湿潮解,在环境温度下稳定,在碱水溶液中易分解,在80 ℃~100 ℃、浓度5%的氢氧化钾溶液中可分解为无毒的C9 碱,即2-氨基-6-羟甲基-8-羟基-喹唑啉[3]。
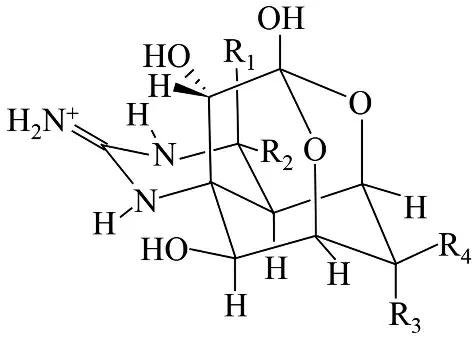
图1 河鲀毒素的基本结构[4]Fig.1 Basic structure of tetrodotoxin
TTX 与其天然存在的衍生物共存,目前已报道的TTX 结构衍生物有20 余种[5],且新的衍生物种类仍在不断被发现[6],常见的衍生物种类见表1[4]。TTX 及其衍生物的毒性大小与分子中羟基的数量和位置有关[7]。羟基在衍生物中的氢键供体作用,其更易与钠离子通道结合,使羟基衍生物的毒性比TTX 更高,11-oxoTTX 的毒性是TTX 的4~5 倍[8]。而TTX 的脱氧衍生物,如 5-deoxyTTX 和5,6,11-trideoxyTTX 等,其羟基数量较少降低了与钠离子通道的结合能力,毒性低于TTX。TTX 及其衍生物在含毒动物体内可同时存在数种,衍生物多来自于TTX 的代谢或生物合成[9]。
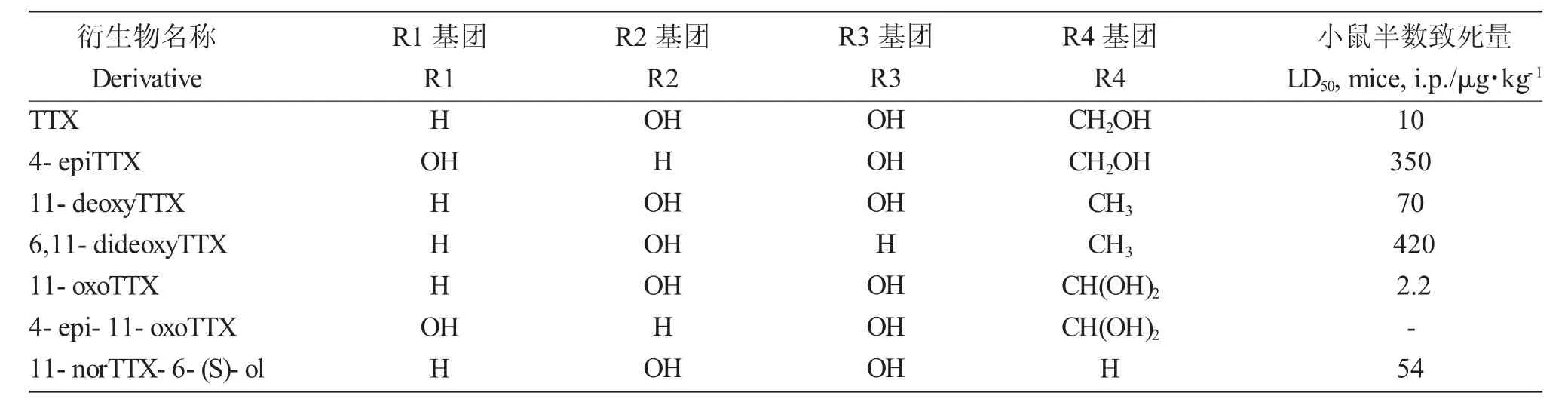
表1 河鲀毒素的常见衍生物种类[4]Tab.1 Common derivatives of tetrodotoxin
1.2 TTX 的分布
TTX 最早于1964 年在鲀科鱼类中被发现,因此被命名为Tetrodotoxin[10]。随后几十年,在一系列不同进化水平的生物如藻类、寄生虫、软体动物、甲壳动物、棘皮动物、两栖动物等体内都发现了TTX及其衍生物[11],含TTX 的代表性生物见表2。不同生境条件下河鲀的TTX 含量差异显著,河鲀的种间、种内、性别、个体和组织器官间TTX 含量都存在显著差异[12]。Jang 等[13]发现,河鲀体内的TTX 主要蓄积于肝脏和卵巢,但肌肉、血液及其他组织器官中也能够检测到。在河鲀的组织器官中,毒素含量较高的为肝脏和卵巢,其次是脾脏、血液和皮肤,精巢和肌肉中的毒素含量较低[14,15]。
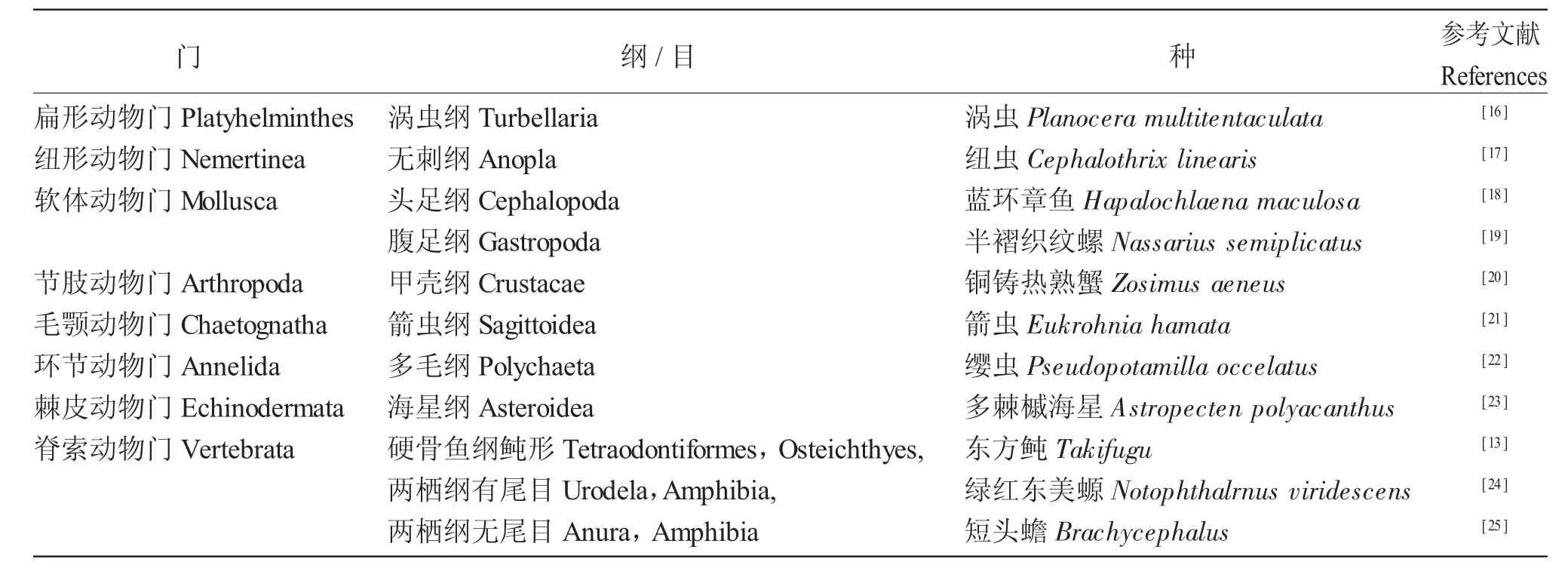
表2 含TTX 的代表性生物分布Tab.2 The distribution of representative organisms with tetrodotoxin
1.3 TTX 的检测方法
根据我国现行的食品安全国家标准[26],TTX 检测方法主要有小鼠生物法(Mouse Bioassay,MBA)、酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)、液相色谱-荧光检测法(liquid chromatography-fluorescence,LC-FLR)和液相色谱-串联质谱法(liquid chromatography tandem mass spectrometry,LC-MS/MS)。MBA 法应用广泛、方法直观、操作简便,是中国和日本等国家检测TTX 含量的公认方法。但该方法的重复性差、灵敏度低,与TTX 共存的无机盐或疏水大分子氨基酸可明显降低TTX的相对毒力,导致结果偏低。ELISA 法是免疫检测法的一种,基于抗原抗体的高度特异性结合和酶的高效催化作用,对样品中的TTX 进行定性或定量分析,广泛应用在食品安全领域。采用我国现行标准ELISA 法测定TTX,检出限可达3 μg/kg,定量限为10 μg/kg。ELISA 法特异性强,基于该方法开发的试剂盒,适用于养殖场、水产品市场TTX 的现场快速检测。液相色谱法(liquid chromatography,LC)是一种常用的仪器检测方法,也是分析领域最广泛使用的技术手段之一。荧光检测法(fluorescence,FLR)是较早建立的定量检测TTX 的仪器分析方法。该法原理是:TTX 经强碱水解生成的荧光衍生物在一定范围内与TTX 浓度呈良好的线性关系,可通过测定衍生物含量来定量分析TTX。LC-FLR 法测定TTX 检出限为50 μg/kg,定量限为150 μg/kg。受方法原理所限,该法需要将TTX 衍生后才能测定,前处理较复杂,检出限偏高。LC-MS/MS 法与LC-FLR 法相比,不需要进行衍生化即可测定TTX。现行国标测定标准LC-MS/MS 法测定TTX,检出限可达1 μg/kg,定量限为3 μg/kg。该法灵敏度高、选择性好,适用于测定复杂样品基质中的痕量TTX 残留,也可用于其他检测方法检出阳性样品的二次验证[27]。除以上介绍的四种国标检测法外,还有离体组织法、组织培养法、生物检测器法、免疫层析法、荧光分光光度法和色谱法等多种TTX 检测方法。
2 TTX 的作用机制
2.1 TTX 对非耐受动物的致毒机制
TTX 是典型的神经钠离子通道阻断剂[28]和“门控调控毒素”中的一种,通过阻遏神经和肌肉的传导发挥毒理作用[29]:毒素被机体吸收进入血液后,能够高度特异性地与钠离子通道受体结合,抑制可兴奋膜电压依赖性钠离子通道的开放,抑制产生动作电位,使神经肌肉迅速丧失兴奋性,导致以神经和肌肉麻痹为主要代表的生理机能障碍,严重时可导致血管运动神经和呼吸神经中枢麻痹而死亡[30]。TTX 的活性基团是1,2,3 位的胍氨基和C-4,9,10 位的羟基,胍基在生理pH 下质子化形成的正电活性区域,与钠离子通道受体蛋白的负电性羟基相互作用,阻碍离子进入通道[31]。TTX 对神经细胞的钠离子通道敏感性比对心肌和骨骼肌的钠离子通道敏感性要高很多,且只阻滞可兴奋细胞膜的电压依赖性通道,对静息电位、静息膜电位和延迟整复等作用不明显[32]。基于其作用机制,在医学上已将TTX用于镇痛、麻醉、抗癌、心血管疾病、神经障碍等多种疾病治疗的研究[33,34]。
2.2 TTX 耐受动物的免疫机制
河鲀对TTX 的免疫耐受是长期自然选择的结果[35],这也使河鲀在生理功能上产生了相应的适应性进化。多项研究表明,TTX 在河鲀体内的积累可能具有多种生理行为功能,如作为对捕食者的天然防御、繁殖季节的交配引诱剂、对受精卵和幼鱼的天然防护以及压力缓解物质等[36-38]。河鲀对TTX 的免疫耐受主要取决于其毒素结合位点的一个氨基酸突变[39]。TTX 结合位点位于钠离子通道内高度保守的P-loop 成孔区。该区域内含有与TTX 高度亲和的芳香性氨基酸。在TTX 非耐受动物体内,钠离子通道的α 亚基上存在TTX 受体,当摄入TTX后,毒素与其门孔附近的氨基酸残基结合,阻止钠离子进入细胞内,引起中毒。而具有毒性的鲀科鱼类,在该区域发生了芳香性氨基酸向非芳香性氨基酸的置换,显著影响了与TTX 结合的灵敏度,从而大幅降低TTX 对河鲀钠离子通道的影响。对红鳍东方鲀、绿河鲀(Tetraodon nigroviridis)和斑马鱼(Danio rerio)的基因序列图谱的比较发现,该置换发生在Nav1.4 通道的401 位点,取代为一个折叠程度更高的不饱和氨基酸[40]。对豹纹东方鲀(Takifugu pardalis)骨骼肌Nav1.4 通道cDNA 的研究发现,取代的不饱和氨基酸为天冬酰胺。将该不饱和氨基酸通过基因工程方法移植到小鼠骨骼肌Nav1.4 通道处,随着移植的不饱和氨基酸折叠程度增高,小鼠耐受TTX 的能力也相应提高[41]。最近,Li 等[42]研究发现,麻痹性贝类毒素(Paralytic shellfish toxin,PST)的致毒机理与TTX 相同,双壳贝类的免疫耐受位点也与河鲀Nav1 中相似(图2),反映出河鲀和双壳贝类在面对钠离子通道海洋生物毒素压力选择了分子水平的趋同进化。
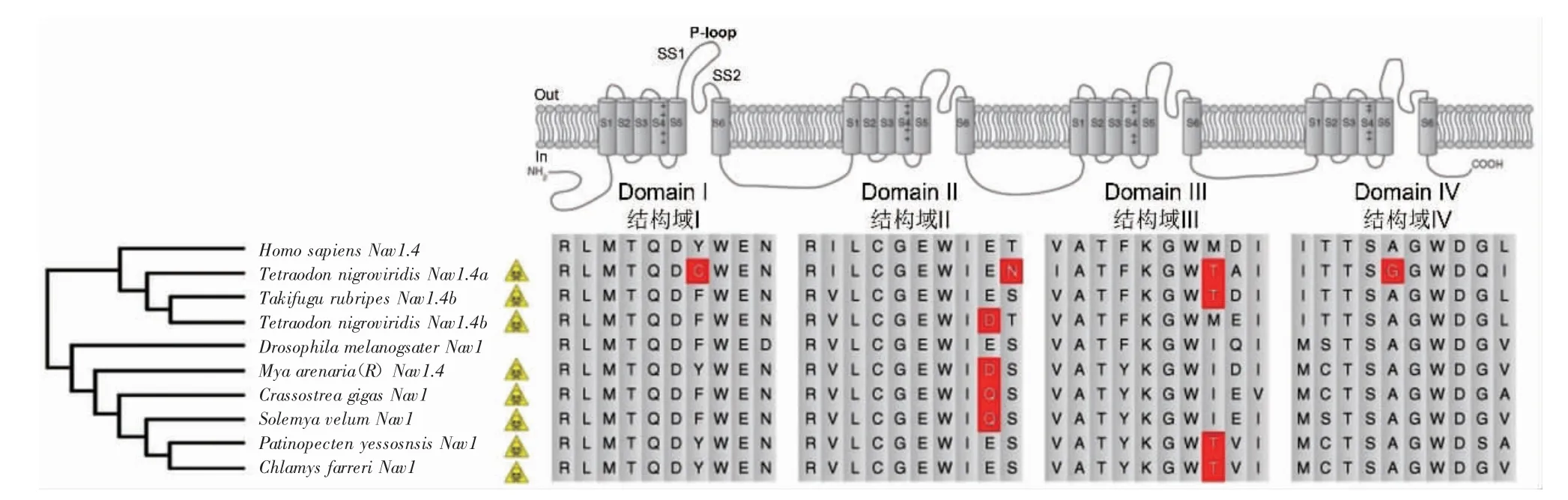
图2 海洋动物钠离子通道Nav1 具有TTX 或PST 抗性的氨基酸位点(红色高亮)[42]Fig.2 Amino acids resistant to TTX or PST in sodium channel Nav1 of marine animals(highlighted in red)
3 河鲀体内TTX 的积累途径
从产TTX 细菌的多样性和含TTX 生物在海洋中的广泛分布来看,TTX 的产生、积累、转运和转化具有十分复杂的机制。曾一度认为TTX 是由河鲀产生的,随着TTX 在不同物种中被陆续发现,TTX 的起源问题受到更多毒理学家和海洋生物学家的关注[43]。在研究的不断深入中逐渐形成了三种假说:外源性假说、内共生起源假说和内源性假说[44,45]。
3.1 通过食物链积累TTX
外源性假说认为,河鲀通过食物链在体内富集TTX[46]。Noguchi 等通过对河鲀进行一系列毒素蓄积、脱毒和毒素分离试验后,提出了河鲀体内TTX是通过食物链富集积累而非由其自身产生的观点:作为TTX 生产者的海洋细菌在生长过程中分泌和积累毒素,被小的浮游生物、食腐生物等初级消费者摄入后,在扁虫、纽虫、织纹螺、扇蟹、海星等次级消费者体内进一步富集,最终被食物链上游的河鲀大量摄食并在体内高浓度的积累[47]。此后,Itoi 等发现,无毒河鲀在饲喂含TTX 饵料一段时间后,能够将TTX 有效积累到特定组织中,验证了河鲀体内TTX 含量能够随着饲喂有毒饵料而迅速积累[48,49]。Zhang 等[50]给暗纹东方鲀投喂含毒和去毒饵料饲喂,对其体内毒素的积累和消除具有直接作用,且皮肤和肝脏的积累效率最高。胃灌TTX 实验结果表明,TTX 最初通过消化道进入血液,然后在肝脏中积累,最后随着血液循环转运到全身其他组织和器官当中[51]。这些研究结果无疑都为TTX 的外源性假说提供了有力证据,但采用高灵敏度的酶联免疫法测定未投喂含毒饵料的养殖河鲀,仍能检测到少量TTX[52],因此,食物链富集并不能全面解释河鲀体内TTX 的来源。
3.2 利用微生物积累TTX
内共生起源假说认为,河鲀通过体内共生微生物积累TTX,其最直接的证据是从不同物种中分离出多种产TTX 的共生微生物。自1986 年Noguchi从花纹爱洁蟹(Atergatis floridus)中分离出产TTX弧菌后,相继从多种海洋生物中分离出弧菌(Vibrio)、假单胞菌(Pseudomonas adaceae)、芽孢杆菌(Bacillus)、交替单胞菌(Alteromonas)、气单胞菌(Aeromonas)、交替假单胞菌(Pseudoalteromonas)、鳗利斯顿氏菌(Listonella anguillarum),及不动杆菌(Acinetobacter)等产TTX 的共生细菌[53-58]。海洋微生物产生具有离子阻断作用的毒素通常是细菌生长进入稳定期后的次级代谢产物。微生物发酵实验发现,菌株发酵培养产生的TTX 比野生河鲀体内的含量要少的多[59]。其原因除了环境因素和实验误差外,主要是河鲀作为产TTX 共生菌的宿主,能够提供必要的信号分子来诱导其产生更多毒素,因此体外培养实验结果偏低[60]。微生物发酵产生的TTX 与经食物链富集积累在河鲀体内的TTX 的结构不同。Matsumura[61]发现,溶藻弧菌所产生的TTX 虽然具有毒性,但与河鲀体内TTX 的单克隆抗体不能发生反应,说明两种毒素的结构不完全相同,推测其可能是TTX 的前体或衍生物[61]。该研究结果表明,河鲀体内的TTX 并不是直接来自于共生微生物,而可能是TTX 的前体或相似物转化而来,为TTX 在河鲀体内的转化积累提供了重要证据。微生物自身的毒素从何而来,是环境胁迫时相关基因的表达,还是调节自身生长生理状态的自然产物,目前尚无结论。微生物产TTX 的诱因及机制有待进一步深入研究。
3.3 河鲀积累TTX 的分子机制
内源性假说认为,河鲀本身具有转化和积累TTX 的能力。Matsumura 等[62]测定发现,星点东方鲀人工授精卵胚胎中的TTX 含量,随着胚胎发育不断增加,证实了河鲀在胚胎阶段即能产生毒素。Itoi 等[52]通过液相色谱串联质谱和免疫组织化学分析发现,河鲀卵巢内的TTX 能够垂直传递给受精卵,并在孵化后以保护层的形式附着于幼鱼体表。目前,在河鲀体内并未找到分泌毒素的腺体和导管,表明TTX 在河鲀体内从头合成的可能性较小。但河鲀体内可能存在着复杂的调控机制,能将食物链富集或共生微生物产生的TTX 及其类似物转化为河鲀体内TTX,并将其转运积累到不同组织器官当中。研究发现,河鲀毒素结合蛋白(pufferfish saxitoxin and tetrodotoxin binding protein,PSTBP)在河鲀的TTX 耐受中具有重要功能。PSTBP 是一种从河鲀血浆中分离出来的毒素结合蛋白,能够作为载体蛋白通过河鲀的血液循环将TTX 运输到特定组织,与TTX 转运密切相关[63]。PSTBP 由两个与三丁基锡结合蛋白(tributyltin-binding protein type 2,TBT-bp2)序列相似性极高的串联结构域组成,TBT-bp 对水生动物具有很高的毒性[64]。然而,Tatsuno 等[65]在无毒养殖河鲀中也发现了PSTBP 同系物,而在部分有毒野生河鲀中则没有检测到PSTBP,表明PSTBP 至少不是调控TTX 积累的唯一蛋白。据报道,红鳍东方鲀肝脏中的纤维蛋白原(fibrinogen-like proteins,FLP)、载脂蛋白(apolipoprotein,APO)、热休克蛋白家族A(heat shock protein 70,HSP70)、补体C5(complement C5,C5)、白细胞介素6(interleukin 6,IL6)以及中枢神经系统中的长链酯酰辅酶A 合成酶(long-chain acyl-CoA synthetase,ACSL)等基因家族中的基因也与河鲀体内TTX 的代谢相关[66-69]。在对河鲀肝脏组织进行核酸杂交和cDNA 末端快速扩增实验后发现,纤维蛋白原基因flp-1、flp-2、flp-3 的表达量与肝脏的毒力水平呈线性关系,推测flp 基因可能与TTX 的积累转化相关[70]。载脂蛋白基因(apo)是一个编码多种与血浆脂质转运相关结合蛋白的基因家族。在肌肉注射TTX 实验中,红鳍东方鲀体内的apoa1、apoe2 和apoh 基因在肝脏中表达上调[66]。热休克蛋白家族A 基因(hsp70)在蛋白质加工、内质网稳态以及减缓细胞应激和凋亡反应中发挥重要作用[71]。与无毒养殖红鳍东方鲀相比,野生红鳍东方鲀肝脏中的白细胞介素6 信号转导物(interleukin 6 cytokine family signal transducer,il6st)和补体C5(c5)基因的表达水平显著升高[67],这些基因通常被认为是先天免疫系统的一部分,参与宿主防御和抗凋亡。ACSL 通常在脂质生物合成中发挥关键作用,并可能与认知功能相关。在TTX 浸泡实验中,红鳍东方鲀鼻区和脑组织中均检测到acsl5 基因表达上调,表明acsl5 基因在TTX 感知和吸收中可能具有潜在功能[69]。虽然已有以上TTX 相关的蛋白或基因被报道,但基于TTX 调控机制的复杂性,目前的研究结果仍不足以解释TTX 耐受动物中TTX 的积累、转运、转化和解毒机制。
与TTX 相似的钠离子通道致毒机制也存在于其他海洋生物毒素中,如广泛存在于双壳贝类和河鲀中的麻痹性贝毒(paralytic shellfish toxins,PSTs)、短裸甲藻毒素(brevetoxin,BTX)等。TTX 和PSTs 还经常在同一个体中被检测到[72,73]。因此,钠通道毒素在耐受动物体内可能具有相似的分子机制,参与调控PSTs、BTX 等相似海洋生物毒素代谢的基因很可能也与TTX 的积累、转运和转化调控相关。已有研究表明,抗氧化、免疫、解毒和抗凋亡相关基因在PST 耐受动物中的诱导表达可能与其耐毒机制相关。其中,与抗氧化防御相关的基因包括谷胱甘肽巯基转移酶(glutathione S-transferase,GST)[74]、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)[75]、硫氧还蛋白(thioredoxin,TXN)[76]、超氧化物歧化酶(superoxide dismutase,SOD)[77]等。已证明,GPxs 在软体动物的各种细菌感染、先天免疫防御以及化学污染物引起的抗氧化应激中发挥重要作用[78]。双壳贝类暴露于PST 后,GST 的解毒和抗氧化酶活性增加,显示出GST 在减轻PST 毒性方面的潜在功能[79]。凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)与抗凋亡、免疫和炎症相关。扇贝iap 基因可能与肝胰脏和肾脏组织中的耐受相关[80]。已发现与PSTs 转运相关的蛋白有溶质转运蛋白(solute carrier,SLC)[81]和ABC 转运蛋白(ATP-binding cassette transporter,ABC)[82]。这两大类膜转运蛋白可能介导了双壳贝类对PST 的吸收和外排。基于以上研究基础,近期有研究首次报道,sod、gst、abc、gpx、txn、iap 和slc 等基因家族的基因可能在红鳍东方鲀体内TTX 的积累、转运和代谢过程中发挥重要作用[83]。通过相似钠通道毒素调控基因进一步挖掘河鲀体内与TTX积累转运相关的基因,有助于更全面地理解TTX 的调控机制和河鲀耐受TTX 的适应性进化。
4 总结与展望
随着河鲀产业的有条件放开,TTX 检测技术的不断提升和新的衍生物相继发现,对TTX 在河鲀体内的积累途径有了进一步的理解。虽然现有研究尚不足以全面揭示河鲀体内TTX 积累、转运和代谢的复杂机制,但随着组学技术的不断发展和广泛应用,利用多组学技术系统挖掘TTX 积累转运过程中的重要分子途径和关键基因功能,能够对河鲀积累转运TTX 的过程有更深入的认识,也有利于揭示河鲀在面对TTX 压力选择下的适应性进化机制,为今后通过遗传改良降低河鲀TTX 的积累提供理论依据。

