芽孢杆菌BMF03 对摄食玉米赤霉烯酮污染饲料鲫的保护效应
周鑫蔚,丁皓天,董秀金,徐一力,刘毅,吴冰,陈香凝,丁祝进,马桂珍,程汉良,许建和,2
(1.江苏海洋大学海洋科学与水产学院,江苏 连云港 222005;2.江苏海洋大学,江苏省海洋生物技术重点实验室,江苏 连云港 222005)
玉米赤霉烯酮(zearalenone,ZON)是一种白色晶体,化学式为C18H22O5,常见于具有赤霉病的玉米和小麦等谷物中,是饲料原料中主要霉变污染物之一。ZON 具有强烈的雌激素作用,在动物体内会引起多种生殖系统相关疾病,如性欲下降、无排卵、不育和细胞质损害等[1,2]。ZON 可通过与鱼体细胞雌激素受体相结合的方式影响鱼类神经系统以及生殖器官[3]。摄食ZON 超标水产品可导致人体乳腺中的癌细胞增加[4]。目前,我国规定饲料原料中ZON 的检出量不得超过500 μg/kg。去除饲料原料中ZON的主要方法有物理、化学和生物降解等方法。其中生物降解法因安全高效无污染,是目前广泛使用的脱毒方法。生物降解法通过微生物降解使用较多。Zhang 等[5]发现,酿酒酵母(Saccharomyces cerevisiae)降解ZON 的效率较高。Harkai 等[6]发现分离筛选的124 株链霉菌(Streptomyces)中有2 个菌株对ZON 毒素的去除率达100%。耿海荣等[7]筛选获得1株高效降解ZON 毒素的枯草芽孢杆菌(B.subtilis),当ZON 毒素浓度为2 μg/mL 和20 μg/mL 时,其发酵液对毒素的去除率分别为93.79%和82.40%;无菌发酵液对ZON 毒素的去除率为62.02%。上述研究中功能菌也均为陆源性菌株,降解的ZON 也都为纯品,而对受污染的饲料原料中的ZON 降解效果目前报道较少。
鲫(Carassius auratus)是我国传统养殖鱼类,2020 年淡水养殖产量为274.9 万t(2021 年中国渔业年鉴)。鲫养殖过程中需要投喂大量人工配合饲料,而在饲料原料和成品储存中ZON 是主要霉变毒素之一。饲料中ZON 对生物体的毒害作用也仅见于陆生动物[8],在水产动物中报道较少。
芽孢杆菌BMF03 是本实验室从养殖水体分离的一种甲基营养型芽孢杆菌,对液体培养基中的ZON 有很强的降解作用[9],但其对鲫饲料中ZON 是否具有同样的降解功能,且添加到饲料后投喂鲫是否存在安全风险,目前均不清楚。本研究通过给鲫投喂四种不同类型饲料:基础饲料(对照)、基础饲料+芽孢杆菌BMF03(1×1010CFU/kg,BMF03 组)、基础饲料+玉米赤霉烯酮(1 000 μg/kg,ZON 组)和基础饲料+玉米赤霉烯酮+芽孢杆菌BMF03(ZON03 组),测定各组饲料和鱼体肌肉中玉米赤霉烯酮的含量及实验鱼的生长性能、生化指标、肠道和肝胰脏健康状况等,综合评价芽孢杆菌BMF03对摄食ZON 污染饲料鲫的保护效应及其作为渔用饲料添加剂的可行性。
1 材料与方法
1.1 实验设计与饲料配方
共配制4 组等氮饲料,基础饲料为对照(配方见表1);在基础饲料中分别添加芽孢杆菌BMF03(BMF03)、玉米赤霉烯酮(ZON)以及玉米赤霉烯酮+BMF03 菌株(ZON03)。依本实验室前期研究结果和鱼体对饲料中ZON 的安全耐受剂量[9,10],确定饲料中ZON(购买自上海士锋生物有限公司)添加量为1 000 μg/kg;BMF03 菌株为发酵上清离心后的产物,溶于水加入饲料中,添加量为1×1010CFU/kg,由江苏海洋大学抗菌微生物及其代谢产物研究与应用重点实验室提供。各组饲料原料粉碎过60 目筛,用小型混合机(ASY-3D,科勒器械有限公司)搅拌10 min,加水后继续揉拌15 min,然后利用便携式绞肉机(TK-12,丰瑞吉食品机械有限公司)制成直径为0.4 mm 左右的颗粒饲料,放入干燥箱,35 ℃烘干至水分为10%左右,装入密封袋,置于4 ℃冰箱冷藏保存。
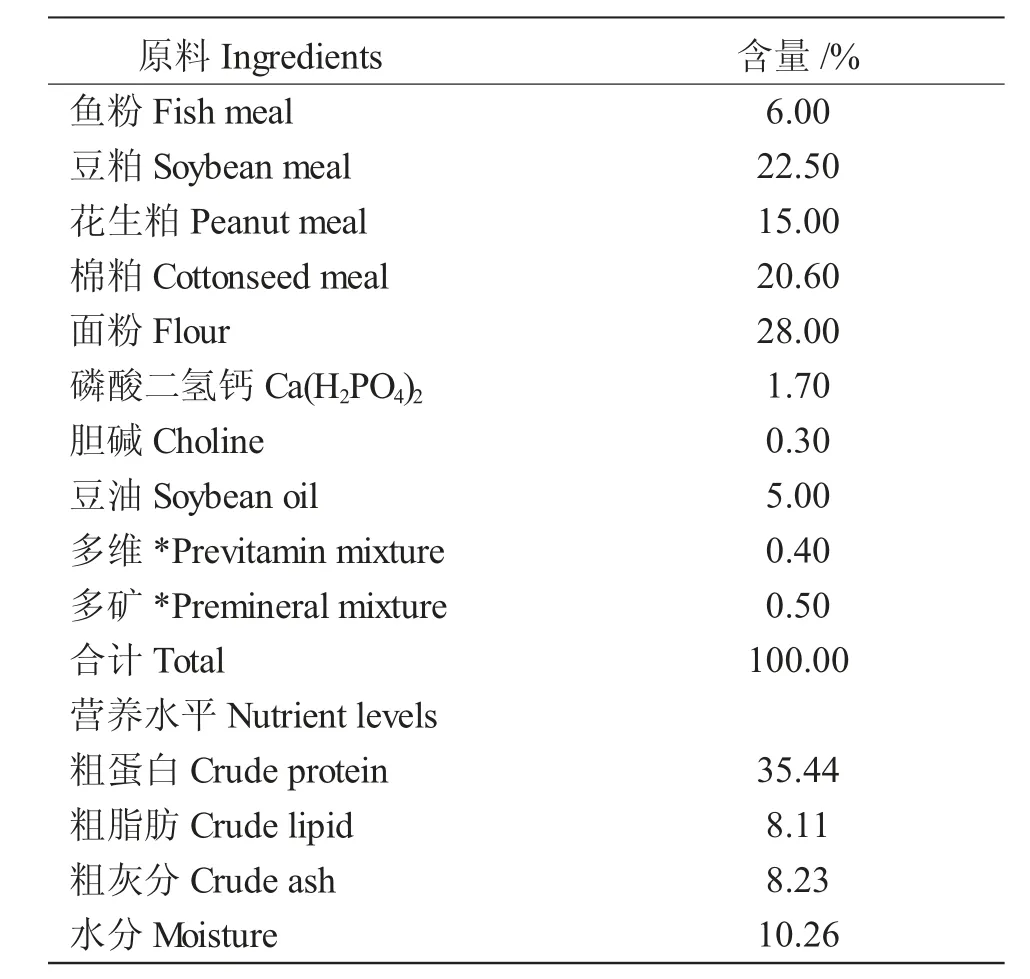
表1 基础饲料组成及营养组成(干物质%)Tab.1 Ingredients and nutritional composition in basic diet (dry matter basis %)
1.2 实验动物与饲养管理
实验用鲫初始体质量为(20.13±0.12)g,购买自连云港市博旺特种水产养殖有限公司。养殖实验在江苏海洋大学水产养殖实验室内的养殖系统(大连汇新)进行。正式实验开始前用对照组饲料暂养1周,驯化鲫上浮抢食。分组前停食24 h,随后选取480 尾规格均匀的健康鲫,随机分成4 组,每组3 个重复,每个重复40 尾鱼。每天投喂四次(8:30、11:30、14:30 和17:30),日投喂量为体质量的4%,每周根据体质量增长情况调整一次,养殖周期为8 周。实验期间每天处理残饵,换水一次,换水量约25%,养殖水温23 ℃~26 ℃,水体pH7.0~7.5,氨氮含量小于0.2 mg/L,溶氧量大于5 mg/L,自然光照,每日记录采食量。
1.3 样品采集与测定
养殖实验结束时,将实验鱼饥饿24 h 后计数、称重,用于测定增重率等生长指标。每组随机取9尾鱼用浓度为50 mg/L 的MS-222 进行麻醉,其中3尾鱼用于测定体长和体质量,然后用2 800 U/mL 肝素钠溶液湿润处理过的一次性2 mL 针头注射器在尾静脉处采血,在4 ℃下3 000 r/min 离心10 min 后收集上清液于2 mL 离心管中,-20 ℃冰箱保存,用于测定生化指标。取血后解剖鱼体,取出内脏并称重,用于计算脏体比。另外3 尾取侧线和背鳍间肌肉,置于密封袋中,-80 ℃冰箱保存,用于测定肌肉中常规营养组成;剩余3 尾鱼解剖后,取肝胰脏和1 cm 左右中肠,放入4%多聚甲醛中固定,用于组织形态的观察。
1.4 饲料和鱼体肌肉中ZON 含量的测定
将饲料和肌肉样品在60℃下烘干至恒重,磨碎后用甲醇水溶液提取,用免疫亲和柱(月旭科技,中国)提取液,洗脱和净化,置于高效液相色谱仪(Agilent-1260,美国)分析。色谱条件∶流动相为甲醇水溶液(8∶2),紫外检测波长为236 nm,柱温25℃,进样量为20 μL,流速为1 mL/min。
1.5 鲫生长性能的测定
实验中测定生长性能参数如下:
式中,m1、m2分别为鲫的初始体质量和终末体质量(g);m3为饲料摄入量(g);m4、m5分别为实验开始和结束时鲫的数量(尾);m6为内脏重(g);t 为养殖时间(d);P 为粗蛋白含量(%);L 为体长(cm)。
1.6 鲫肌肉常规营养组分的测定
称取干重样品1 g(精确至0.000 1 g)置于消化管中,加入硫酸钾4.5 g、硫酸铜0.5 g 和硫酸10 mL,420 ℃消化1.5 h,冷却15 min 后上机,利用全自动凯氏定氮仪(KjeltecTM-8400)测定粗蛋白含量;
称取干重样品1 g(精确至0.000 1 g)置于滤纸筒中,塞入脱脂棉,在恒重完的铝杯中加入80 mL石油醚,利用索式抽提仪(SoxtecTM8000)测定粗脂肪含量;采用550 ℃灼烧称量法(GB5009.4-2016)测定粗灰分含量。
1.7 鲫血清生化指标的测定
血清中超氧化物歧化酶、碱性磷酸酶、酸性磷酸酶、过氧化氢酶、溶菌酶活性和总蛋白含量用南京建成生物试剂盒测定。
1.8 鲫肠道和肝胰脏组织形态的测定
将4%多聚甲醛固定好的鲫中肠和肝胰脏样品送至Servicebio 有限公司(武汉)制作石蜡切片并进行H&E 染色。使用CaseViewer2.2(3DHISTECH)浏览数字切片,对切片中病理改变进行文字描述,用箭头标识说明切片之间差异。
1.9 数据统计分析
实验数据用SPSS 23 软件经单因素方差分析(One-way ANOVA)后以平均值±标准偏差(mean±SD)表示。用Student t-test 和Duncan 进行显著性检验,P<0.05 表示差异显著。
2 结果与分析
2.1 饲料和鱼体肌肉中ZON 含量
实验前后各组饲料中玉米赤霉烯酮的含量见表2。由表2 可知,实验开始时ZON 和ZON03 组饲料中ZON 含量显著高于对照组和BMF03 组,8 周后ZON 组饲料中ZON 含量未见明显下降,但ZON03组饲料中ZON 水平显著低于ZON 组(P<0.05)。

表2 8 周后饲料中ZON 含量变化/(μg·kg-1)Tab.2 Concentrations of ZON in diets after eight weeks/(μg·kg-1)
实验前后鱼体肌肉中玉米赤霉烯酮含量见表3。由表3 可知,实验开始时鱼体肌肉中未检出ZON,8 周后对照组和BMF03 组鱼体肌肉中检测出少量ZON,但含量显著低于ZON 和ZON03 组(P<0.05)。ZON03 组鱼体肌肉中ZON 含量显著低于ZON 组(P<0.05)。

表3 8 周后肌肉中ZON 含量变化/(μg·kg-1)Tab.3 Concentrations of ZON in muscles after eight weeks/(μg·kg-1)
2.2 投喂不同饲料对鲫生长性能的影响
投喂不同饲料对鲫生长性能的影响见表4。养殖实验结束时,各实验组之间蛋白质效率、饲料系数、特定生长率及肥满度和存活率无显著差异(P>0.05)。但ZON 组鲫终末体质量和增重率均显著高于对照组和BMF03 组(P<0.05),但与ZON03 组无显著差异(P>0.05)。
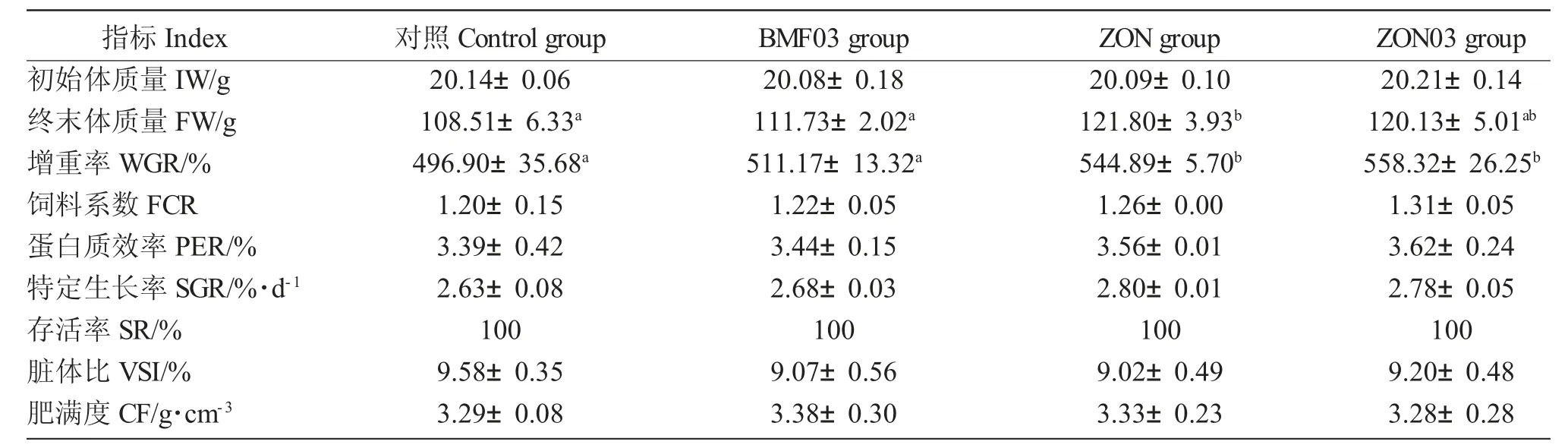
表4 投喂不同饲料后对鲫生长性能的影响Tab.4 Effects of different diets on the growth performance of crucian carp
2.3 投喂不同饲料对鲫肌肉常规营养组分影响
投喂不同饲料对鲫肌肉常规营养组分影响见表5。BMF03 组鱼体肌肉粗蛋白含量显著高于其他三组(P<0.05)。ZON 和ZON03 组鱼体粗脂肪和粗灰分含量与对照组相比均显著升高(P<0.05),但两组之间无显著差异(P>0.05)。各组鱼体肌肉中水分含量无明显差异(P>0.05)。

表5 投喂不同饲料后对鲫肌肉常规营养组分的影响(湿物质%)Tab.5 Approximate nutritional composition in muscle of crucian carps fed different diets(wet matter basis %)
2.4 投喂不同饲料对鲫血清生化指标的影响
投喂不同饲料对鲫血清生化指标的影响见表6。BMF03 和ZON03 组鱼体血清CAT 活性与对照组相比无显著差异,但显著高于ZON 组。ZON 组鱼体血清SOD 和AKP 活性明显低于其他组(P<0.05),各实验组中LZM活性均显著高于对照组(P<0.05),但添加毒素组LZM 活性低于BMF03 组(P<0.05)。各组间鱼体血清ACP 活性和TP 含量差异不显著(P>0.05)。
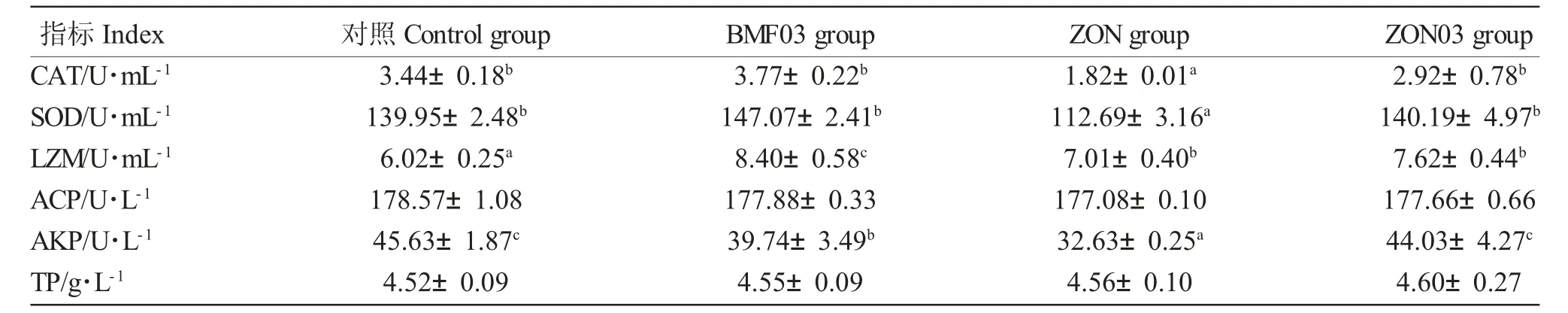
表6 投喂不同饲料对鲫血清生化指标的影响Tab.6 The serum biochemical indicators of crucian carps fed different diets
2.5 投喂不同饲料对鲫肠道和肝胰脏健康状况的影响
投喂不同饲料对鲫中肠组织结构的影响见图1。图1 中可见,对照组、BMF03 组和ZON03 组中肠组织皱襞结构完整,可见少量杯状细胞,少量黏膜上皮细胞点状坏死(黑色箭头)。ZON 组中组织局部黏膜下层轻度水肿(黑色箭头),结构疏松,黏膜与黏膜下层轻度脱落(蓝色箭头);较多黏膜上皮细胞坏死(绿色箭头)。
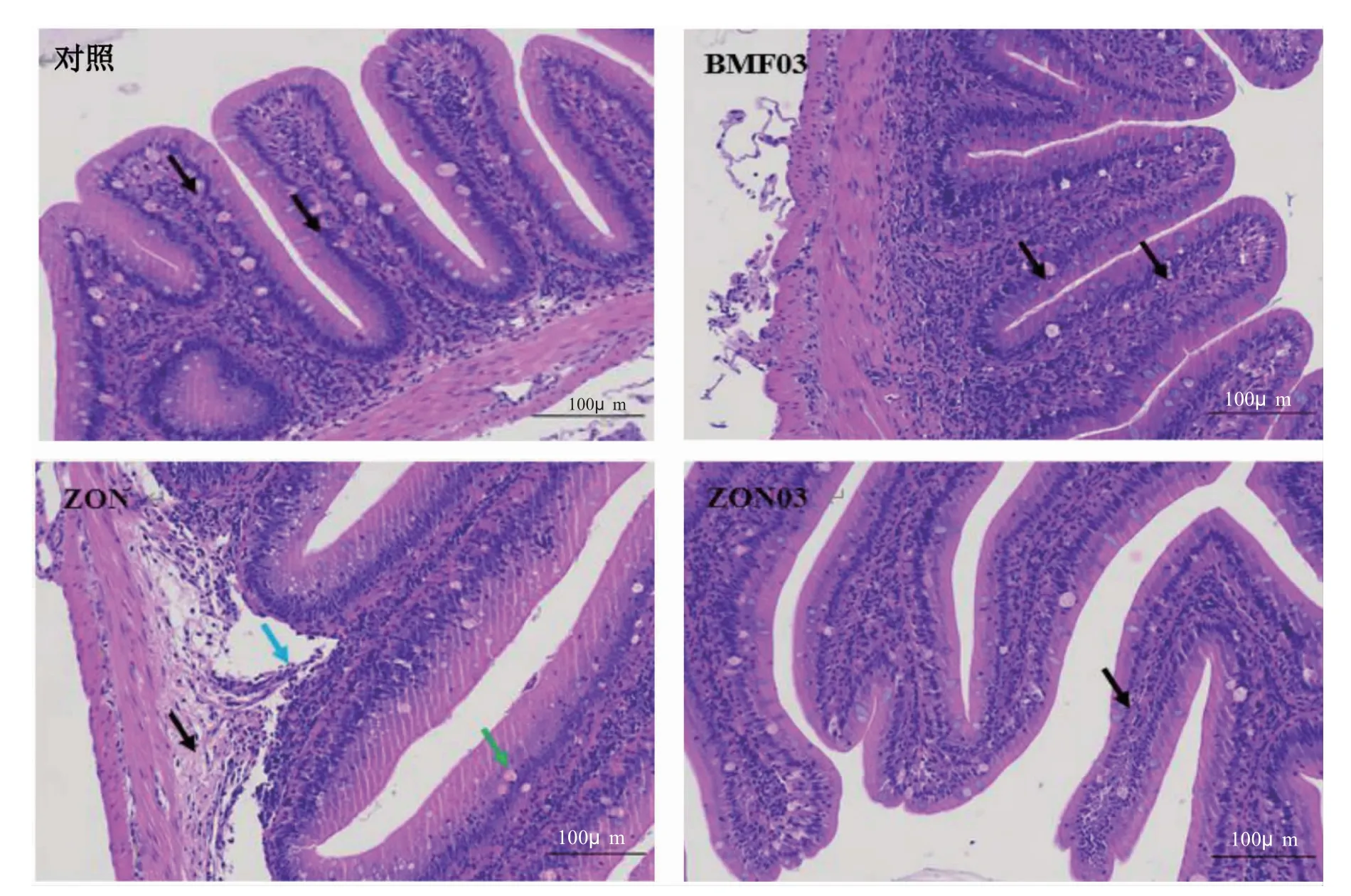
图1 摄食不同饲料鲫中肠的组织结构Fig.1 The intestinal tissue structures of crucian carp fed different diets
投喂不同饲料对鲫肝胰脏组织结构的影响见图2。由图2 可见,对照组和BMF03 组肝细胞空泡变性程度较小(黑色箭头),胰腺腺泡细胞排列紧密,未见明显炎性细胞浸润;ZON 组中,肝细胞重度空泡变性(黑色箭头),局部可见少量大泡,周围可见轻微出血(蓝色箭头),多处胰腺腺泡周围少量巨噬细胞浸润(黄色箭头);ZON03 组中,肝细胞中度空泡变性(黑色箭头),多处胰腺腺泡周围少量出血(黄色箭头)。

图2 摄食不同饲料鲫肝胰脏的组织结构Fig.2 The hepatopancreatic structure of crucian carp fed different diets
3 讨论
本研究中ZON 组饲料中添加芽孢杆菌BMF03 8 周后,饲料中ZON 浓度显著降低,表明芽孢杆菌BMF03 在体外对ZON 具有一定的去除效果。已有的研究表明,除芽孢杆菌对ZON 有降解作用外,其他多种微生物对ZON 也有降解作用。Keller 等[11]从饲料中分离出的酿酒酵母(Saccharomyces cerevisiae)菌株能消除培养基中90%以上的ZON 毒素;采用戊糖乳杆菌(Lactobacillus pentosus)JM0812 菌株能够吸附乙酸钠缓冲溶液中83.17%的ZON[12];乳酸菌(Lactobacillus)发酵液可以降解麦芽中23%的ZON[13];从发霉玉米中分离出的乳酸杆菌(Lactobacillus beijerinck)和明串珠菌(Leucanostoc)可以将ZON 生物转化为α-ZAL[14]。微生物对ZON 毒素降解主要通过细胞壁的吸附、胞内活性物质和胞外蛋白等途径。彭云等[9]报道,甲基营养型芽孢杆菌对ZON 毒素降解主要通过细胞壁的吸附、胞内活性物质和胞外蛋白的共同作用,pH、温度等因素对菌株去除ZON 毒素有明显影响,pH 为7 时菌株对ZON毒素去除作用最强,温度低于23 ℃或高于28 ℃毒素去除作用下降。本研究中芽孢杆菌BMF03 对饲料中ZON 降解效率远低于对液体或固体培养基中ZON 的降解效果,去除率不足20%。而彭云等[9]报道当培养液中ZON 浓度为15 μg/mL 时,BMF04 菌株48 h 对其去除率达99%。推测原因可能与BMF03 也属于甲基营养型芽孢杆菌,其发挥功能也需要满足一定温度和介质条件,本研究中饲料配制后一直贮存于4 ℃,远低于甲基营养型芽孢杆菌对ZON 毒素降解所需适宜温度,同时饲料中较低水分含量也影响了BMF03 对ZON 的降解效果。
ZON 对鱼体组织损伤作用在较多文献中已有报道。Wang等[15]发现,饲料中ZON的剂量大于1 041 μg/kg 会引起草鱼肠道内组织的氧化损伤和细胞凋亡。Wony等[16]发现,ZON会造成虹鳟(Oncorhynchus mykiss)肝脏组织损害(包括细胞质空泡化和巨噬细胞聚集)。本研究中也发现鲫摄食含ZON 饲料后肠道组织表现出明显的病理症状,如黏膜层水肿,较多上皮细胞坏死以及杯状细胞消失等,肝细胞也出现重度空泡变性,与在其他鱼类中结果相似。而摄食添加BMF03 菌株饲料后实验鱼肠道和肝脏组织结构完整,表明饲料中添加BMF03 可降低ZON 对鱼体的损伤作用,缓解ZON 在鱼体内的毒害作用。王悦等在小鼠中也发现降解ZON 菌株在体内可明显降低ZON 毒性,保护肝脏[17]。CAT 和SOD 是机体抗氧化酶系统重要成员,可防止活性氧损害,维持自由基产生和清除之间的平衡[18]。SOD 可清除机体内的活性氧自由基,将其转化为H2O2,再通过CAT进一步还原生成H2O 和O2。本研究中添加BMF03菌株饲料组鱼体血清SOD、CAT 酶活力均明显高于ZON 组,表明BMF03 可提高鱼体抗氧化能力,维持其抗氧化系统的平衡,保护鱼体组织免受ZON 的氧化损伤。饲料中添加芽孢杆菌可提升水产动物抗氧化能力在鱼类和甲壳类中均有报道。黄坤鹏等[19]研究也发现,芽孢杆菌可显著提高斜带石斑鱼(Epinephelus coioides)仔鱼体内的SOD活力。袁卫[20]研究表明,饲料中添加芽孢杆菌能提高凡纳滨对虾(Litopenaeus vannamei)体内抗氧化活性指标。但目前芽孢杆菌对水产动物抗氧化系统的具体益生机制仍待进一步研究。溶菌酶(LZM)是鱼类先天免疫的重要指标之一,是鱼类血清中重要的杀菌剂[21]。碱性磷酸酶(AKP)是鱼类免疫系统中非常重要的水解酶,在保护机体防御病原体入侵,参与细胞中生物大分子的消化,维持细胞正常代谢活动有重要功能[22]。蔡红丹等[23]报道,饲料中添加复合芽孢杆菌可显著提高石斑鱼血清中溶菌酶和AKP 活力。本研究亦发现BMF03 组鱼体血清中LZM 和AKP 活力均明显高于ZON 组,表明添加芽孢杆菌BMF03 能够提高鲫免疫能力,缓解ZON 毒素对鱼体免疫造成的负面影响。
本实验中,鲫摄食添加ZON 的饲料时,终末体质量和增重率都显著增加。Wony 等[24]也发现在饲料中添加2 mg/kg 的ZON 投喂虹鳟,其终末体质量、生长速度和饲料利用率显著提高。这一结果可能与ZON 在动物体内产生的代谢物生理功能有关。ZON 在动物体内会分解成两种植物雌激素α-ZAL和β-ZAL,其中α-ZAL 可通过刺激垂体产生内生生长激素来促进骨骼和肌肉的生长,从而在短时间内表现出对鱼体生长具有一定的促进作用[25,26]。本实验中,鱼体摄食添加BMF03 饲料后促进了肌肉中蛋白质积累。周晓波等[27]也发现罗非鱼摄食添加乳酸菌(Lactobacillus)、戊糖乳杆菌(Lactobacillus pentosus)和鼠李糖乳杆菌(Lactobacillus rhamnosus)饲料后,鱼体肌肉中粗蛋白含量明显上升。黄灵等[28]报道,虎龙斑(Epinephelus fuscoguttatus♀×E.lanceolatus♂)摄食添加光合细菌和芽孢杆菌饲料后能够提高肌肉中粗蛋白的含量。但本研究中添加BMF03菌株未显著改善鱼体的终末体质量、增重率以及特定生长率,这与在罗非鱼[29]和凡纳滨对虾[30]中研究结果相似。这些不同的研究结果可能由于益生菌种类和剂量以及物种的特异性所导致,温度、水质等环境因素也会影响益生菌对养殖对象的作用效果[ 31 ]。
结论
本实验中,饲料中添加玉米赤霉烯酮短期内可促进鲫生长发育,但免疫参数测定和组织切片观察结果表明,玉米赤霉烯酮对鱼体的毒害作用明显;BMF03 菌株可在一定程度上降解鲫饲料中玉米赤霉烯酮毒素。摄食添加BMF03 菌株的玉米赤霉烯酮污染饲料可缓解玉米赤霉烯酮在鲫体内的毒害作用,且不影响鱼体生长性能,表明BMF03 菌株对摄食玉米赤霉烯酮污染饲料的鲫具有保护作用。

