重症超声评估二尖瓣环收缩期运动峰值速度在体外膜肺氧合撤机前的应用
杨慧燕 黄生奇 王静 方圆 顾继伟
1宁夏医科大学总医院心脏大血管外科(银川 750001);2宁夏永宁县人民医院中医科(宁夏 永宁 750004)
静脉-动脉体外膜肺氧合(veno-arterial ECMO,VA-ECMO)越来越多地应用于心源性休克患者的循环辅助[1],近些年,ECMO 辅助存活率逐年上升。实施ECMO 支持,顺利撤机是治疗成功的关键所在[2]。目前VA-ECMO 撤机国内并没有统一的标准和流程。能无创、动态地评估撤机时机和撤机整个过程的心肺耐受性首选重症超声[3-6]。
组织多普勒技术测量的二尖瓣环收缩期运动速度峰值(Sm)可反映左心室心肌纵向运动的速度,左室射血分数受到多种因素影响,难以精准评估心脏的收缩功能,而Sm 的测量不受二维超声图像质量的影响,目前已逐渐成为评价ECMO 撤除的主要方法,本研究通过重症超声动态监测Sm,为VA-ECMO 脱机提供新措施。
1 资料与方法
1.1 一般资料 选取宁夏医科大学总医院心脏大血管外科2019 年2 月至2023 年2 月接受VA-ECMO治疗的患者40例,其中男26例,女14例。根据撤机试验成功与否,分为试验成功撤机组(A组,n=28)、试验失败撤机组(B 组,n= 12),在试撤机前,用床旁超声仪(迈瑞M9Pro)监测患者二尖瓣环收缩期峰值运动速度。本研究符合医学伦理学标准,所有被选患者或家属均签署知情同意书。
VA-ECMO的适应症:(1)心源性休克,低心排表现(如患者存在意识障碍、毛细血管充盈时间>3 s,四肢末梢冷、皮肤花斑、尿量<0.5 mL/(kg·h)持续3 h 或乳酸持续升高)。(2)在大剂量血管活性药物辅助下,循环仍不能维持(如SBP <85 mmHg 或MAP >55 mmHg 或CI <1.8 L/min/m2)[7]。
VA-ECMO 的禁忌证:不可逆的心、肺病变,颅内出血。不可逆的中枢神经系统损伤。没有心脏移植可能的扩张性心肌病。心肺复苏效果不佳。
1.2 方法
1.2.1 上机 由具有丰富经验的VA-ECMO 团队的外科医师在床旁进行超声引导经皮插管。股静脉-股动脉插管,该途径是VA-ECMO 最常用的血管通路,该路径具有快速、微创、易穿刺的优势。套管型号的选择基于超声测量血管内径以及患者的体格和流速。股动脉插管周径为15 ~17 F,股静脉插管周径为19 ~26 F。从动脉插管建立远端侧支,提供远端肢体的血流灌注,下肢灌注导管的周径为6 F,动脉、静脉置管成功后连接到VA-ECMO 回路,即德国MAQUET Rotaflow。成人置管均在床边操作,心脏手术难以脱离体外循环,则在手术室放置。在插管前,按照0.5 ~1 mg/kg 推注肝素钠,监测活化凝血时间。
1.2.2 呼吸机设置及常规监测 由于VA-ECMO 提供氧合血流,呼吸机条件设置施行肺保护通气策略,给予充分镇静镇痛避免人机对抗,减少氧耗。
1.2.3 重症超声评估 包括以下评估左心功能指标:(1)二尖瓣环收缩期运动峰值速度(Sm):取心尖四腔心切面,在TDI-PW 模式下,将脉冲多普勒取样容积放在二尖瓣环上的“感兴趣区”可获得二尖瓣环的组织运动速度模式,取样容积可置于二尖瓣环室间隔或侧壁处测量,显示运动速度-时间曲线。Sm 收缩期运动速度峰值。见图1。(2)于左右心室长轴的切面M 模式下,测量左心舒末径(left ventricular end diastolic dimension,LVEDD)及收缩末径,计算左室射血分数(left ventricular ejection fraction,LVEF)。
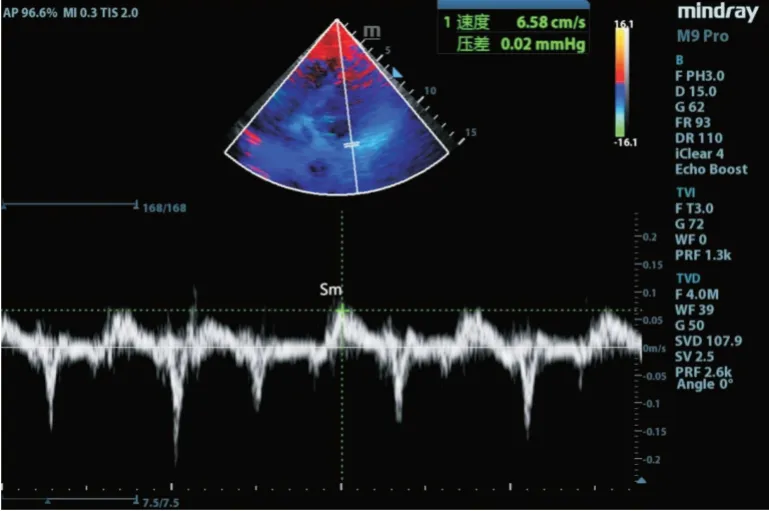
图1 Sm 的测量Fig.1 Mitral ring systolic peak motion velocity(Sm)measurements
1.2.4 撤机 原发疾病得到良好控制或病因已明确并得到精准治疗;全身组织灌注满意;循环稳定;渐降低ECMO 辅助流量至1.5 L/min,维持15 min。心脏超声下无左、右心扩大,心室收缩活动无变化,二尖瓣环收缩期峰值运动速度Sm >6 cm/s,如果不满足以上条件,应恢复全流量,中止试停机,试验失败。
1.3 统计学方法 采用SPSS 22.0 统计软件。计量资料以(±s)表示,组间比较采用两独立样本t检验。计数资料组间比较采用χ2检验。试验成功与否的诊断作用采用ROC 曲线分析,AUC 比较采用Z检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 两组患者的性别、年龄、BMI、UROSCOR 评分等一般资料比较,差异均无统计学意义(均P>0.05)。见表1。
表1 两组患者一般资料比较Tab.1 Comparison of general data between the two groups ±s
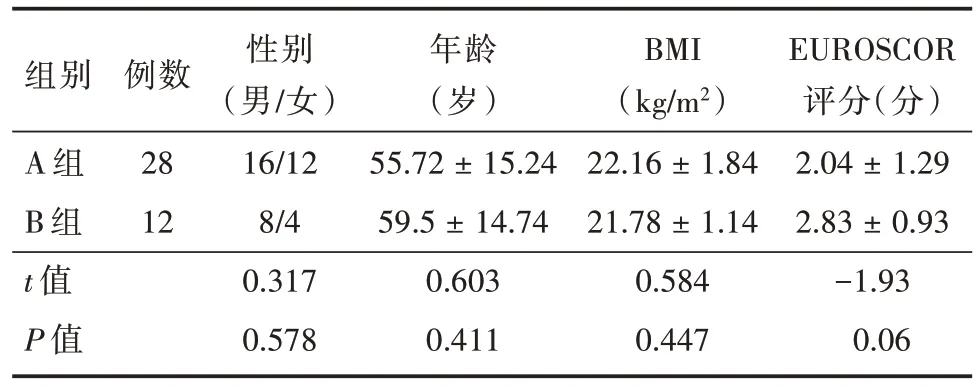
表1 两组患者一般资料比较Tab.1 Comparison of general data between the two groups ±s
注:EUROSCOR 评分,欧洲心血管手术危险因素评分系统
组别A 组B 组t 值P 值例数28 12性别(男/女)16/12 8/4 0.317 0.578年龄(岁)55.72 ± 15.24 59.5 ± 14.74 0.603 0.411 BMI(kg/m2)22.16 ± 1.84 21.78 ± 1.14 0.584 0.447 EUROSCOR评分(分)2.04 ± 1.29 2.83 ± 0.93-1.93 0.06
2.2 两组患者撤机前左心超声参数(Sm/EF/LVEDD)比较 两组患者撤机试验前,A 组左心功能超声参数Sm 及LVEF 均大于B 组,差异有统计学意义(均P<0.05)。LVEDD 比较差异无统计学意义(P>0.05)。见表2。
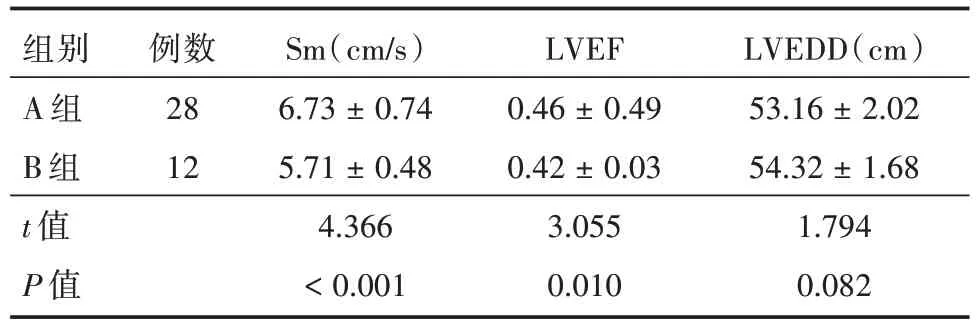
表2 两组患者撤机前左心超声参数比较Tab.2 Comparison of left ventricular ultrasound parameters before withdrawal between the two groups
2.3 Sm 参数预测患者撤机成功与否的ROC 曲线分析 将检验结果变量Sm 和LVEF 纳入判断VAECMO 撤机试验成功与否的ROC 曲线分析中,其中Sm 最佳临界值分别为0.821。见表3、图2。
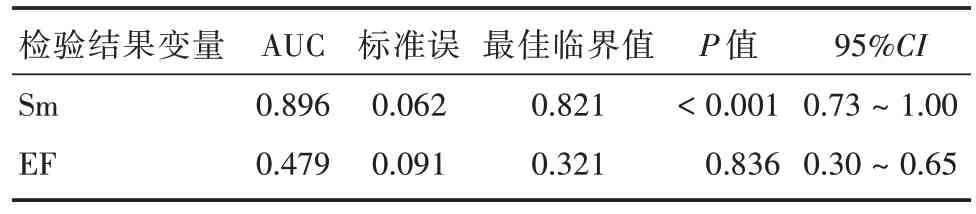
表3 左心功能超声参数预测患者撤机成功与否的ROC曲线分析结果Tab.3 ROC curve analysis results of left cardiac functional ultrasound parameters predicting successful withdrawal of patients

图2 预测患者撤机成功与否的ROC 曲线Fig.2 ROC curve of Sm and LVEF for successful evacuation
3 讨论
静脉-动脉体外膜肺氧合(VA-ECMO)为心血管系统提供临时辅助,已成为心脏泵衰竭患者的一种有效的抢救干预措施[8]。然而,不同的治疗中心VA-ECMO 的撤机流程也不同,并且缺乏标准化的撤机方案[9]。撤机过程中可能会面临许多问题,比如全身血管舒张导致的低血压、左心室功能障碍和左室流出道梗阻(left ventricular outflowtract obstruction,LVOTO)等并发症[10]。VA-ECMO 会加重左心后负荷,超声心动图监测在评估和决定VA-ECMO 能否成功撤机时是必不可少的。CHRISTIAAN 等[11]研究表明,总结撤机失败的解决方法,首选超声心动图评估Sm 来评价心脏收缩功能作为预测成功撤机的标准之一。
LVEF 一直是临床医生评价左心功能的参数。但某些情况下,尤其心脏术后带呼吸机肺气干扰,会直接影响其对左心收缩功能评估的精准性[12]。学者们认为,与LVEF 不同,二尖瓣环运动的主要特征是:(1)在同一平面上,瓣环的运动代表全部心室肌长轴方向上从基底到心尖纵向位移的总量;(2)在这个平面上心肌纤维的数量明显多于任何短轴切面的数量,且不受容量负荷的影响[13],二尖瓣环运动不受负荷改变的影响,因此,在评价这些因素影响下的心功能改变时仍是可靠的方法。VA-ECMO 可以增加左心后负荷,减轻左心前负荷。
TDI 能够测定心动周期二尖瓣环的纵向运动速度(Sm),并且由于其测量的是心肌组织多普勒频移信号,不依靠心内膜的清晰度,对二维超声图像清晰度较差的患者也能进行精准分析和动态评估[14]。BARNFO 等[15]研究认为,和短轴收缩功能异常相比,TDI 能更早检测出左室长轴收缩功能异常,因此应用组织多普勒测量二尖瓣环收缩期运动速度Sm 评估左心室长轴收缩功能对早期发现左心功能减低有很大作用。
用TDI 技术测量二尖瓣环Sm 来评估左心室功能时,其敏感性为94%,特异性93%,准确性94%[15]。AISSAOUI 等[16]研究表明,在ECMO 流量最低时,VTI >10 cm、LVEF >20% ~25%和组织多普勒外侧Sm >6 cm/s 均能成功撤机。JOSEPH等[17]研究表明,Sm >6 cm/s 可作为成功撤机的客观指标,朱英等[18]研究表明组织多普勒Sm >6 cm/s 以及VTI 及左心室心肌应变和应变率等指标的上升提示心脏收缩功能改善,应作为V-AECMO 撤机前心功能评估的基本指标。
Sm 用于评价左心长轴的收缩功能,不受前后负荷、心腔大小、心室壁、瓣膜、血流等因素的影响,临床应用具有极其重要的价值。本研究发现,在应用VA-ECMO 治疗后,撤机试验成功的A 组28 例,试验成功组其Sm 值(6.73 ± 0.74)cm/s 明显高于B 组(5.71 ± 0.48)cm/s 患者,见表2,针对超声参数对VA-ECMO 撤机试验成功与否的诊断价值,ROC 曲线结果也支持这一结论,见图2。以上均提示Sm 可作为评估VA-ECMO 撤机时机的一个可靠指标。
LVEF 常用来评估左心收缩功能的指标,但它反映的是左心容积变化,且受到左心前负荷和后负荷的影响,受到心肌节段异常运动等影响,ECMO 期间测量EF 值来评估撤机时机不可靠,我们的研究结果与彭伟报道的一致[19]。本研究结果显示,撤机成功组与失败组两组EF 值差异没有显著性差异。有研究报道左室EF 可以做为撤机标准[20],心脏术后患者部分为应激性心肌病患者,测EF 值是满意的,但患者整体收缩功能是不满意的,必须结合Sm 综合考虑,单独EF 指标不能作为评估撤机的依据,考虑到我们样本量小,需加大样本量进一步研究。
左心室舒张末期直径,ECMO 期间心脏超声动态评估LVEDD 可辨别左心室有无扩张[21]。本研究中,两组患者撤机前LVEDD 无统计学意义,由于VA-ECMO 运行时,受到流量及容量的干扰,LVEDD 也会变化,故该参数指导意义有限。也可能本研究样本量小,期待后期多中心、大样本量研究支持这一结果。
综上所述,重症超声是一种无创、直观、可重复性高的心脏监测方法,被喻为重症医师的眼睛。在应用于体外膜肺氧合治疗时,Sm 可做为实时监测评价心脏功能恢复情况的指标,对撤除ECMO辅助给予客观指导,提升ECMO 撤机成功率,是推动ECMO 技术发展的关键环节之一。本研究的不足之处:本研究研究对象来源于同一中心。样本量小,期待联合多中心实施随机、对照、双盲研究。
【Author contributions】YANG Huiyan and HUANG Shengqi supervised and administrated the study,collected and assembled data.WANG Jing analyzed the data,conducted validations and performed visualization,FANG Yuan drafted the paper.GU Jiwei revised the manuscript.All authors contributed equally to this study.All authors read and approved the final manuscript.

