维生素D 对辛酸高脂饮食引起的前列腺癌小鼠骨转移的影响
赵海军 李伟 魏瑜 张丽翠 张玉 王新敏 王翠喆
1石河子大学第一附属医院(新疆 石河子 832000);2石河子大学医学院(新疆 石河子 832000)
前列腺癌是前列腺上皮细胞恶性增生所引起的一种肿瘤,约八成患者是65 岁以上的男性,并具有一定的遗传倾向。据世界卫生组织发布的数据显示[1-2],前列腺癌是全球男性第二高发恶性肿瘤。中国国家癌症中心统计数据显示[3],中国男性前列腺癌的发病率约为6.72/10 万,每年前列腺癌新发人数约为7.8 万。临床资料调查显示[4]:约75% ~80%的前列腺癌患者发生骨转移,而前列腺癌患者高死亡率多归因于骨转移。此外,出现骨转移的前列腺癌患者常伴随骨折、骨痛和脊髓压缩等并发症,严重影响患者生活质量和治疗依从性。研究[5]表明,肥胖后血液中脂肪酸水平显著增高,而作为脂肪的合成原料,脂肪酸可以促进骨中脂肪细胞的分化。笔者前期比较了正常个体和前列腺癌患者血清37 种脂肪酸的水平[6],发现前列腺癌患者辛酸水平显著高于正常个体。此外,王晓希等[7]的研究指出,前列腺癌骨转移患者血清25 羟基维生素D(25 hydroxyvitamin D,25-OH-D)含量降低,并指出血清25-OH-D 含量降低是引起前列腺癌骨转移的原因之一。然而,维生素D、辛酸与前列腺癌骨转移之间的关系尚未被研究确认,本研究设计研究维生素D 治疗对辛酸高脂饮食引起的前列腺癌小鼠骨转移的影响。
1 材料与方法
1.1 实验动物与分组 40 只C57BL/6 小鼠(6 ~8 周,20 ~23 g)购买自北京维通利华实验动物技术有限公司。所有小鼠腹腔注射1%戊巴比妥钠溶液进行,参考毕永祥等[8]的研究,在小鼠膝关节股骨下端,顺着股骨长轴注射106个RM-1 细胞/20 μL 以建立前列腺癌骨转移模型。然后,将所有小鼠随机分为Control 组、High fat 组、Bitter 组和Vitamin D 组,每组10 只。Control 组:正常给予正常饲料喂养;High fat 组:给予高脂肪饲料(010139-03,斯贝福(北京)生物技术有限公司)喂养;Bitter 组:给予添加2%辛酸(P5585,北京索莱宝科技有限公司)高脂肪饲料喂养;Vitamin 组:给予添加2%辛酸(P5585,北京索莱宝科技有限公司)高脂肪饲料喂养,并且每两天按照2.5 μg/kg 灌胃给予维生素D(BD224107,杭州馨然生物科技有限公司)治疗。本研究实验动物经石河子大学附属第一医院伦理委员会批准(实验动物伦理编号:A2017-115-01)。
1.2 细胞培养与处理 小鼠前列腺癌细胞RM-1(CRL-3310,美国典型培养物保藏中心)培养在DMEM 培养基(D6046,Sigma Aldrich,USA),培养条件为:37 ℃+5% CO2。RM-1 细胞根据处理方法不同分为Control 组、Bitter only 组和Vitamin D 组。Control 组:RM-1 细胞不进行任何处理培养48 h;Bitter only 组:40 μmol/L 辛酸处理48 h;Vitamin D组:10 nmol/L维生素D和40 μmol/L辛酸处理48 h。
1.3 血清脂质、钙和25-OH-D 检测 小鼠在完成30 d 对应喂养后被安乐死,眼球摘取收集外周血,离心(1 000 ×g,室温,10 min)以收集血清,使用全自动生化分析仪(AU5800,贝克曼)检测血清总胆固醇、甘油三酯、低密度脂蛋白和钙含量;使用小鼠25 羟基维生素D(25 hydroxyvitamin D,25-OHD)ELISA 试剂盒(M176656,北京迈瑞达科技有限公司)检测血清25-OH-D 含量。
1.418F-氟化钠PET/CT 检测 所有小鼠经尾静脉注射185 kBq/g 的18F-氟化钠(18F-NaF),1 h 后使用小动物PET/CT 活体成像系统(上海玉研科学仪器有限公司)进行全身成像,并计算最小/最大/平均标准化摄取值(SUVmin、SUVmax和SUVmean)。
1.5 Transwell 小室检测细胞迁移和侵袭 在评价细胞迁移能力时,transwell 上室不做任何处理;而在评价细胞侵袭能力时,在接种细胞前,Matrigel胶被预先铺到transwell 上室中。取1 × 104个转染后的RM-1 细胞接种到24 孔Transwell 的上室中,加无血清培养基常规培养。24 h 后,取出并去除培养基,用PBS 洗涤2 次,然后加入甲醇固定30 min厚干燥。干燥后的膜片经结晶紫染色20 min 后,在显微镜下计数下室细胞数目。
1.6 蛋白免疫印迹法 使用RIPA 裂解液(R0010,Solarbio,中国)从细胞中提取总蛋白。然后使用BCA 试剂盒(C503021,Sangon Biotech,中国)检测总蛋白质的浓度。最后,在90 V 恒定电压下,通过10% SDS-PAGE 分离50 μg 总蛋白。将蛋白从SDS-PAGE 凝胶转移到PVDF 膜上,5%脱脂牛奶室温封闭1 h。用PBS(135 mmol/L NaCl,2.7 mmol/L KCl,1.5 mmol/L KH2PO4,8 mmol/L K2HPO4,用HCl和NaOH 将pH 调整到7.2)洗涤膜3 遍后,将膜与E-cadherin(ab231303,abcam)、p-p8(ab178867,abcam)和p38(ab170099,abcam)抗体在4 ℃孵育过夜。然后在室温下添加二抗孵育2 h。用磷酸盐缓冲液-洗涤3 次后,加入ECL 溶液(WBKLS0100,北京新晶科生物技术有限公司,中国)进行检测。所有本次研究的抗体均购买自ABCAM 公司。
1.7 统计学方法 研究数据通过SPSS 20.0 软件进行统计学分析。以Turkey 为事后检验的单因素方法分析被用于比较多组间的差异;配对独立样本t检验被用于比较两组间的差异。P<0.05 表示差异有统计学意义。
2 结果
2.1 维生素D 改善辛酸高脂喂养小鼠血清脂质与正常饲料喂养的Control 组小鼠相比,高脂饲料喂养的High fat 组小鼠和添加辛酸的高脂饲料喂养的Bitter 组小鼠血液中总胆固醇、甘油三酯和低密度脂蛋白含量均升高(P<0.05);并且Bitter 组小鼠显著高于High fat 组(P<0.05)。与Bitter 组相比,维生素D 治疗的辛酸高脂饲料喂养的Vitamin D组小鼠血液中总胆固醇、甘油三酯和低密度脂蛋白含量均降低(P<0.05)。见图1。
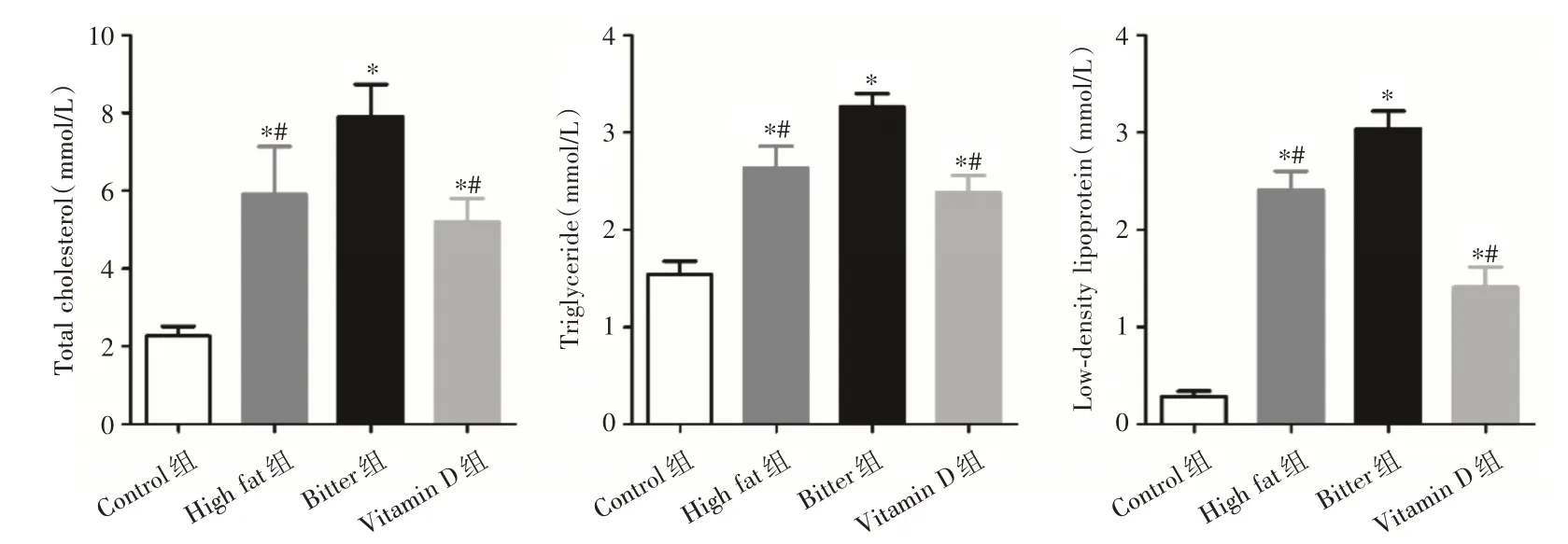
图1 维生素D 对辛酸高脂喂养的前列腺癌小鼠血清脂质的影响Fig.1 Effect of vitamin D on serum lipids of prostate cancer mice fed with caprylic acid/high fat
2.2 各组前列腺癌小鼠骨转移CT 指标比较 与Control 组小鼠相比,Hight fat 组和Bitter 组小鼠18FNaF PET/CT 检测结果中SUVmin、SUVmax和SUVmean均升高(P<0.05);并且Bitter 组小鼠显著高于High fat组(P<0.05)。与Bitter组相比,Vitamin D组小鼠18FNaF PET-CT 检测结果中SUVmin、SUVmax和SUVmean均降低(P<0.05)。见图2。

图2 维生素D 对辛酸高脂喂养的前列腺癌小鼠骨转移指标的影响Fig.2 Effect of vitamin D on bone metastasis index of prostate cancer mice fed with caprylic acid/high fat
2.3 各组小鼠血钙和25-OH-D 含量的比较 与Control 组小鼠相比,Hight fat 组和Bitter 组小鼠血液钙含量均升高(P<0.05);并且Bitter 组小鼠显著高于High fat 组(P<0.05)。与Bitter 组相比,Vitamin D 组小鼠血液钙含量降低(P<0.05)。与Control 组小鼠相比,Hight fat 组和Bitter 组小鼠血液25-OH-D 含量均降低(P<0.05);并且Bitter 组小鼠显著低于High fat 组(P<0.05)。与Bitter 组相比,Vitamin D 组小鼠血液25-OH-D 含量升高(P<0.05)。见图3。

图3 维生素D 对辛酸高脂喂养的前列腺癌小鼠血钙和25-OH-D 的影响Fig.3 Effect of vitamin D on serum calcium and 25-OH-D in prostate cancer mice fed with caprylic acid / high fat
2.4 维生素D 抑制辛酸促进的前列腺癌细胞体外转移 在体外,与不进行任何处理的Control 组相比,辛酸处理的Bitter only 组RM-1 细胞迁移和侵袭细胞数目均升高(P<0.05);与Bitter only 组,Vitamin D 组RM-1 细胞迁移和侵袭细胞数目均降低(P<0.05)。见图4、5。
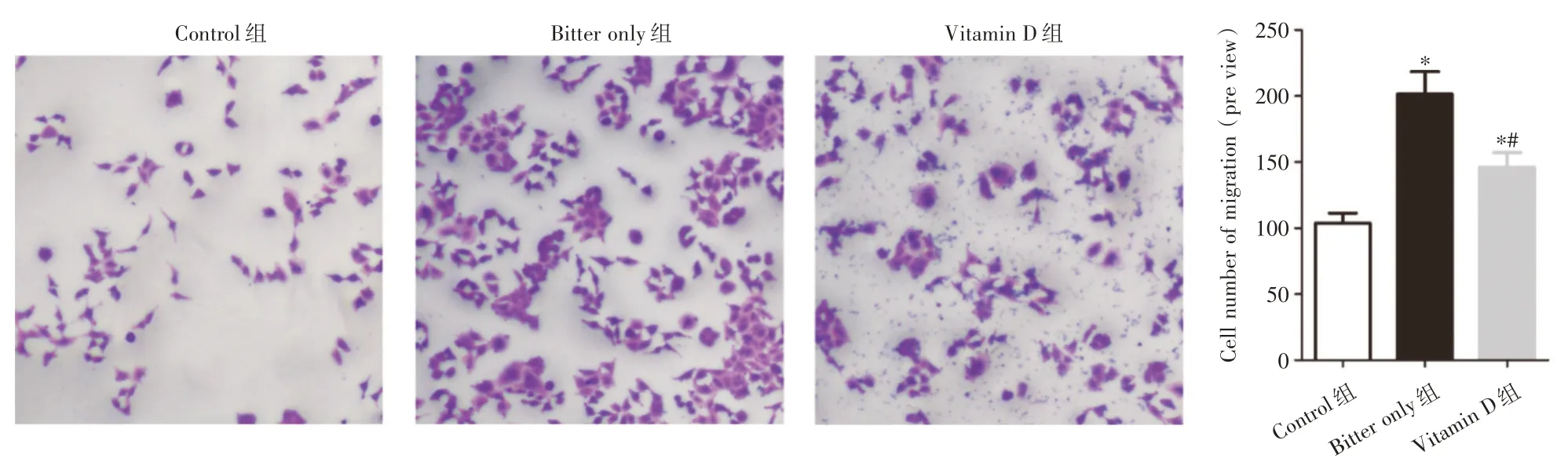
图4 维生素D 抑制辛酸促进的前列腺癌细胞体外迁移(× 200)Fig.4 Vitamin D inhibits the migration of prostate cancer cells promoted by caprylic acid in vitro(× 200)
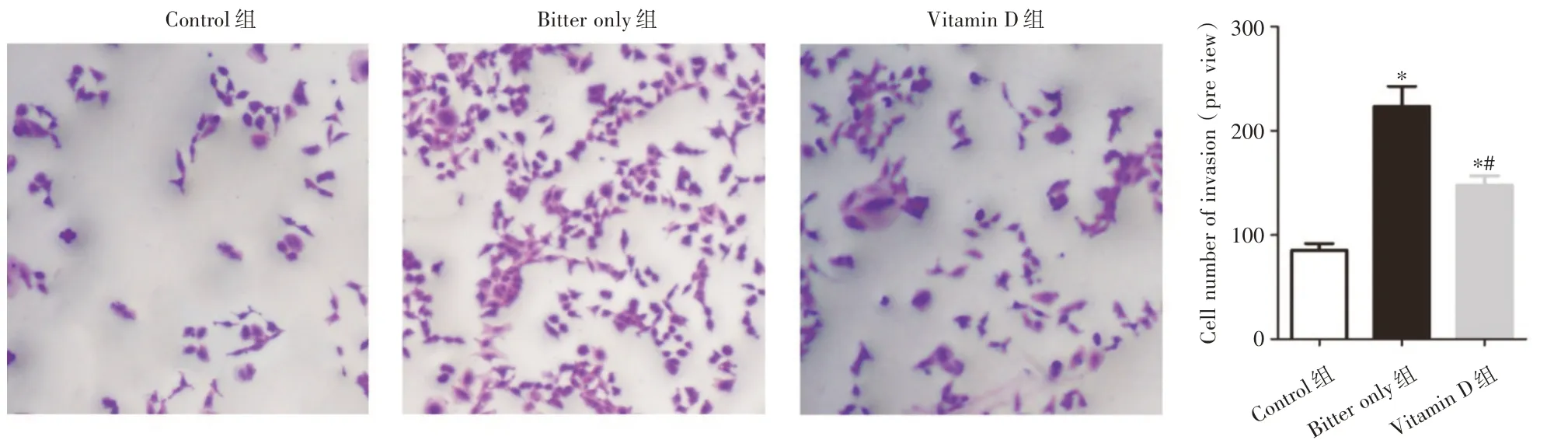
图5 维生素D 抑制辛酸促进的前列腺癌细胞体外侵袭(× 200)Fig.5 Vitamin D inhibits the invasion of prostate cancer cells promoted by caprylic acid in vitro(× 200)
2.5 维生素D 对辛酸高脂喂养前列腺癌小鼠肿瘤组织E-cadherin 和p38 表达的影响 与Control 组相比,Hight fat 组和Bitter 组前列腺癌骨转移小鼠肿瘤组织E-cadherin 和p-p38/p38 蛋白表达均升高(P<0.05);并且Bitter 组小鼠高于High fat 组(P<0.05)。与Bitter 组相比,Vitamin D 组列腺癌骨转移小鼠肿瘤组织E-cadherin 和p-p38/p38 蛋白表达均降低(P<0.05)。见图6。
3 讨论
前列腺癌是目前造成男性患者死亡的第二位恶性肿瘤[9],其中骨转移是前列腺癌最常见的转移位置[10]。流行病学研究[11]发现,肥胖是前列腺癌患者发生骨转移的独立危险因素,并且肥胖也对前列腺癌患者手术治疗效果、放疗生物表型重现、癌细胞复发转移以及死亡率产生影响。研究发现[12],对临床分期一致的前列腺癌患者使用相同的临床治疗方案,肥胖患者骨转移发生率是正常患者的2 ~3 倍。此外,我们团队前期研究发现[6],前列腺癌骨转移患者血清辛酸含量增高。然而,肥胖和辛酸对前列腺癌骨转移的影响未被研究所证实。
本研究发现,高脂肪饮食可显著提高实验动物血液中脂质含量,并且添加辛酸后脂质含量更高。此外,研究还发现辛酸/高脂饮食不仅在体内增加前列腺癌骨转移指标,而且辛酸还在体外促进小鼠前列腺癌细胞的侵袭和迁移,这表明辛酸/高脂饮食促进前列腺癌骨转移。进一步分析可知[13-14]:高脂肪饮食引起体内脂肪细胞的增加,尤其是骨髓脂肪细胞增多,而富含脂肪细胞的代谢活跃红骨髓对转移癌细胞的克隆和生长都具有吸引力,并且研究指出骨髓脂肪细胞的增多所引起的骨髓微环境特征性变化可能对前列腺癌选择性骨转移的发生具有特殊的作用。辛酸是含有8 个C 的饱和脂肪酸,在体内对其他外源性脂肪酸和胆固醇的吸收有重大影响[15]。此外,笔者前期的研究也发现[6],辛酸可通过影响骨髓腔中脂肪细胞与成骨细胞的构成比而促进前列腺癌骨转移。因此,结合本研究结果表明,辛酸、高脂肪饮食均促进前列腺癌骨转移。
维生素D 是人体血液中钙离子水平调控的重要物质,其在血液中以25-OH-D 的形式存在。之前的研究表明,肿瘤细胞发生骨转移的必要物质之一是血钙,并且临床数据显示血钙含量越高的晚期癌症患者临床预后一般较差[16-17]。王晓希等人[7]在比较正常人、前列腺癌无骨转移和前列腺癌骨转移患者血钙和血25-OH-D 时发现,前列腺癌骨转移患者血钙含量最高,而血25-OH-D 含量最低。本研究通过灌胃给予维生素D 以研究维生素D 对辛酸/高脂饮食促进的前列腺癌骨转移的影响,结果显示:维生素D 治疗不仅显著降低辛酸/高脂饮食引起的血脂质和血钙升高,而且显著降低前列腺癌骨转移小鼠骨转移指标和显著提高血清25-OH-D 含量,并在体外抑制辛酸增高的前列腺癌细胞侵袭和转移能力。这表明维生素D 可以通过增加小鼠体内25-OH-D 含量而降低辛酸/高脂饮食引起的前列腺癌骨转移。进一步分析可知[18-19]:维生素D 不仅可以通过负调控血钙浓度而抑制肿瘤细胞骨转移,而且对多种肿瘤细胞的增殖分化、血管形成和远端转移均具有重要的调控作用[20]。
上皮细胞钙黏蛋白(E-cadherin)是一种细胞黏附蛋白,其表达水平与癌细胞侵袭迁移能力密切相关[21-22]。p38 蛋白的磷酸化已经被多项研究证实与前列腺癌细胞骨转移有关[23]。本研究发现,辛酸前列腺癌骨转移小鼠肿瘤组织促进E-cadherin 和p-p38/p38 蛋白表达,而维生素D 则减弱/逆转辛酸的这一作用,即维生素D 在辛酸/高脂喂养的前列腺癌骨转移小鼠肿瘤组织抑制E-cadherin和p-p38/p38 蛋白表达,这一结果与ZHANG 等[24]和ZHOU 等[25]的研究结果一致。ZHANG 等研究指出,维生素D 缺乏促进前列腺癌细胞E-cadherin,进而增强前列腺癌细胞的侵袭迁移能力;而ZHOU 等的研究则指出,维生素D 可显著降低细胞中p38 蛋白的磷酸化。结合本研究结果表明,维生素D 抑制辛酸促进的前列腺癌骨转移的分子机制可能与抑制E-cadherin 和p-p38/p38 蛋白表达有关。
综述所述,维生素D 治疗抑制辛酸高脂饮食促进的前列腺癌小鼠骨转移,其机制可能与增加血清25-OH-D 含量和抑制癌细胞中E-cadherin、pp38/p38 蛋白表达有关。
【Author contributions】ZHAO Haijun performed the experiments and wrote the article.LI Wei and WEI Yu performed the experiments.ZHANG Licui and ZHANG Yu revised the article.WANG Xinmin and WANG Cuizhe designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

