let-7c-5p通过靶向CD74基因在糖尿病视网膜病变中的致病作用
杨立平,曹亚微,王亚莉,刘一栋
糖尿病是一种以高血糖为特征的慢性代谢紊乱,其病因是糖稳态受损、胰岛素活性降低和胰岛素抵抗。高血糖的长期并发症包括血脂异常、高血压和氧化应激。这些反过来又导致严重的多系统并发症,导致微血管和神经功能障碍,包括肾病、神经病变、大血管相关中风、缺血性心脏病和视网膜病变。糖尿病视网膜病变(DR)是其严重的多系统并发症之一,其发展缓慢且往往是隐匿的。这种疾病是工作年龄成年人视力丧失的最常见原因,其特征是视网膜的功能和形态变化。它是由血管改变引起的缺血和炎症状况恶化引起的,例如白细胞淤滞的发展、基底膜的增厚、视网膜新生血管和玻璃体视网膜界面处的纤维血管组织形成。而目前所有的疗法都针对DR的后期阶段,因此,及早发现早期预警标志物并探明其调节机制对DR防控具有重要意义。
微RNA(miRNA)是一种单链非编码小RNA(19~22个核苷酸),它们也属于高度保守的内源性RNA序列。到目前为止,已经在整个人类基因组中鉴定出约2 000个miRNA,并在生理学和病理生理学中发挥重要作用,参与主要的生物过程,包括细胞生长,分化和凋亡。miRNA作为参与糖尿病微血管并发症的潜在参与者而受到广泛关注,影响肾脏,视网膜和外周神经元[1-4]。研究表明,异常表达的miRNA在微血管并发症的关键致病过程中具有关键作用[5],例如氧化应激、细胞凋亡、炎症和血管生成。DR是一种进行性疾病,其持续时间依赖性,在严重程度逐渐增加的阶段发展,伴有氧化应激、炎症和血管生成等,导致微血管改变[6]。高血糖是DR中已知的诱因,可能引起氧化应激[7],研究表明miRNA表达水平的变化可能与DR 的发生和进展有关[8]。并且高血糖还会刺激炎症并促进视网膜血管功能障碍,导致毛细血管通透性和血管渗漏增加[9-10]。因此,炎症信号通路在DR进展中可能扮演着不可或缺的角色。miRNA可以与mRNA靶标的非翻译区(UTR)中发现的miRNA反应元件上的mRNA相互作用[11-13]。总之,miRNA以各种方式参与DR的发病机制,包括炎症、氧化应激和血管生成。研究它们在DR中的作用可以导致对疾病的发展及其有效治疗的更详细的了解。随着更多miRNA的发现,miRNA作为DR中的生物标志物已成为研究热点[14]。
加权基因共表达网络分析(WGCNA)是一种用于描述微阵列样本中基因之间的相关性的模式系统生物学方法,广泛用于识别候选生物标志物或治疗靶标[15]。例如,使用WGCNA方法构建共表达网络以探索糖尿病相关易感模块和心血管疾病基因的研究[16]。在本研究中,我们使用WGCNA方法筛选出DR进展的核心miRNA和核心基因,通过双萤光素酶实验验证了两者的靶向结合关系,可为DR的诊断和治疗提供新的思路。
1 资料与方法
1.1 数据来源 本研究所有数据来源基因表达综合数据库(Gene Expression Omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/),从GEO数据库GSE160306、GSE160308数据集中获得43例正常对照和80例糖尿病视网膜病变病人的miRNA表达谱数据。
1.2 加权基因共表达网络的构建 GSE160306、GSE160308数据集包括80例糖尿病视网膜病变病人的性别、年龄和病理评分,适合构建加权基因共表达网络。使用R包“WGCNA”构建GSE160306、GSE160308基因表达数据矩阵,选择样本中方差最大的前25%的基因作为后续WGCNA的输入数据集。为了选择标准的无标度网络,在选择合适的软阈值函数之前,采用样本层次聚类方法检测并去除异常样本。下一阶段,构建邻接矩阵和拓扑重叠矩阵(TOM),计算对应的相异度(1-TOM),并采用动态树切割完成基因树和模块识别。最小模块大小为30。然后通过聚类融合模块特征基因,将高度相似的模块合并。
1.3 核心网识别 将所需模块中的基因输入到相互作用基因/蛋白质检索工具(STRING,https://cn.string-db.org/)网站进行蛋白质-蛋白质相互作用(protein-protein interaction ,PPI)分析,并获得PPI分数。然后,将结果导入Cytoscape并使用MCODE插件进行分析。
1.4 细胞培养 人视网膜内皮细胞(human retinal endothelial cells,HREC)用含1 g/L葡萄糖的DMEM培养基与10%胎牛血清和1%青霉素/链霉素培养。融合细胞在无血清的DMEM培养基中饥饿过夜,以减少血清的影响,然后以高浓度葡萄糖(25 mmol/L)刺激24 h。
1.5 实时荧光定量逆转录聚合酶链反应(qRTPCR) 使用Trizol试剂(Invitrogen, Carlsbad, CA)按照制造商的指导原则从各组细胞中提取总RNA。用Primescript RT试剂盒(Takara,中国大连) 将RNA合成互补DNA(cDNA)。利用SYBR Green mix (Takara)在Applied Biosystems 7500仪器中进行cDNA扩增和定量。本研究使用的引物序列在表1。采用2-ΔΔCt法测定基因相对表达量。内对照分别为Ⅱ型穿膜蛋白CD74和let-7c-5p的甘油醛-3-磷酸脱氢酶(GAPDH)和U6。
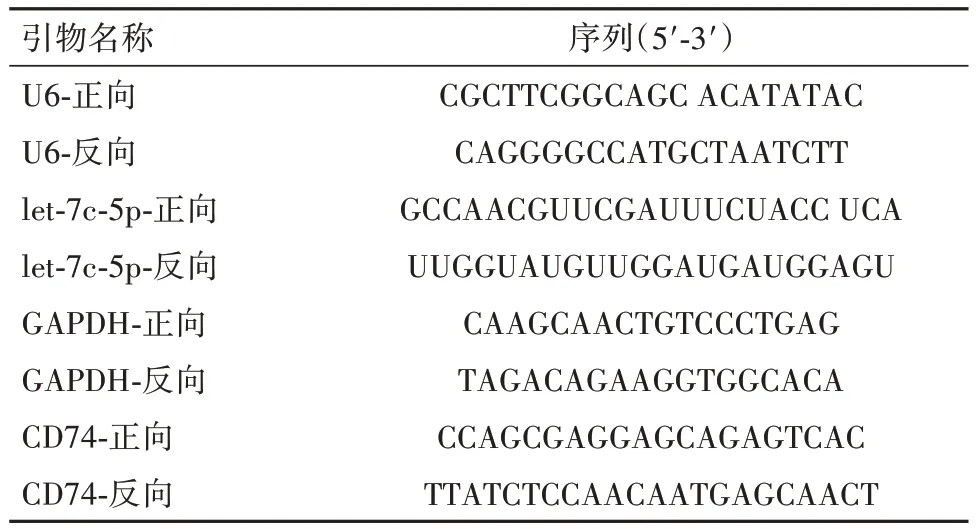
表1 引物序列
1.6 双萤光素酶报告实验 将含有let-7c-5p结合位点的野生型(WT)或突变型(MUT)CD74片段引入pGL3-basic载体(Promega, Madison, WI, USA)。为了进行萤光素酶检测,Hep-2细胞同时加入let-7c-5p模拟物或相应的阴性对照(NC)。48 h后,应用萤光素酶报告系统(Promega)来检查萤光素酶的活性。
1.7 统计学方法 采用SPSS 24.0和GraphPad Prism 8.0.1软件处理数据。符合正态分布计量资料以表示,两组间比较采用两独立样本t检验,采用Pearson相关性分析检验两变量的相关性。以P< 0.05为差异有统计学意义。
2 结果
2.1 WGCNA鉴定与DR进展相关的核心miRNA 为了鉴定与DR进展相关的miRNA,我们通过WGCNA在GSE160308中构建共表达网络,使用80个样本构建邻接矩阵(图1A)。在本研究中,我们选择β=5作为阈值构建无缩放网络(图1B、1C),在使用合并的动态树切割后共鉴定出4个miRNA表达模块,通过构建随机基因网络图谱,分析其与DR进展的相互作用关系,通过计算模块特征基因与临床特征之间的相关性,我们发现turquoise模块与DR的发展相关性最强(图1D),随后我们以severity score≥0.2与相关系数≥0.8共获得let-7c-5p和miR-26a-5p两个核心miRNA(图1E)。
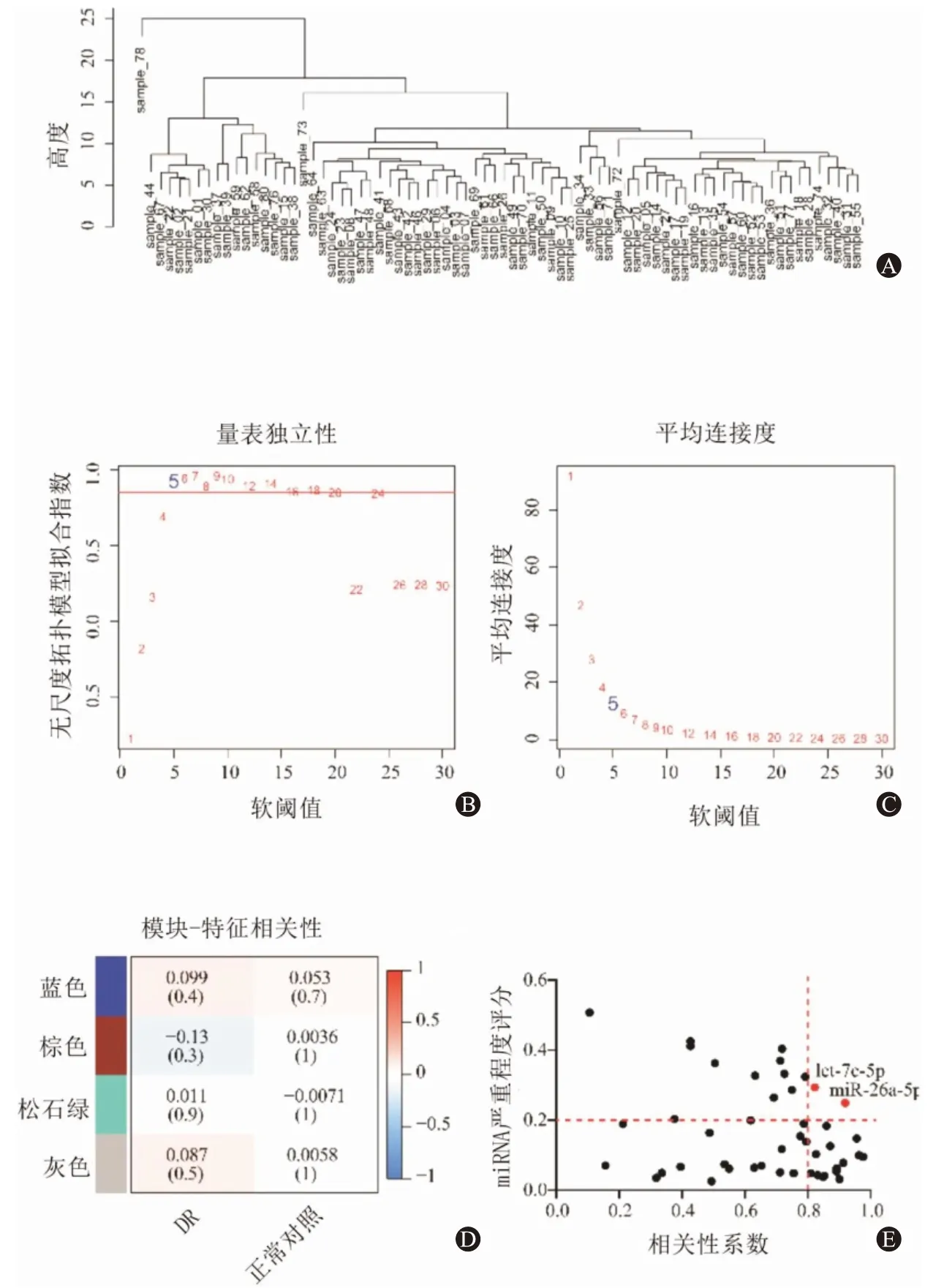
图1 鉴定与糖尿病视网膜病变(DR)进展相关的核心微RNA(miRNA):A为样本树状图;B、C分别为分析无尺度拟合指数和各种软阈值函数的平均连通性,评估β=5时的无缩放拓扑;D为模块特征基因与DR临床性状相关性的热图;E为miRNA severity score与相关系数散点分布图(每个点代表一个miRNA)
2.2 WGCNA鉴定与DR进展相关的核心基因随后,我们进一步鉴定与DR进展相关的基因,通过WGCNA在GSE160308构建共表达网络,在本研究中,我们选择β=3作为阈值构建无缩放网络,动态树切割后共鉴定11个基因模块。为了获得中心基因,我们分析了与DR相关性最高模块中基因的PPI网络,将结果导入Cytoscape软件,用MCODE插件进行处理,并在度截止值=2的条件下得到11个核心基因,包括CD74(图2)。
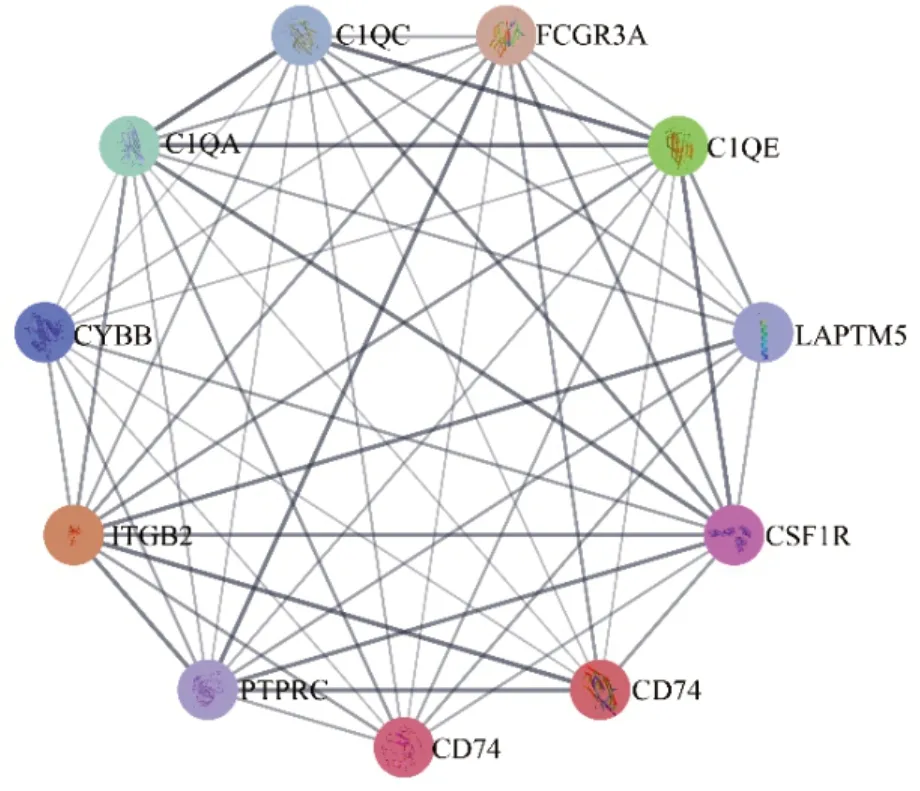
图2 与糖尿病视网膜病变(DR)相关性最强的模块中的蛋白质-蛋白质相互作用(PPI)核心网络
2.3 高糖诱导的视网膜细胞let-7c-5p与CD74表达及相关性 为了进一步验证DR进展的调节机制,探寻核心miRNA和核心基因的相互关系。我们通过ENCORI数据库对核心miRNA和核心基因进行匹配,发现let-7c-5p与CD74存在靶向结合的可能性,因此我们在高糖诱导的人类视网膜细胞中检测let-7c-5p和CD74的表达水平,结果表明与正常培养的人类视网膜细胞(1.01±0.02,1.00±0.01)相比,高糖处理的会显著下调let-7c-5p的水平(0.46±0.08,t=20.01,P<0.001)和显著上调CD74的水平(3.62±0.13,t=60.28,P<0.001)。随后,我们对let-7c-5p 和CD74两者之间的相关性进行分析,发现两者呈现负相关关系(r=-0.99,P=0.012)。
2.4 let-7c-5p靶向抑制CD74表达 为了确定在人类视网膜细胞中let-7c-5p靶向结合CD74,我们在ENCORI数据库中预测let-7c-5p与CD74的结合位点(图3)。此外,let-7c-5p模拟物降低了CD74-WT的相对萤光素酶活性(1.00±0.01比0.43±0.06;t=28.11,P<0.001)。我们没有发现CD74-MUT组之间的差异(1.01±0.03比0.99±0.02;t=1.66,P=0.116)。
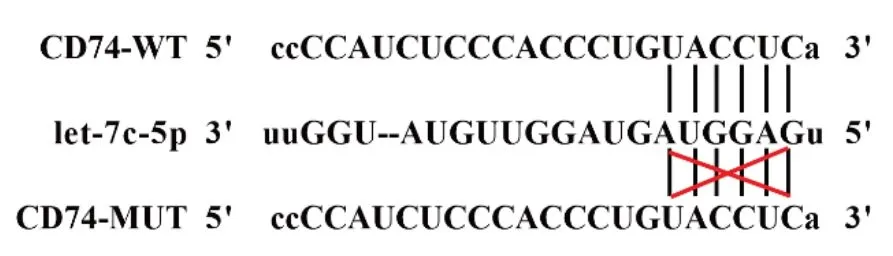
图3 生物信息学网站预测let-7c-5p与CD74的结合位点
3 讨论
DR是糖尿病最常见的并发症之一,并且仍然是全球视力丧失和失明的主要原因[17]。糖尿病会影响眼睛的许多组成部分,但威胁视力的主要病理发生在视网膜中。尽管在 DR 的预防和治疗方面取得了重大进展,但是DR的失明率并未见下降,这表明 DR 的预防和抑制仍然面临多重挑战,需要进一步研究。与传统检测和治疗手段相比,miRNA的在其中扮演的角色可能非常重要。因此,通过生物信息学方法筛选关于DR进展相关的核心miRNA和核心基因,探明核心miRNA与核心基因之间的相互调节关系可能为DR进展的调控作用机制提供新的见解,可为治疗DR提供新的方法。
在本研究中,我们通过WGCNA筛选出关于DR进展的两个核心miRNA(let-7c-5p和miR-26a-5p),其中let-7c-5p在DR中显著下调。在Grieco等[18]的研究中,DR病人血液循环中let-7c-5p不仅比正常的病人低,还比2型糖尿病的病人低。此外还有研究表明,在1型糖尿病(T1D)中, let-7c-5p与病人快速进展为终末期肾病的风险相关[19]。同时还有研究表明,let-7c-5p与2型糖尿病肾病的进展有关,可以作为2型糖尿病肾病的诊断标志物[20]。在我们的研究中let-7c-5p与DR进展相关,并且let-7c-5p呈现显著下降趋势。在周小平、欧邝[21]的研究中,过表达let-7c-5p可以阻止大鼠DR模型的发展。以上数据表明,通过WGCNA筛选的let-7c-5p可以作为鉴定DR进展的标志物,通过监测let-7c-5p可以有效鉴定DR进展情况,但是本研究并未针对临床资料进行研究,缺乏数据体现,后续研究将主要分析let-7c-5p对DR临床意义,这也是我们后续的研究目标。
本研究通过WGCNA筛选出DR进展的核心miRNA和核心基因,并在细胞中进行let-7c-5p与CD74的表达水平和相关性,结果表明let-7c-5p靶向抑制CD74的表达。CD74是一种跨膜糖蛋白,作为伴侣调节细胞内蛋白质运输,是细胞因子巨噬细胞移动抑制因子(MIF)和D-多巴色素互变异构酶 (DDT/MIF-2) 的同源细胞表面受体。在一项关于人类1型糖尿病病人基因表达谱进行的最大规模的研究发现,CD74是其中上调的基因之一,这些基因主要富集在炎症响应通路中,参与高糖引起的免疫调控[22]。MIF/CD74轴在许多疾病中起到了至关重要的作用,在糖尿病足细胞损伤中,CD74在足细胞中充当MIF的受体,在糖尿病肾病的发病机制中发挥作用[23]。在一些研究中,MIF作为T1D疾病发病机制的一个促成因素,在糖尿病小鼠模型中,MIF基因表达和CD74+白细胞频率增加,表明MIF/CD74 信号通路在促进T1D中巨噬细胞介导的炎症中的可能作用[24]。最近有研究表明,二甲双胍作为糖尿病的有效治疗药物,可在2型糖尿病病人中表现出其足细胞保护能力,其潜在机制可能部分归因于其抑制MIF-CD74轴介导的炎症级联反应的作用[25]。而在DR中MIF/CD74信号传导参与增殖性糖尿病视网膜病变[26]。此外,血管功能障碍和血管退化是各种炎症性中枢神经系统疾病和炎症相关视网膜疾病(如糖尿病视网膜病变)的标志。小胶质细胞的激活和体液先天免疫系统是促成因素。已经提出抗炎方法作为神经血管疾病的疗法,包括调节小胶质细胞活化。小胶质细胞活化与炎症性视网膜血管侵犯相关[27],而MIF/CD74信号传导阻碍小胶质细胞M1极化[28]。
总之,本研究通过WGCNA方法筛选出DR进展核心miRNA let-7c-5p和核心基因CD74,且两者存在靶向抑制关系,通过探明let-7c-5p通过靶向抑制CD74 在 DR进展中的作用,可为DR的治疗开发新的遗传治疗策略的靶标。

