微RNA-24过表达对缺血性脑梗死大鼠的脑保护作用及对神经细胞凋亡的影响
陈辉,赵春水,张春伟,刘欣
缺血性脑梗死(ischemic cerebral infarction,ICI)是常见的脑血管疾病,致死率、病死率均较高,且发病率逐渐升高[1]。目前超早期溶栓是治疗ICI的最佳方式,但其受治疗时间窗限制,且易并发脑出血,临床应用受到限制[2]。因此,探寻更为有效的ICI治疗方式备受关注,而基因治疗被认为是该病有希望的治疗途径之一。ICI的治疗原则在于保护缺血半暗带神经细胞,减少其凋亡,以尽早恢复缺血区域供血,挽救濒死脑组织,故基因抗凋亡成为ICI实验研究热点之一[3]。微RNA(miRNA/miR)是由18~25个核苷酸构成的内源性非编码RNA,其不编码蛋白质,通过调控基因转录后水平参与蛋白表达,从而促进mRNA降解或抑制蛋白翻译过程。目前已经发现miRNA在多种中枢神经系统疾病如ICI中发挥着重要作用[4]。有学者指出,miR-24在急性脑梗死病人中低表达,且可作为该病进展的生物标志物,为ICI基因治疗提供了思路[5]。2020年1月至2022年1月,本研究通过建立ICI大鼠模型,分析miR-24过表达对其脑保护作用及对神经细胞凋亡的影响,现报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 45只SPF级SD雄性大鼠,6周龄,体质量(200±10)g,购自北京科宇动物养殖中心,动物生产许可证号:SCXK(京)2018-0010,动物使用许可证号:SYXK(豫)2020-0002。自由进食、饮水,温度22~26 ℃,12 h/12 h明暗交替,适应性饲养1周。本研究符合一般动物实验伦理学原则。
1.1.2 主要试剂和仪器 含有miR-24激动剂miR-24 agomir、miR-24抑制剂miR-24 antagomir、阴性对照(negative control,NC)序列的pcDNA 3.0质粒(苏州吉玛基因股份有限公司);SYBR Green荧光定量染料法试剂盒(美国Thermo Fisher Scientific公司);2% TTC染色液(上海信帆生物科技有限公司);兔抗鼠神经元核抗原(neuronal nuclei antigen,NeuN)、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)一抗(美国Abcam公司)。
StepOne Puls实时荧光定量逆转录聚合酶链反应(qRT-PCR)仪(美国Applied Biosystems公司);Synergy-HD显微镜(日本Toshiba公司);Mini Protean 3 Cell小型垂直电泳(美国伯乐公司)。
1.2 方法
1.2.1 分组及立体定向注射 45只大鼠以随机数字表法分为健康组(8只)、脑梗死组(9只)、脑梗死过表达组(9只)、脑梗死低表达组(9只)、脑梗死NC组(10只)。选取接近脑缺血半暗带皮质位置、距离脑梗死内缘0.5~1.0 mm处注射。戊巴比妥钠腹腔注射麻醉,将其固定于立体定向仪上,消毒脑部顶部皮肤并清除毛发,在两耳中点向后3 cm切口,逐层分离皮下组织,暴露前囟、矢状缝、右侧颅骨表面,选取两个注射点,注射点1:前囟前1.7 mm,矢状缝右侧3.8 mm,深2.8 mm。注射点2:前囟后3.3 mm,矢状缝右侧3.8 mm,深2.3 mm。用胰岛素针吸取腺病毒,在脑梗死过表达组、脑梗死低表达组、脑梗死NC组两个注射点分别注射miR-24 agomir、miR-24 antagomir和miR-24阴性对照序列,注射速度1 μL/min,总量10 μL。注射完成后撤出针头,采用骨蜡将颅骨孔道封闭,缝合头皮。健康组与脑梗死组同法、同位置、同量注射生理盐水。
1.2.2 模型建立[6]立体定向注射后24 h采用改良Longa线栓法建立ICI模型。戊巴比妥钠腹腔注射麻醉,钝性分离右侧颈部肌群,分离、结扎右颈总动脉、颈外动脉与分支。距离颈总动脉1 cm位置采用1 mL注射液针头将右颈总动脉上壁分离刺破,将尼龙线从颈总动脉插入内动脉,感受到阻力停止,深度18~20 mm,线栓即到达并阻塞大脑中动脉开口处,扎紧动脉残端,常规缝合、消毒。健康组将阻塞线插入颈内动脉深度约5 mm,其余步骤同上。大鼠清醒后单笼饲养,采用Zea-longa神经功能评价方法评价神经功能,评分范围为0~4分,1、2、3分提示建模成功,0、4分剔除。最终各组均纳入8只。建模成功后1、3 d采用Zea-longa神经功能评价方法评价大鼠神经功能。
1.2.3 组织取材 神经功能评价完成后,戊巴比妥钠腹腔注射麻醉,剪开胸廓,镊子轻固定心脏,输液针头插进左心室,剪开右心房,迅速推注多聚甲醛至大鼠右心房流出无色液体。脱颈处死,剥离颅骨,将脑组织迅速取出,清除血污,4只置于冰上用于TTC染色;4只取脑组织中动脉供血区域,分成2份,1份保存于液氮中,1份固定于4%多聚甲醛中。
1.2.4 qRT-PCR检测脑组织miR-24 mRNA表达取液氮保存脑组织,转录得互补DNA(cDNA),鉴定后试剂盒说明书要求设定反应体系(总反应体系20 μL:SYBR Green Mix 11 μL,正、反向引物各1 μL,DNA模板1.0 μL,双蒸水7.0 μL)及反应条件(95 ℃35 s,60 ℃ 30 s,72 ℃ 30 s),重复40次,72 ℃延伸4 min。以U6为内参基因,2-ΔΔCt法计算。实验所用引物:miR-24正向:5′-TGACGCTTACGTGAACTCCACCAC-3′,反向:5′-GTACCACGCTGCACGGACGTGCAC-3′;U6正向:5′-GTGCACGCACGTGTGTCCAACCAC-3′,反向:5′-GTGCACCTACCACGCACGTGCTGC-3′。所有实验重复3次取平均值。
1.2.5 TTC染色法检测脑梗死体积 取冰上保存脑组织,-20 ℃中存放30 min取出,沿冠状面从前脑额部向后连续切成2 mm薄片,迅速置入磷酸缓冲盐溶液(PBS)溶液中(含2% TTC染色液),37 ℃避光孵育30 min,每5分钟轻晃1次容器,4%多聚甲醛固定12 h,取出后PBS充分洗涤,拍照后经Image Pro Plus 6.0分析图像。正常脑组织为鲜红色,梗死灶为苍白色。测量每片梗死面积、总面积,梗死体积=层厚×梗死面积乘积,总梗死体积为各层梗死体积之和。
1.2.6 免疫组织化学染色检测脑皮质NeuN表达取4%多聚甲醛固定的脑组织,病理切片机切成厚度5 μm切片;二甲苯Ⅰ、Ⅱ溶液中脱蜡10 min;3%H2O2溶液温箱中孵育25 min使内源性酶失活,PBS缓冲液冲洗;常温孵育微波修复抗原,冷却后5%胎牛血清封闭,加入兔抗鼠NeuN一抗(1∶400),4 ℃孵育过夜;PBS溶液摇床洗涤切片,加入辣根过氧化物酶标记的二抗(1∶800),常温孵育60 min;PBS洗涤,滴加DAB显色液,乙醇脱水干燥,中性树胶封片。光学显微镜下随机选取5个不相邻切片观察、计数缺血半暗带被染成棕褐色的神经元数量,Image J2x软件分析。
1.2.7 蛋白质印迹法检测脑组织Bcl-2、Bax蛋白表达 取40 mg液氮保存脑组织,眼科剪剪碎,匀浆后移至离心管,RIPA裂解液提取蛋白,BCA试剂盒定量。取50 μg样本与上样缓冲液按比例混合,沸水浴5 min使蛋白变性,离心取上清,恒压电泳后湿转至膜上,封闭液封闭2 h,加入兔抗大鼠Bcl-2、Bax一抗(1∶400),4 ℃摇床孵育过夜,等渗缓冲盐溶液(TBST)洗膜,加入山羊抗兔IgG二抗(1∶1 000),室温孵育120 min,TBST洗膜,电化学发光法(ECL)显色剂显色、曝光,以Bcl-2、Bax/内参甘油醛-3-磷酸脱氢酶(GAPDH)灰度值表示蛋白相对表达量,凝胶成像系统分析结果。重复3次取均值。
1.3 统计学方法 采用软件SPSS 19.0进行数据的统计及分析,以表示计量资料,组内比较采用配对t检验,组间多样本资料的检验方式为单因素方差分析,再以LSD-t行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 神经功能评价 与脑梗死组比较,建模后1、3 d脑梗死过表达组Zea-longa神经功能评分降低,脑梗死低表达组升高(P<0.05);脑梗死组、脑梗死NC组Zea-longa神经功能评分比较,差异无统计学意义(P>0.05);脑梗死组、脑梗死过表达组、脑梗死低表达组、脑梗死NC组建模后3 d Zea-longa神经功能评分均低于建模后1 d(P<0.05)。见表1。
表1 各组脑梗死大鼠神经功能评分比较/(分,)

表1 各组脑梗死大鼠神经功能评分比较/(分,)
注:①与脑梗死组比较,P<0.05。②与脑梗死过表达组比较,P<0.05。③与脑梗死低表达组比较,P<0.05。④与同组建模后1 d比较,P<0.05。
建模后3 d 1.72±0.19④0.82±0.09①④2.36±0.21①②④1.65±0.17①②③④108.97<0.001组别脑梗死组脑梗死过表达组脑梗死低表达组脑梗死NC组F值P值鼠数8 8 8 8建模后1 d 2.06±0.25 0.98±0.11①2.71±0.24①②1.94±0.21①②③92.43<0.001
2.2 脑组织miR-24表达 健康组、脑梗死组、脑梗死过表达组、脑梗死低表达组、脑梗死NC组脑组织miR-24 mRNA相对表达量分别为0.56±0.12、0.21±0.03、1.38±0.26、0.06±0.01、0.22±0.04(F=133.94,P<0.001);与健康组比较,脑梗死组脑组织miR-24 mRNA表达降低(LSD-t=8.00,P<0.001);与脑梗死组比较,脑梗死过表达组脑组织miR-24 mRNA表达升高(LSD-t=12.64,P<0.001),脑梗死低表达组miR-24 mRNA表达降低(LSD-t=13.42,P<0.001);脑梗死组、脑梗死NC组miR-24 mRNA表达比较,差异无统计学意义(LSD-t=0.57,P=0.581)。
2.3 脑梗死体积 脑梗死组、脑梗死过表达组、脑梗死低表达组、脑梗死NC组脑梗死体积分别为(40.31±5.30)mm3、(21.25±4.93)mm3、(50.56±6.14)mm3、(41.04±4.62)mm3(F=43.32,P<0.001);与脑梗死组比较,脑梗死过表达组脑梗死体积缩小(LSD-t=5.89,P<0.001),脑梗死低表达组脑梗死体积增大(LSD-t=2.83,P=0.022);脑梗死组、脑梗死NC组脑梗死统计比较,差异无统计学意义(LSD-t=0.23,P=0.822)。
2.4 脑梗死皮质区存活神经元密度 健康组、脑梗死组、脑梗死过表达组、脑梗死低表达组、脑梗死NC组脑梗死皮质区NeuN阳性表达神经元数目分别为(501.00±63.71)个/视野、(292.20±35.60)个/视野、(385.20±45.13)个/视野、(154.40±17.91)个/视野、(285.80±32.59)个/视野(F=75.82,P<0.001);与健康组比较,脑梗死组减少(LSD-t=5.61,P=0.001);与脑梗死组比较,脑梗死过表达组增加(LSD-t=3.62,P=0.007),脑梗死低表达组减少(LSD-t=7.73,P<0.001);脑梗死组、脑梗死NC组比较,差异无统计学意义(LSD-t=0.30,P=0.774)。
2.5 脑组织Bcl-2、Bax蛋白表达 与健康组比较,脑梗死组脑组织Bcl-2蛋白表达降低,Bax蛋白表达升高(P<0.05);与脑梗死组比较,脑梗死过表达组脑组织Bcl-2蛋白表达升高,Bax蛋白表达降低,脑梗死低表达组Bcl-2蛋白表达降低,Bax蛋白表达升高(P<0.05);脑梗死组、脑梗死NC组脑组织Bcl-2、Bax蛋白表达比较,差异无统计学意义(P>0.05)。见图1,表2。
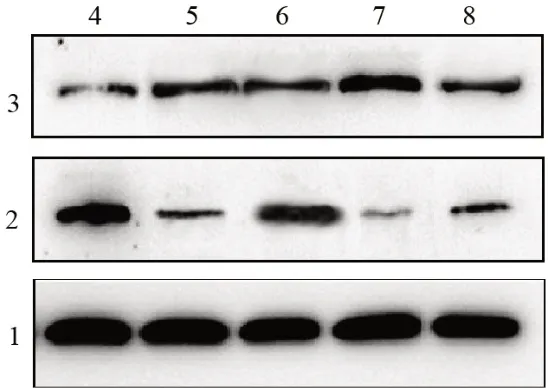
图1 蛋白质印迹法检测各组大鼠脑组织Bcl-2、Bax蛋白表达
表2 各组大鼠脑组织Bcl-2、Bax蛋白表达比较/
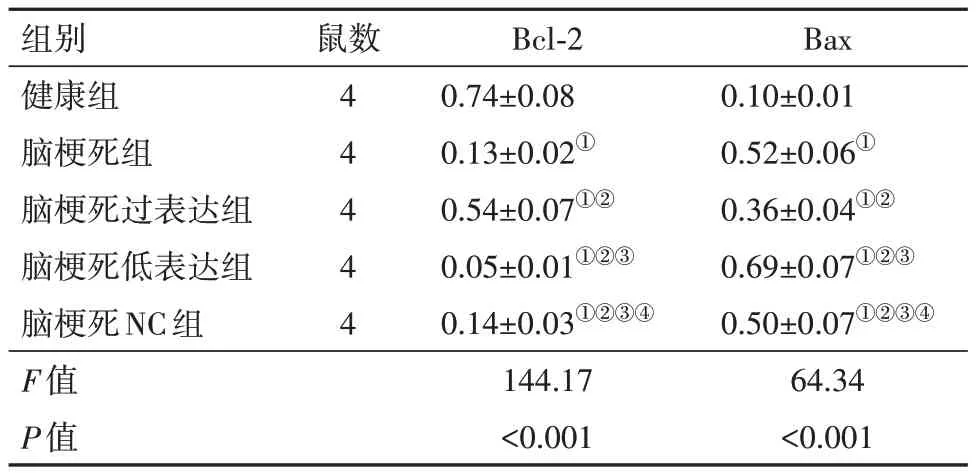
表2 各组大鼠脑组织Bcl-2、Bax蛋白表达比较/
注:Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X蛋白。①与健康组比较,P<0.05。②与脑梗死组比较,P<0.05。③与脑梗死过表达组比较,P<0.05。④与脑梗死低表达组比较,P<0.05。
Bax 0.10±0.01 0.52±0.06①0.36±0.04①②0.69±0.07①②③0.50±0.07①②③④64.34<0.001组别健康组脑梗死组脑梗死过表达组脑梗死低表达组脑梗死NC组F值P值鼠数4 4 4 4 4 Bcl-2 0.74±0.08 0.13±0.02①0.54±0.07①②0.05±0.01①②③0.14±0.03①②③④144.17<0.001
3 讨论
ICI是由脑供血障碍引起的一种以严重意识障碍、感觉和运动功能障碍为主要特征的神经退行性疾病。研究表明,年龄、高血压、高脂血症、长期失眠、不良生活习惯、遗传等均是ICI发生的危险因素[7-8]。越来越多的报道指出,miRNAs与神经系统发育及神经功能关系密切,在大脑特异性表达功能的调节中发挥重要作用,为ICI的基因治疗提供了新的可能[9-11]。本课题组选择与血脂代谢、高血压、血管内皮细胞、血管炎症反应均有明显关联的miR-24作为本研究的重点。
ICI发生后,在正常脑组织与缺血中心不可逆坏死区域之间,存在处于低灌注状态、可观察到典型细胞凋亡特征的缺血半暗带。细胞过度凋亡是DNA损伤后细胞程序化死亡的晚期病理现象,随着缺血半暗带的缩小,神经细胞迟发性死亡及其所致的不可逆性损伤病灶持续扩大,推测主要是通过细胞凋亡来实现的,且可能对最终脑梗死体积具有决定性作用。本研究结果显示,miR-24过表达可降低Zea-longa神经功能评分,缩小脑梗死体积,增加梗死皮质区NeuN阳性表达神经元数目,miR-24低表达则作用相反,提示miR-24对ICI大鼠具有脑保护及抗神经元凋亡作用。miR-24广泛表达于全身血管组织及心、肺、脑、肝等器官中,参与调控细胞增殖及凋亡,炎症性疾病及肿瘤发生等过程。Sun等[12]研究显示,缺氧将抑制SHR-SY5Y细胞中miR-24表达,采用miR-24模拟物干预后在缺氧条件下可抑制细胞凋亡,诱导细胞周期及细胞增殖。此外,Jiang等[13]研究发现,miR-24可降低脑梗死大鼠血清血脂水平及脑梗死面积百分比,抑制脑组织细胞凋亡。结合本研究推测,miR-24在神经元细胞凋亡中起关键作用,且是缺血性脑病的潜在治疗靶标。
既往报道显示,脑梗死后神经元凋亡的主要途径是线粒体损伤介导的细胞凋亡信号传导[14-15]。Bcl-2、Bax分别是Bcl-2基因家族最重要的凋亡抑制、凋亡诱导基因。Bcl-2与Bax可形成异源二聚体,减少或阻断释放线粒体细胞色素C,从而抑制下游的凋亡级联反应。当Bcl-2高表达时,Bax二聚体解离为稳定性更强的Bcl-2/Bax复合物,从而延长细胞生存周期。当Bax高表达时,Bax二聚体数量明显增加,刺激细胞凋亡。Liu等[16]研究发现,急性脑梗死外周血中Bax高于健康受试者,而Bcl-2低于健康受试者,经溶栓治疗后Bax降低,而Bcl-2升高,且与梗死面积密切相关,提示两者参与该病发生、发展。本研究结果显示,miR-24过表达可提高脑组织Bcl-2蛋白表达量,减少Bax蛋白表达,miR-24低表达则相反,提示miR-24过表达对ICI的治疗作用可能与调节脑组织Bcl-2、Bax蛋白表达有关。
综上所述,miR-24过表达可改善ICI大鼠神经功能,缩小脑梗死体积,减少神经元凋亡,可能通过调节脑组织Bcl-2、Bax蛋白表达来实现。然而,miR-24生理功能是否受细胞中其他信号转导分子的调控,以及其对ICI的治疗作用是否受剂量影响等,仍有待进一步研究。

