基于网络药理学探究防风中生物活性成分及对类风湿关节炎的作用机制
蒋 勇,钟淑欣,何升华,梁家彬,张浩宇,叶裕丰,陈汉威
基于网络药理学探究防风中生物活性成分及对类风湿关节炎的作用机制
蒋 勇1, 2,钟淑欣3,何升华4,梁家彬1, 2,张浩宇1, 2,叶裕丰2*,陈汉威2, 5*
1. 广州中医药大学番禺区中心医院,广东 广州 510006 2. 广州市番禺区中心医院 中心实验室,广东 广州 511486 3. 暨南大学基础医学院,广东 广州 510632 4. 广州中医药大学第四临床医学院,广东 深圳 518033 5. 广州市番禺区健康管理中心,广东 广州 511495
通过以网络药理学为基础的策略研究防风治疗类风湿关节炎(rheumatoid arthritis,RA)的分子生物学机制。采用网络药理学方法收集防风活性成分和治疗RA的潜在靶点,并评估活性成分的药理和毒理学等相关参数;构建蛋白质相互作用网络筛选核心靶点,并通过生物信息学方法进一步验证核心靶点和疾病的关联;对核心成分和相应靶点进行分子对接。体外通过CCK-8实验、细胞迁移和侵袭、细胞凋亡、qRT-PCR和Western blotting分析,阐明别欧前胡素对MH7A细胞磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路的调控作用。从防风中共鉴定出18种活性成分和66个与筛选出的RA疾病靶基因相交的潜在靶基因,最终获得了汉黄芩素、β-谷甾醇、5--甲基维斯阿米醇和别欧前胡素等核心成分。防风治疗RA的潜在机制可能是通过调控PI3K/Akt、白细胞介素-17(interleukin-17,IL-17)、凋亡等信号通路和多种生物过程来实现,以发挥抗炎和免疫调节作用。分子对接证实了所有的核心成分和关键靶点均具有很好的对接活性。别欧前胡素抑制MH7A细胞的活力、迁移和侵袭(<0.05、0.01),诱导细胞凋亡(<0.01),并显著下调、、、基质金属蛋白酶-1(matrix metalloproteinase-1,)和的基因表达(<0.01)。分子分析表明别欧前胡素通过抑制PI3K/Akt通路发挥对MH7A的调控作用。成功预测了防风治疗RA的有效成分和潜在靶点,为进一步探究其分子机制提供了新的理论基础。揭示了别欧前胡素通过PI3K/Akt通路抑制RA成纤维样滑膜细胞的活力、迁移、侵袭及细胞因子和MMPs的表达,并诱导细胞凋亡。
防风;类风湿关节炎;网络药理学;发病机制;别欧前胡素;汉黄芩素;5--甲基维斯阿米醇;成纤维样滑膜细胞;PI3K/Akt信号通路
类风湿关节炎(rheumatoid arthritis,RA)是一种病因不明的慢性全身性自身免疫疾病,主要损害关节,以对称性滑膜炎症为特征。目前,RA的全球发病率为0.5%~1.0%,以女性为多见,其晚期形式的特点为严重且使人衰弱的慢性疼痛,管理不善会进一步导致疾病进展,最终导致关节侵蚀、破坏和畸形[1]。迄今尚无有效的针对RA的治疗方法,目前的西医治疗主要用于减少关节炎症、防止不可逆的骨破坏和尽可能维持关节功能,但构成高昂的财务成本并表现出严重的不良反应[2]。滑膜炎是RA的病理基础,而成纤维样滑膜细胞(fibroblast-like synoviocytes,FLSs)是RA中具有免疫作用的核心靶细胞。在RA滑膜炎性环境中,FLSs发生凋亡异常,导致RA滑膜增生,聚积并黏附在骨和软骨上加重关节破坏[3]。同样,RA-FLSs“类肿瘤样”异常增殖,会导致细胞过度活化,迁移、侵袭能力加强,产生大量的蛋白酶、细胞因子和黏附分子促使软骨破坏,进一步激活破骨细胞造成骨破坏,并且激活的FLSs还可以通过与邻近血管内皮细胞发生串扰来调节炎症浸润的侵入,在关节骨和软骨的破坏中也发挥重要作用[4-8]。
防风(Turcz.) Schisch广泛分布于东西伯利亚和北亚[9]。首载于秦汉时期的《神农本草经》,被列为上品,一般规定用防风祛风解表、祛湿止痛、定惊,与现代应用大致相符,对普通感冒、头痛、风疹、瘙痒、破伤风、风湿病和关节痛有明显的治疗作用[10-11]。防风在当前临床实践中被广泛用于治疗炎症、疼痛和关节炎等[12]。防风含有100多种化学成分,主要有色原酮类、香豆素类、多糖类、聚乙炔等,这些活性成分有解热、抗炎镇痛、抗增殖、抗肿瘤以及免疫调节等多种药理作用[13-15]。基于系统生物学与药理学的网络药理学,是评价药物的代谢和有效性特征,分析药物治疗疾病的具体途径,揭示药物作用的分子机制的强有力方法[16-17]。分子对接技术可以评估分析药物与疾病关键靶点结合的活性和机制,对进一步药物筛选和研发提供一些见解[18]。因此,本研究采用网络药理学、微阵列数据分析和分子对接技术系统地鉴定防风活性成分的有效靶蛋白,探索防风治疗RA的分子机制,筛选出防风治疗RA的活性成分和重要信号通路,为后续研究提供参考。
1 材料
1.1 细胞
人RA成纤维样滑膜细胞系MH7A购自吉妮欧生物科技有限公司。
1.2 药品与试剂
别欧前胡素(批号D21091501,质量分数≥98%)购自南京狄尔格医药科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,批号031825)购自美国Peprotech公司;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂LY294002(批号134167)购自美国MCE公司;甲氨蝶呤(methotrexate,MTX,批号02211101)购自山西普德药业有限公司;Matrigel胶(批号2082001)购自美国Corning公司;胎牛血清(批号SA220629)、胰蛋白酶溶液(批号WH0622G111)购自武汉普诺赛生命科技有限公司;DMEM培养基(批号8123020)、青霉素-链霉素(批号2321131)购自美国Gibco公司;CCK-8试剂盒(批号VB816)购自日本DOJINDO公司;总RNA提取试剂盒(批号343904)购自美国Invitrogen公司;逆转录试剂盒(批号H0104731)购自上海翊圣生物科技有限公司;SYBR Green qPCR试剂盒(批号027E2232EB)购自南京诺唯赞生物科技股份有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒(批号20220610)、全蛋白提取试剂盒(批号20221009)、BCA测定试剂盒(批号20220427)购自江苏凯基生物技术股份有限公司;ECL化学发光检测溶液(批号2127701)购自美国Millipore公司;特大B细胞淋巴瘤(B-cell lymphoma-extra-large,Bcl-xL)抗体(批号F1741)购自英国EterLife公司;B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)抗体(批号GR151406-19)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)抗体(批号GR46472-1)购自英国Abcam公司;PI3K抗体(批号CJ36131)、p-PI3K抗体(批号AA10171)、蛋白激酶B(protein kinase B,Akt)抗体(批号CN13211)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)p-Akt抗体(批号AA44161)、抗体(批号1201908)、HRP标记山羊抗兔二抗(批号AA102109)购自美国Bioworld公司。
1.3 仪器
5804R型冷冻高速离心机(德国Eppendorf公司);371型CO2培养箱、1300 series A2型生物安全柜、Variskan LUX microplate reader多功能酶标仪(美国Thermo Fisher Scientific公司);DMI1型倒置光学显微镜(德国Leica公司);LightCycler480 II Real-time PCR系统(瑞士Roche公司);CytoFLEX Flow Cytometer流式细胞仪(美国Beckman Coulter公司);PowerPac HC型垂直电泳/转膜套装、Bio-Rad Gel-Doc XR+凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 网络药理学分析
2.1.1 防风中的有效成分和靶点 在TCMSP(http://tcmspw.com/tcmsp.php)、YaTCM(http://cadd. pharmacy.nankai.edu.cn/yatcm)、BATMAN-TCM(http://bionet.ncpsb.org.cn/batman-tcm)和TCMIP(http://www.tcmip.cn/TCMIP)4个中药药理学数据库检索和收集防风的化学成分。以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18作为主要的药动学参数(符合这一标准的化合物具有更高的类药物特性)对防风的成分进行筛选[19],同时通过文献检索进行补充,获得最终候选目标活性成分。然后,搜集TCMSP中预测的与这些活性分子相对应的靶点。所有活性成分的化学结构均来自PubChem数据库(https:// pubchem.ncbi.nlm.nih.gov)。
2.1.2 药理和毒理参数评估 通过参考里宾斯基“五规则”(rule of 5,RO5),评估活性成分的“类药物”特性,符合该规则的化合物有更好的药动学性质和更高的生物利用度,因而也更有可能成为口服药物。化合物毒性的预测是药物设计开发过程的关键部分之一。ProTox-II网络服务器(https://tox-new.charite.de/protox_II)用于预测获得的活性成分的毒理学参数,包括毒理学终点(免疫毒性、致突变性和致癌性)、器官毒性(肝毒性)和急性口服毒性(median lethal dose,LD50)。活性成分的合成可及性得分(synthetic accessibility score,SAscore)通过ADMETlab 2.0(https://admetmesh.scbdd.com)计算,SAscore旨在计算类药物分子的合成难度,SAscore<6表示容易合成,否则难以合成。
2.1.3 防风-RA潜在靶基因 为确保数据的全面性与准确性,从GeneCard(https://www.genecards.org)、OMIM(https://omim.org/search/advanced/geneMap)、DisGeNET(https://www.disgenet.org/search)、DRUGBANK(https://go.drugbank.com)4个数据库中收集RA相关的靶点。其中DRUGBANK数据库基于临床试验药物证据构建而成,包含丰富的药物数据与全面的药物靶标信息,GeneCard、OMIM、DisGeNET 3个数据库基于现有文献构建,各个数据库之间优势互补。将上述4个数据库获取的靶基因,删除重复项后合并。使用UniProt数据库(https:// www.uniprot.org)将药物成分和疾病的目标统一规范为标准“Gene Symbol”,通过VENNY 2.1网站(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获取防风治疗RA的潜在靶基因(即共存靶基因)。
通过收集基因表达综合数据库(gene expression omnibus,GEO)数据集(GSE93272和GSE97779)的对照组和RA组中差异表达基因(differentially expressed genes,DEGs),分析与RA发病机制相关的防风靶标的标准化表达水平。此外,通过Panther分类系统(http://pantherdb.org)进行潜在靶基因的功能分类。
2.1.4 防风-RA潜在靶基因的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络分析 通过将获取的防风-RA潜在靶基因输入STRING数据库(https://cn.string-db.org)并选择生物体为“Homo sapiens”,设置靶基因交互得分的置信度为0.40,以获得PPI网络来呈现潜在靶基因之间互作的直接与间接调控关系。PPI网络中每个节点代表1个蛋白质,边代表蛋白质-蛋白质关联,即潜在靶基因相互之间共同功能的关联。将这些结果导入Cytoscape 3.7.1对目标蛋白进行包含拓扑参数的可视化PPI网络构建和分析。
2.1.5 基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 将防风-RA共同靶基因导入R(https://www.r-project.org)软件,利用“Cluster Profiler”包进行生物信息富集分析,包括GO功能和KEGG信号通路分析。<0.05为显著富集,结果用R软件绘制气泡图和条形图来直观地显示。R包“pathview”和“GOplot”分别用于将KEGG数据映射到RA相关的信号通路图上并显示出来和绘制Chord plot将靶基因映射到GO或KEGG条目来反应归属关系。
2.1.6 靶点-器官定位网络构建 防风体内代谢过程尚未明确,防风诱导的RA治疗作用可能涉及多个器官和组织。通过使用BioGPS数据库(http:// biogps.org)获得每个防风-RA靶点在器官组织水平的mRNA表达谱。分别计算每个mRNA在每个组织或器官中的平均值和在所有组织器官中的总体平均值,提取mRNA表达值高于总体值的相关组织器官。使用Cytoscape 3.7.1构建靶点-器官定位网络。
2.1.7 “成分-潜在靶基因-信号通路(ingredients-potential target genes-signaling pathways,IPS)”网络构建 利用Cytoscape 3.7.1构建IPS网络,节点代表活性化合物、靶基因或信号通路,线条则代表活性化合物、靶基因和信号通路三者之间的相互作用。利用Cytoscape 3.7.1中内置的“Network Analyzer”功能分析活性成分和靶基因的网络拓扑参数,包括连接度、介度、紧密度等,并据此鉴定核心靶基因和化合物。
2.1.8 核心成分和核心靶点的分子对接验证 对IPS核心网络(Hithubs Network)中得到的核心成分和靶基因按照化合物-靶点网络中的组合关系进行分子对接验证。首先从PubChem数据库下载活性成分的SDF格式文件并利用Chem 3D软件进行能量最小化计算后转换为MOL2格式文件。通过RCSB PDB数据库(https://www.rcsb.org)下载分辨率低于0.2 nm(优先选择分辨率值更小且有小分子复合的结构)的靶蛋白的PDB结构文件,并使用AutoDock Tools1.5.7软件进行去杂原子、氢化、计算电荷等加工。运行AutoDock Vina 1.2.3进行分子对接,以对接评分Affinity<−20.929 3 kJ/mol表明具有较强的结合活性[20]。最后,通过CB-Dock网站(http://clab. labshare.cn/cb-dock)将结果进行可视化。
2.2 细胞实验
2.2.1 细胞培养和处理 MH7A细胞用含10%胎牛血清和1%青霉素-链霉素的DMEM培养基,在37 ℃、5% CO2的培养箱中培养,每48~72小时传代1次(细胞融合度达到80%~90%时用胰蛋白酶溶液消化细胞)。MH7A细胞以1×105/mL接种于相应培养皿中,给予TNF-α(10 ng/mL),别欧前胡素(20、40、60 μmol/L),MTX(20 μmol/L)或LY294002(20 μmol/L)干预24 h或48 h。
2.2.2 细胞活力测定 MH7A细胞分别给予别欧前胡素(20、40、60、80、120、160 μmol/L)处理24、48 h,然后用CCK-8试剂孵育3 h,酶标仪在450 nm处检测吸光度()值,计算细胞活力。
2.2.3 划痕愈合测定 细胞融合度达到80%时更换基础培养基培养12 h,用药物预处理24 h,再使用移液管尖端制造伤口,记作0 h,完全培养基继续培养48 h。分别在0、24、48 h进行拍照,计算迁移细胞数。
2.2.4 迁移和侵袭测定 细胞用药物预处理12 h后转移至Transwell小室,24 h(迁移)或48 h后(侵袭,Matrigel胶包被)对小室进行固定、染色、拍照并计数。
2.2.5 qRT-PCR检测、、、基质金属蛋白酶-1(matrix metalloproteinase-1,)和基因表达 按照试剂盒说明书提取细胞中总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。
表1 引物序列
Table 1 Primer sequences
基因引物序列 (5’-3’) IL-1βF: CAGGCTGCTCTGGGATTCTC R: GTCCTGGAAGGAGCACTTCAT IL-6F: CCTGAACCTTCCAAAGATGGC R: TTCACCAGGCAAGTCTCCTCA IL-8F: GAAGTTTTTGAAGAGGGCTGAGA R: GCCCTTGGCCTCAATTTTGC MMP-1F: ATGAAGCAGCCCAGATGTGGAG R: TGGTCCACATCTGCTCTTGGCA MMP-3F: TGGACAAAGGATACAACAGGGAC R: ATCTTGAGACAGGCGGAACC GAPDHF: TCGGAGTCAACGGATTTGGT R: TTCCCGTTCTCAGCCTTGAC
2.2.6 细胞凋亡测定 收集药物干预48 h后的细胞,PBS洗涤3次,在细胞缓冲液中依次加入Annexin V-FITC和碘化丙啶(PI)孵育5~10 min,通过流式细胞仪检测细胞凋亡情况。
2.2.7 Western blotting检测PI3K/Akt通路和凋亡相关蛋白表达 使用全蛋白提取试剂盒提取细胞总蛋白,并用BCA测定试剂盒测定蛋白质浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,在室温下用5%脱脂牛奶封闭1 h后,分别加入p-Akt(1∶750)、Akt(1∶750)、p-PI3K(1∶750)、PI3K(1∶750)、Bax(1∶5000)、cleaved Caspase-3(1∶500)、Bcl-xL(1∶1000)和GAPDH(1∶5000)抗体,4 ℃孵育过夜。然后,将膜与二抗在室温下孵育1 h。滴加ECL化学发光检测溶液后,使用Bio-Rad Gel-Doc XR+可视化蛋白条带。使用Image Lab软件对条带进行量化。
2.3 统计学分析
3 结果
3.1 网络药理学分析
3.1.1 防风活性成分的药理学性质和靶基因 以OB≥30%、DL≥0.18标准对防风检索出的成分进行筛选并结合文献检索,最终获得19种活性成分。其中升麻素苷(Hacc>10),其余18种活性成分符合“RO5”(MW<500、Hdon<5、Hacc<10、−2<log<5、RBN<10)。这些活性成分的相关药理参数见表2。通过检索HERB数据库(http://herb.ac.cn/)分析它们在中药中分布情况。结果表明,它们在防风中具有高度特异性。11-羟基-亥茅酚苷_qt、divaricatacid和珊瑚菜内酯仅存在于防风中,防风色酮醇和divaricatol存在于包括防风在内的2种中药中,川白芷内酯和别欧前胡素则是3种。防风的所有活性成分均未表现出肝毒性,亚油酸乙酯和11,14-二十碳二烯酸甲酯的LD50值最高(图1)。SAscore评估表明所有成分都是容易合成的。上述结果表明,筛选出的这些防风活性成分具有很高的“类药物”药理学性质。在TCMSP收集到防风18种活性成分的218个靶蛋白,经去重和验证后得到80个靶蛋白。
表2 防风生物活性成分的药理学和分子性质
Table2 Pharmacological and molecular properties of bioactive components in S. divaricata
活性成分MWAlogPHdonHaccOB/%DLCaco-2BBBTPSARBNSAscore 黄花菜木脂素A386.382.492868.830.660.21−0.53107.5943.448 11-羟基-亥茅酚苷_qt292.310.883650.240.27−0.27−1.23100.1313.502 川白芷内酯426.465.050759.650.660.56−0.0292.0463.932 divaricatacid320.321.342787.000.32−0.18−1.05106.2033.436 divaricatol334.351.252731.650.38−0.13−1.09106.2033.505 欧前胡素270.303.650434.550.221.130.9252.5832.782 防风色酮醇374.422.802732.050.510.07−0.81106.2043.718 珊瑚菜内酯300.333.640543.390.280.900.4361.8142.815 5-O-甲基维斯阿米醇290.342.021537.990.250.54−0.1068.9023.466 珊瑚菜素300.333.640540.190.280.980.4861.8142.815 3-表-β-谷甾醇414.798.081136.910.751.320.8720.2364.388 汉黄芩素284.282.592530.680.230.790.0479.9022.288 β-谷甾醇414.798.081136.910.751.320.9920.2364.388 亚油酸乙酯308.566.990242.000.191.461.1426.30162.305 异欧前胡素270.303.650445.460.230.970.6652.5832.674 别欧前胡素270.303.791436.310.220.910.5063.5822.982 11,14-二十碳二烯酸甲酯322.597.550239.670.231.471.1026.30172.322 紫花前胡素328.393.960539.270.380.770.2565.7433.359
MW-相对分子质量 Alog-辛醇/水分配系数的对数 Hdon-氢键供体 Hacc-氢键受体 Caco-2-肠上皮通透性 BBB-血脑屏障 TPSA-拓扑极性表面积 RBN-化合物中可旋转键的个数
MW-molecular weight Alog-log of octanol/water partition coefficient Hdon-hydrogen bond donors Hacc-hydrogen bond acceptors Caco-2-intestinal epithelial permeability BBB-blood-brain barrier TPSA-topological polar surface area RBN-rotation bonds number

图1 防风生物活性成分的毒理学参数
3.1.2 防风治疗RA的潜在靶基因及PPI网络分析 选取GeneCard、DisGeNET数据库中评分大于中位数的靶点,合并DRUGBANK、OMIM数据库中获得的靶点,去重得到5769个RA相关靶基因。利用VENNY 2.1工具将防风活性成分靶基因和RA靶基因取交集,得到66个潜在靶基因(图2-A)。将该66个共同靶点输入STRING数据库,构建PPI网络来呈现靶点间相互作用的调控关系(图2-B)。将这些结果导入Cytoscape 3.7.1构建了66个节点、547条边的可视化PPI网络(图2-C),平均节点连接度为16.6。排名前12的关键靶点见图2-D,18种活性成分靶向RA发病机制相关靶点的数量见图2-E。
3.1.3 与RA发病机制相关的防风靶点的功能分类 FLSs功能障碍(如异常增殖、凋亡)导致滑膜增生,与免疫系统细胞相互作用从而产生一系列炎症级联反应,而持续的滑膜炎症是RA进展的主要原因[2]。通过Panther分类系统,对66个防风-RA靶点进行蛋白质功能分类。与RA发病机制相关的66个防风靶点根据其细胞功能分为10个不同的类别,其中蛋白质修饰酶、跨膜信号受体和基因特异性转录调节因子是最丰富的类别(图3-A)。涉及蛋白质修饰酶的15个潜在防风靶点形成了1个具有13个节点和35个边的PPI网络(图3-B),其中AKT1和CASP3是关键靶点。由酶活性介导的蛋白质翻译后修饰在调节细胞活性和功能方面起着至关重要的作用,包括信号转导、细胞间相互作用、细胞增殖和凋亡等[21]。在蛋白质修饰酶中(图3-C),丝氨酸/苏氨酸蛋白激酶与磷酸酶共同参与调节细胞增殖、凋亡过程关键元件的磷酸化状态。CASP3、CASP8、CASP9则属于Caspase家族蛋白酶,其在细胞程序性死亡中起关键作用。根据相关靶点的数量提出了可能的RA发病机制相关的蛋白质修饰酶调节因子(图3-D)。这些发现表明防风活性成分对RA的治疗靶点与多个关键生物学功能密切相关。

A-Venn图 B、C-PPI网络 D-排名前12的关键靶点 E-防风中18种活性成分靶向RA发病机制相关靶点的数量
3.1.4 防风生物活性成分治疗RA的潜在协同机制 GO分析结果显示66个靶基因在1081个GO生物过程(biological process,BP)条目中显著富集,基于调整后值排序的前20个富集项绘制的条形-气泡图如图4-A所示。主要丰富的BP条目是对激素的反应、细胞死亡的正向调节等。前8个BP条目的数据导入R包“GOplot”绘制“GOChord plot”来直观地映射“条目”与“基因”的归属关系(图4-B)。RA在女性中患病率较高,大量的研究表明激素与RA的发病和临床表现密切相关[22]。27个RA相关的防风目标密切参与对激素的反应并形成1个包含25个节点和173个边的PPI网络(图4-C)。其中有9个是关键靶点,在这个PPI网络中发挥着关键作用(即图4-C内一圈)。FLSs凋亡异常导致的持续滑膜炎症在RA的发病机制中具有重要的意义。19个防风目标参与细胞死亡的正向调节,并形成1个具有18个节点和112个边的PPI网络(图4-D)。表明防风的有效成分通过多种BP起到治疗RA的协同作用。
同样,KEGG富集分析结果显示66个靶基因在215个信号通路中显著富集。基于调整后值排序的前20个KEGG富集项如图4-E所示。KEGG通路主要涉及对PI3K/Akt、IL-17和凋亡等信号通路。对按照“基因计数”排序的前10个KEGG条目绘制KEGG“Chord plot”来映射项目与基因归属关系(图4-F)。PI3K/Akt和IL-17信号通路是最显著富集的通路,19个SD靶点参与PI3K/Akt信号通路,形成1个包含19个节点和94条边的PPI网络(图4-G)。这些结果表明,防风活性成分对RA的多种协同作用涉及多个靶点和多种途径。此外,防风治疗RA潜在靶基因的PI3K/Akt和IL-17信号通路分别如图5所示(红色矩形代表潜在的靶基因)。

A-BP分析的前20个富集项的条形-气泡图,按调整后的值排序 B-BP分析中主要8项富集弦图 C、D-参与激素响应(GO:0009725)和细胞死亡的正向调节(GO:0010942)防风靶点的PPI网络 E-KEGG分析的前20个富集途径的条形-气泡图,按调整后的值排序 F-KEGG分析前10项富集途径的弦图,按潜在靶基因的基因数排序 G-参与PI3K/Akt信号通路的防风靶标的PPI网络(hsa04151)
A-bar-bubble plot of top 20 enriched terms of BP analysis, sorted by adjustedvalue B-GO chord plot of primary enriched 8 terms of BP analysis C, D-PPI network of targets ofinvolved in response to hormone (GO: 0009725) and positive regulation of cell death (GO: 0010942) E-bar-bubble plot of top 20 enriched pathways of KEGG analysis, sorted by adjustedvalue F-KEGG chord plot of top 10 enriched pathways of KEGG analysis sorted by gene count for potential target genes G-PPI network of targets ofinvolved in PI3K/Akt signaling pathway (hsa04151)
图4 防风治疗RA靶点的GOBP和KEGG途径富集分析
Fig. 4 GO BP and KEGG pathway enrichment analysis of targets ofagainst RA
3.1.5 IPS网络的构建与分析 根据获得的KEGG通路富集分析结果,运用Cytoscape构建IPS网络,系统地解释防风对RA的作用机制,并通过内置工具分析防风靶点。如图6-A所示,该网络由104个节点和366条边构成,橙色节点代表防风活性成分(六边形),绿色节点代表KEGG分析得到的前20条信号通路(正方形),红色节点代表防风和RA(椭圆)的共同靶基因。在Cytoscape中将拓扑参数高于IPS网络平均连接度、介度和紧密度的节点提取出来,得到Hithubs Network(核心网络,图6-B),这些节点是防风治疗RA的核心靶点、核心成分和重要的信号通路。涉及的主要信号通路是PI3K/Akt和IL-17,核心靶点是前列腺素内过氧化物酶2(prostaglandin-endoperoxide synthase2,PTGS2)、转录因子p65(transcription factor p65,RELA)和AKT1等,核心成分则包括汉黄芩素、β-谷甾醇、5--甲基维斯阿米醇和别欧前胡素等。

3.1.6 靶点-器官定位网络分析 评估66个防风-RA靶点的mRNA水平,所有靶蛋白的mRNA水平在BioGPS中均可用。其中有64个靶蛋白在21个与RA相关免疫器官中mRNA表达水平升高,包括滑膜(29个靶点)、脾脏(26个靶点)、淋巴结(25个靶点)、肾上腺皮质(28个靶点)、骨髓(28个靶点)、肾皮质(19个靶点)、肾髓质(19个靶点)、淋巴细胞(30个靶点)、浆细胞(25个靶点)等。构建的靶点-器官定位网络,包含85个节点和549条边(图7)。大多数靶标在多个器官和组织中高表达,表明这些器官与防风的靶标密切相关。此外,21个器官与免疫密切相关,表明防风对RA的治疗作用可能涉及全身免疫的激活。

图6 IPS网络(A) 与核心网络(B) 构建与分析
3.1.7 与RA发病机制相关的防风靶点的GEO数据集分析 通过GEO数据库获取感兴趣的GEO数据集,分析了GSE93272数据集健康对照组和RA组中与RA发病机制相关的SD靶点的归一化表达值。该数据集收集了大样本RA患者和健康对照的全血基因表达水平数据,可用于分析鉴定不同人群基因的差异表达。结果表明,66个防风靶点中的38个存在差异表达,其中有10个在RA组中显著上调,其余28个显著下调。其中肿瘤蛋白p53(tumor protein p53,TP53)、CASP3、转录因子AP-1(transcription factor AP-1,JUN)、雌激素受体1(estrogen receptor 1,ESR1)、PTGS2和G1/S期特异细胞周期蛋白D1(G1/S-specific cyclin D1,CCND1)是关键靶点(图8-A);维生素A与丝裂原活化蛋白激酶14(mitogen-activated protein kinase 14,MAPK14)、RELA、周期蛋白依赖性激酶(cyclin-dependent kinase 2,CDK2)、热休克蛋白αB1(heat shock protein 90 kDa alpha family class B member 1,HSP90AB1)、B淋巴细胞瘤-2(B-cell lymphoma-2,BCL2)和二肽基肽酶4(dipeptidyl peptidase 4,DPP4)属于IPS中的核心靶点(图8-B)。以上结果表明,这些防风靶标与RA的发病机制密切相关。

箭头节点代表器官,菱形节点代表靶点;节点明暗和大小与其连接度相关
3.1.8 巨噬细胞病理学相关的防风靶点的生物信息学分析 滑膜炎是RA的病理基础,滑膜巨噬细胞和FLSs是RA的核心靶细胞,会导致骨骼和关节软骨的破坏[4]。巨噬细胞与炎症微环境相互作用以参与RA炎症的发展。当被激活时,巨噬细胞会产生细胞因子、趋化因子、代谢物和其他参与RA过程的因子[23]。同样地,通过分析GSE97779数据集中滑膜巨噬细胞在健康对照组和RA组的DEGs,发现66个防风靶点中的26个是差异表达的,包括RA中上调的18个基因和8个下调的基因(图9-A)。这26个DEGs的表达式模式的热图见图9-B。25个防风靶点参与巨噬细胞病理学,形成1个包含25个节点和105条边的PPI网络,其中TNF、IL6、CASP3、CCND1、MAPK14、纤连蛋白1(fibronectin 1,FN1)、PTGS2和RELA是发挥重要作用的关键靶点(图9-C)。为了进一步分析这些参与巨噬细胞病理学的目标,进行了GO和KEGG通路富集分析以进行功能预测。主要在靶标中富集的GO BP条目包括对激素的反应、蛋白质磷酸化的正向调节、蛋白丝氨酸/苏氨酸激酶活性的调节、细胞死亡的正向调节等(图9-D)。在KEGG通路分析中,这26个防风靶点在IL-17、PI3K/Akt、RA和凋亡等信号通路高度富集。上述结果表明,这些防风靶点与巨噬细胞病理学密切相关,在RA发病机制的相关病理过程中发挥着重要的作用。

A-PPI网络中防风治疗RA关键靶点表达 B-IPS网络中核心靶点表达

A-DEGs和防风治疗RA的共同靶点,每个气泡点的大小表示相应的P值 B-26个DEGs的表达模式热图 C-参与巨噬细胞病理学的25个防风靶点的PPI网络 D-巨噬细胞病理学相关靶标的GO BP和KEGG通路富集分析,BP和KEGG分析的前20个富集项的气泡图,按−lgP排序
3.1.9 通过分子对接检测核心成分与核心靶标之间的结合能力 在IPS核心网络中共有8个活性成分和10个关键靶点,最终得到40组配体-受体对接结果。基于亲和力分数的对接结果见图10,所有对接组合的结合能均小于−20.929 3 kJ/mol,其中得分最低的是汉黄芩素-AKT1对接组合,得分为−26.370 9 kJ/mol,最高的是紫花前胡素-PTGS2对接组合,得分为−47.300 1 kJ/mol。配体-受体结合构象结合能越低,表明构象越稳定,则互作的可能性也越大。分子对接结果显示所有对接组合均具有较强的对接活性,表明这些核心活性成分可能通过核心靶点在RA的治疗中发挥关键作用。对接分数排名前5的分子对接三维视图如图11所示。
3.2 实验验证
3.2.1 别欧前胡素抑制细胞活力、迁移和侵袭及细胞因子和MMPs的表达,并诱导细胞凋亡 在Hithubs Network中排名前4的核心成分是汉黄芩素(26)、β-谷甾醇(567)、5--甲基维斯阿米醇(11)和别欧前胡素(3),前3个并不是防风的特异性成分,因此选择仅在3种(括号中数字)中药中分布的别欧前胡素作进一步的深入验证机制研究。

图10 防风的8个核心成分与10个关键靶点的对接得分
如图12-A所示,在MH7A细胞中干预24 h后,别欧前胡素(60、80、120、160 μmol/L)和MTX(20 μmol/L)明显抑制细胞活力(<0.05、0.01);在处理48 h后,别欧前胡素(80、120、160 μmol/L)和MTX(20 μmol/L)明显抑制细胞活力(<0.01)。在MH7A细胞中选择浓度为20、40、60 μmol/L的别欧前胡素进行后续实验。别欧前胡素和MTX显著抑制MH7A细胞的迁移和侵袭(<0.05、0.01,图12-B);别欧前胡素和MTX均显著降低TNF-α诱导的MH7A细胞中、、、和的mRNA表达水平(<0.01,图12-C);别欧前胡素(40、60 μmol/L)和MTX显著诱导MH7A细胞凋亡(<0.05、0.01,图12-D)。

图11 按对接分数排序的前5种分子对接组合的3D视图

A-别欧前胡素和MTX作用24、48 h对细胞活力的影响 B-别欧前胡素和MTX对细胞迁移和侵袭的影响 C-别欧前胡素和MTX对TNF-α诱导的细胞炎症因子基因表达的影响 D-别欧前胡素和MTX对细胞凋亡的影响 与对照组比较:*<0.05**<0.01;与TNF-α组比较:##<0.01;与MTX组比较:▲<0.05▲▲<0.01
A-effects of prangenidin and MTX for 24 and 48 h on cell viability B-effects of prangenidin and MTX on cell migration and invasion C-effects of prangenidin and MTX on inflammatory factors gene expressions in TNF-α-induced cells D-effects of prangenidin and MTX on cell apoptosis*< 0.05**< 0.01control group;##< 0.01TNF-α group;▲< 0.05▲▲< 0.01MTX group
图12 别欧前胡素对MH7A细胞生物学行为的影响
Fig. 12 Effect of prangenidin on biological behavior of MH7A cells
3.2.2 别欧前胡素通过抑制PI3K/Akt通路对MH7A细胞发挥调节作用 网络药理学的结果表明别欧前胡素治疗RA的机制与PI3K/Akt通路和细胞死亡的调控生物过程相关,潜在靶基因包括Bax、Bcl-2等与细胞凋亡相关的蛋白。为了阐明别欧前胡素改善RA的机制,采用Western blotting分析相关蛋白表达。TNF-α(10 ng/mL)诱导后p-PI3K/PI3K和p-Akt/Akt值显著升高(<0.01,图13-A),别欧前胡素(40 μmol/L)作用后显著降低了p-PI3K/PI3K和p-Akt/Akt值(<0.01)。然后,使用PI3K抑制剂LY294002检测其对细胞迁移和侵袭、细胞凋亡、细胞因子和MMPs表达的调控作用,并检测凋亡相关蛋白表达。LY294002(20 μmol/L)显著抑制MH7A细胞迁移和侵袭(<0.01,图13-B),并显著降低TNF-α(10 ng/mL)诱导的MH7A细胞中、、、和的mRNA表达水平(<0.01,图13-C)。别欧前胡素(40 μmol/L)和LY294002(20 μmol/L)显著诱导MH7A细胞凋亡(<0.05、0.01,图13-D),下调Bcl-xL并上调Bax、cleaved Caspase-3表达(<0.01,图13-E)。
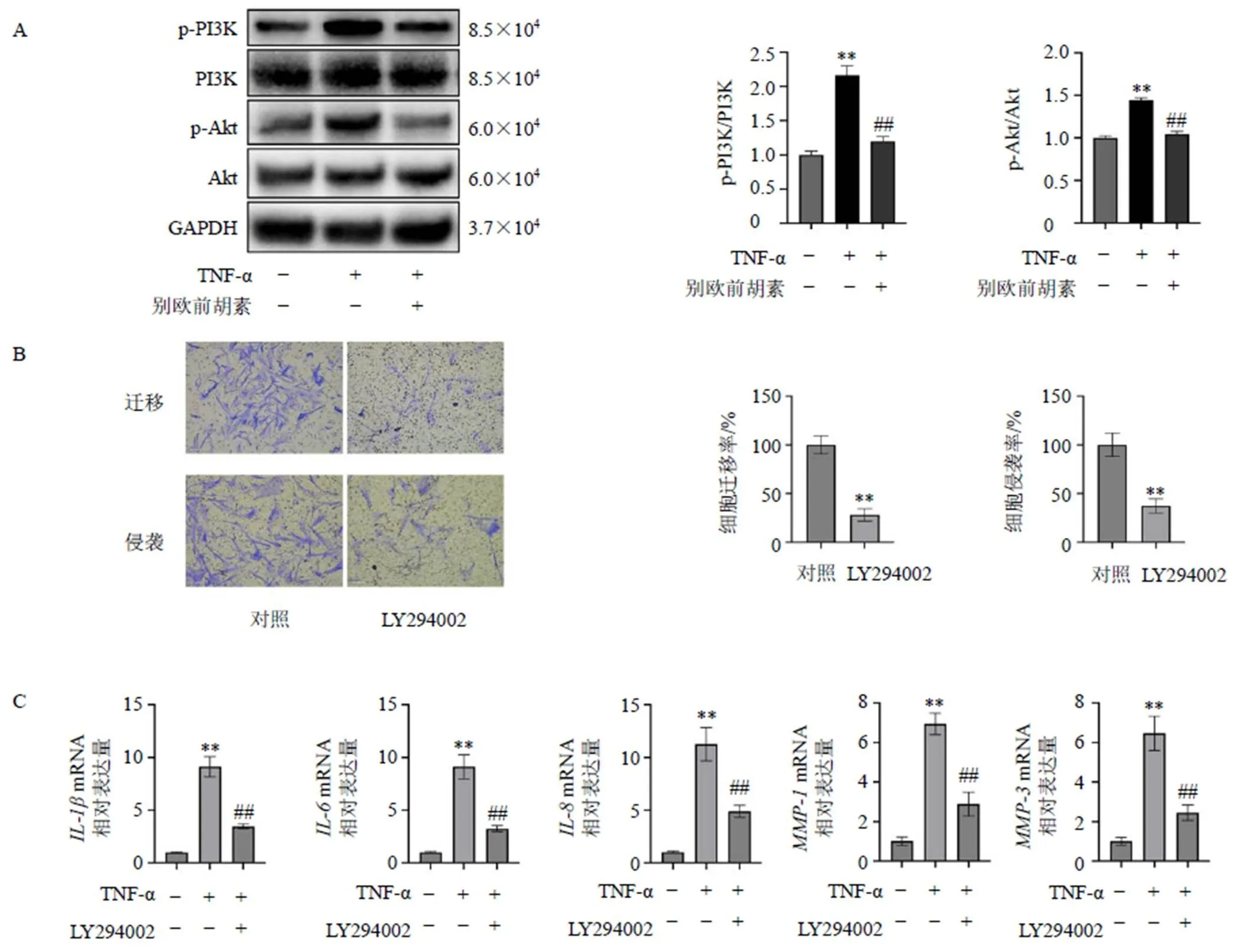
A-别欧前胡素对TNF-α诱导的细胞PI3K/Akt通路相关蛋白表达的影响 B-LY294002对细胞迁移和侵袭的影响 C-LY294002对TNF-α诱导的细胞炎症因子基因表达的影响 D-别欧前胡素和LY294002对细胞凋亡的影响 E-别欧前胡素和LY294002对细胞凋亡相关蛋白表达的影响 与对照组比较:*<0.05**<0.01;与TNF-α组比较:##<0.01;与LY294002组比较:▲<0.05▲▲<0.01
A-effect of prangenidin on PI3K/Akt pathway related protein expressions in TNF-α-induced cells B-effect of LY294002 on cell migration and invasion C-effect of LY294002 on inflammatory factors gene expressions in TNF-α-induced cells D-effects of prangenidin and LY294002 on cell apoptosis E-effects of prangenidin and LY294002 on apoptosis related protein expressions in cells*< 0.05**< 0.01control group;##< 0.01TNF-α group;▲< 0.05▲▲< 0.01LY294002 group
图13 别欧前胡素对MH7A细胞PI3K/Akt通路的影响
Fig. 13 Effect of prangenidin on PI3K/Akt pathway in MH7A cells
4 讨论
本研究系统地评价了防风生物活性成分的药理、毒理和分子特性,加深了对这些防风活性成分的认识。对防风-RA共存靶点进行蛋白质功能分类、BioGPS靶点-器官定位分析,还使用GEO数据库中人类高通量组学数据验证了与RA致病机制相关的防风靶点,并对别欧前胡素进行了体外实验验证。
通过建立和筛选IPS网络得到核心成分汉黄芩素、β-谷甾醇、5--甲基维斯阿米醇和别欧前胡素等,核心靶点PTGS2、RELA、AKT1等。Khan等[24]研究显示汉黄芩素可以有效抑制IL-1β刺激的软骨细胞中IL-6、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、一氧化氮和前列腺素E2(prostaglandin E2,PGE2)炎症介质的表达和产生,通过激活相应信号通路发挥确切的抗炎和软骨保护作用。此外,动物实验表明汉黄芩素通过核因子-κB(nuclear factor-κB,NF-κB)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路改善胶原诱导的关节炎(collagen-induced arthritis,CIA)大鼠RA症状,并呈剂量相关性地改善抗氧化蛋白、氧化应激标志物和炎性细胞因子水平的变化[25]。一项对小鼠巨噬细胞的研究表明,β-谷甾醇处理后,一些趋化因子和促炎因子释放减少,抗炎因子IL-10水平增加,并且提高了蛋白酪氨酸磷酸酶1(protein phosphoserine phosphatase-1,SHP-1)活性,抑制了信号传导及转录激活因子1(signal transducers and activators of transcription 1,STAT1)和NF-κB信号转导[26]。其他研究表明,β-谷甾醇通过抑制NF-κB和激活血红素加氧酶-1(heme oxygenase-1,HO-1)/核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路对CIA大鼠起到抗关节炎作用,β-谷甾醇可以通过调节巨噬细胞功能,抑制M1极化,增强M2极化从而减少促炎因子和增加抗炎因子释放[27-28]。大量研究表明汉黄芩素、5--甲基维斯阿米醇等色原酮类化合物在各种动物模型和细胞实验中抑制炎性细胞因子释放和炎症相关信号通路的转导[29-30]。以上研究充分说明防风活性成分在RA的治疗中有很好的抗炎和免疫调节作用。此外,既往大量文献研究表明这些核心靶点在RA的治疗和发病机制中发挥着关键作用[31-33]。
通过PPI网络可以看出66个靶点间并非相互独立,而是呈现相互作用的交互关系[34]。在成分-靶点网络中,很多靶基因可以被防风的多种活性成分调控,这体现了中医药疗法多成分、多靶点的特质。进一步对66个靶基因进行了GO BP和KEGG通路富集分析。其中PI3K/Akt和IL-17是IPS核心网络中的主要信号通路。和既往的研究一致[35],表明这些信号通路在RA疾病的发生和发展具有重要影响。研究表明,阻断PI3K/Akt通路可以抑制RA患者FLSs的肿瘤样生物学行为[36-37]。Chang等[38]发现IL-17通过激活STAT3上调自噬增强了RA中FLSs的肿瘤样增殖。IL-17在RA-FLSs中诱导线粒体功能障碍和自噬体形成,表明它们对细胞凋亡具有抗性。IL-17诱导的自噬相关抗细胞凋亡通过抑制自噬而恢复,这表明线粒体功能障碍与RA-FLSs中的细胞存活之间存在关系。辅助性T细胞17(T helper cell 17,Th17)和IL-17通过引起线粒体功能障碍增加RA-FLSs的自噬[39]。最近一项研究总结了中药及其活性成分对RA-FLSs的凋亡诱导,阐述了促凋亡治疗RA的重要分子机制[40]。本研究结果表明,防风有效成分可以通过作用于多种生物学过程和信号通路发挥抗炎和免疫调节等作用,从而起到对RA的治疗作用。对IPS中筛选出的核心成分和核心靶点组合进行分子对接验证,结果显示所有对接组合均具有良好的对接活性,说明其可能在RA的治疗中发挥着重要的作用。预测结果为防风中活性成分作用于特定靶点治疗RA提供了依据。
在RA滑膜炎性环境中,FLSs会发生凋亡异常,“类肿瘤样”异常增殖,会导致细胞过度活化,迁移、侵袭能力加强。RA-FLSs分泌细胞因子和免疫细胞的募集都会导致PI3K/Akt通路的高度激活,并进一步参与RA-FLSs的异常生物学行为和炎症,导致炎症性侵蚀性关节炎和TNF-α介导的软骨破坏[41]。TNF-α刺激T细胞产生巨噬细胞集落刺激因子,激活成骨细胞产生核因子-κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL),间接诱导破骨细胞的产生[42]。被PI3K激活的Akt能够通过磷酸化作用抑制或激活其下游死亡启动子相关靶蛋白Bcl-xL/Bcl-2从而影响细胞凋亡[35]。别欧前胡素是一种香豆素类生物活性化合物,既往研究表明,其具有抗肿瘤活性、抗氧化、抗炎,以及诱导激活细胞凋亡、铁死亡、氧化死亡以抑制细胞生长和迁移、侵袭等多种药理学作用[43-47]。但目前为止,有关该化合物的研究很少,其对RA-FLSs的异常生物学行为影响的研究尚无报道。在本研究中,首次阐述了别欧前胡素可以抑制MH7A细胞的活力、迁移和侵袭,并诱导细胞凋亡,也能抑制、、、和的表达,这可能是别欧前胡素治疗RA的机制。分子分析表明别欧前胡素通过抑制PI3K/Akt通路发挥对MH7A细胞的调控作用。
本研究通过以网络药理学为基础的研究方法,系统地阐明了防风治疗RA的分子靶点和潜在机制。构建“成分-靶点”网络,筛选出防风治疗RA的核心成分和关键靶点及其作用的方式,以及对活性成分-靶点进行分子对接验证,为揭示防风治疗RA的分子生物学机制和药物研发提供了进一步的理论依据。体外实验研究结果表明,别欧前胡素是通过抑制PI3K/Akt通路的分子机制在RA治疗中发挥作用的一种新的有价值的天然潜在药物。
利益冲突 所有作者均声明不存在利益冲突
[1] Radu A F, Bungau S G. Management of rheumatoid arthritis: An overview [J]., 2021, 10(11): 2857.
[2] Guo Q, Wang Y X, Xu D,. Rheumatoid arthritis: Pathological mechanisms and modern pharmacologic therapies [J]., 2018, 6: 15.
[3] Baum R, Gravallese E M. Bone as a target organ in rheumatic disease: Impact on osteoclasts and osteoblasts [J]., 2016, 51(1): 1-15.
[4] Cheng L Y, Wang Y Y, Wu R H,. New insights from single-cell sequencing data: Synovial fibroblasts and synovial macrophages in rheumatoid arthritis [J]., 2021, 12: 709178.
[5] Serratì S, Margheri F, Chillà A,. Reduction ofinvasion andcartilage degradation in a SCID mouse model by loss of function of the fibrinolytic system of rheumatoid arthritis synovial fibroblasts [J]., 2011, 63(9): 2584-2594.
[6] Bartok B, Firestein G S. Fibroblast-like synoviocytes: Key effector cells in rheumatoid arthritis [J]., 2010, 233(1): 233-255.
[7] Nygaard G, Firestein G S. Restoring synovial homeostasis in rheumatoid arthritis by targeting fibroblast-like synoviocytes [J]., 2020, 16(6): 316-333.
[8] Noss E H, Brenner M B. The role and therapeutic implications of fibroblast-like synoviocytes in inflammation and cartilage erosion in rheumatoid arthritis [J]., 2008, 223(1): 252-270.
[9] Bao Z Z, Zhu Z Y, Zhang H J,. The complete chloroplast genome of[J]., 2019, 5(1): 360-361.
[10] 中国药典 [S]. 一部. 2020: 156.
[11] 梁瑞峰, 李兵杰, 葛文静, 等. 防风不同提取部位的燥性差异及其对胶原诱导性关节炎大鼠滑膜水通道蛋白的影响 [J]. 中草药, 2021, 52(11): 3312-3320.
[12] Chun J M, Kim H S, Lee A Y,. Anti-inflammatory and antiosteoarthritis effects ofethanol extract:andstudies [J]., 2016, 2016: 1984238.
[13] Tai J, Cheung S. Anti-proliferative and antioxidant activities of[J]., 2007, 18(1): 227-234.
[14] Yang M, Wang C C, Wang W L,.-an ethnopharmacological, phytochemical and pharmacological review [J]., 2020, 26(11): 873-880.
[15] Kreiner J, Pang E, Lenon G B,.: A phytochemical, pharmacological, and pharmacokinetic review [J]., 2017, 15(4): 255-264.
[16] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[17] Berger S I, Iyengar R. Network analyses in systems pharmacology [J]., 2009, 25(19): 2466-2472.
[18] Kitchen D B, Decornez H, Furr J R,. Docking and scoring in virtual screening for drug discovery: Methods and applications [J]., 2004, 3(11): 935-949.
[19] Shen X, Zhao Z Y, Wang H,. Elucidation of the anti-inflammatory mechanisms ofandusing system pharmacological analyses [J]., 2017, 2017: 3709874.
[20] Gaillard T. Evaluation of AutoDock and AutoDock vina on the CASF-2013 benchmark [J]., 2018, 58(8): 1697-1706.
[21] Liu X, Shi F, Li Y,. Post-translational modifications as key regulators of TNF-induced necroptosis [J]., 2016, 7(7): e2293.
[22] Alpízar-Rodríguez D, Pluchino N, Canny G,. The role of female hormonal factors in the development of rheumatoid arthritis [J].(), 2017, 56(8): 1254-1263.
[23] Yang X Z, Chang Y, Wei W. Emerging role of targeting macrophages in rheumatoid arthritis: Focus on polarization, metabolism and apoptosis [J]., 2020, 53(7): e12854.
[24] Khan N M, Haseeb A, Ansari M Y,. Wogonin, a plant derived small molecule, exerts potent anti-inflammatory and chondroprotective effects through the activation of ROS/ERK/Nrf2 signaling pathways in human Osteoarthritis chondrocytes [J]., 2017, 106: 288-301.
[25] Huang Y T, Guo L B, Chitti R,. Wogonin ameliorate complete Freund’s adjuvant induced rheumatoid arthritis via targeting NF-κB/MAPK signaling pathway [J]., 2020, 46(2): 283-291.
[26] Valerio M, Awad A B. β-Sitosterol down-regulates some pro-inflammatory signal transduction pathways by increasing the activity of tyrosine phosphatase SHP-1 in J774A.1 murine macrophages [J]., 2011, 11(8): 1012-1017.
[27] Zhang F, Liu Z Y, He X J,. β-Sitosterol-loaded solid lipid nanoparticles ameliorate complete Freund’s adjuvant-induced arthritis in rats: Involvement of NF-кB and HO-1/Nrf-2 pathway [J]., 2020, 27(1): 1329-1341.
[28] Liu R, Hao D L, Xu W Y,. β-Sitosterol modulates macrophage polarization and attenuates rheumatoid inflammation in mice [J]., 2019, 57(1): 161-168.
[29] Kong X Y, Liu C F, Zhang C,. The suppressive effects of(Fangfeng) chromone extract on rheumatoid arthritis via inhibition of nuclear factor-κB and mitogen activated proteinkinases activation on collagen-induced arthritis model [J]., 2013, 148(3): 842-850.
[30] Okuyama E, Hasegawa T, Matsushita T,. Analgesic components ofroot () [J].(), 2001, 49(2): 154-160.
[31] Fan H W, Liu G Y, Zhao C F,. Differential expression of COX-2 in osteoarthritis and rheumatoid arthritis [J]., 2015, 14(4): 12872-12879.
[32] Giridharan S, Srinivasan M. Mechanisms of NF-κB p65 and strategies for therapeutic manipulation [J]., 2018, 11: 407-419.
[33] Che N, Sun X X, Gu L,. Adiponectin enhances B-cell proliferation and differentiation via activation of Akt1/STAT3 and exacerbates collagen-induced arthritis [J]., 2021, 12: 626310.
[34] Zeng Q, Li L F, Jin Y,. A network pharmacology approach to reveal the underlying mechanisms ofPall. on the treatment of Alzheimer’s disease [J]., 2019, 2019: 8706589.
[35] Liu S, Ma H X, Zhang H X,. Recent advances on signaling pathways and their inhibitors in rheumatoid arthritis [J]., 2021, 230: 108793.
[36] Liu Y, Pan Y F, Xue Y Q,. uPAR promotes tumor-like biologic behaviors of fibroblast-like synoviocytes through PI3K/Akt signaling pathway in patients with rheumatoid arthritis [J]., 2018, 15(2): 171-181.
[37] Song B, Li X F, Yao Y,. BMP9 inhibits the proliferation and migration of fibroblast-like synoviocytes in rheumatoid arthritis via the PI3K/AKT signaling pathway [J]., 2019, 74: 105685.
[38] Chang L, Feng X, Gao W. Proliferation of rheumatoid arthritis fibroblast-like synoviocytes is enhanced by IL-17-mediated autophagy through STAT3 activation [J]., 2019, 60(4): 358-366.
[39] Kim E K, Kwon J E, Lee S Y,. IL-17-mediated mitochondrial dysfunction impairs apoptosis in rheumatoid arthritis synovial fibroblasts through activation of autophagy [J]., 2017, 8(1): e2565.
[40] Zhang Q, Liu J, Zhang M M,. Apoptosis induction of fibroblast-like synoviocytes is an important molecular-mechanism for herbal medicine along with its active components in treating rheumatoid arthritis [J]., 2019, 9(12): 795.
[41] Liu S Y, Cao C X, Zhang Y J,. PI3K/Akt inhibitor partly decreases TNF-α-induced activation of fibroblast-like synoviocytes in osteoarthritis [J]., 2019, 14(1): 425.
[42] Chen X J, Chen W, Aung Z M,. LY3023414 inhibits both osteogenesis and osteoclastogenesis through the PI3K/Akt/GSK3 signalling pathway [J]., 2021, 10(4): 237-249.
[43] Bai Y Y, Yang L J, Zhang C H,. Studies on the mechanism of alloimperatorin on the proliferation and apoptosis of HeLa cells [J]., 2021, 2021: 6617312.
[44] Abd-Alla H I, Ibrahim Fouad G, Ahmed K A,. Alloimperatorin fromfruits mitigates Piroxicam-provoked gastric ulcer and hepatorenal toxicity in ratssuppressing oxidative stress and apoptosis [J]., 2022, 27(8): 727-742.
[45] Bai Y Y, Cheng Y M, Wang W H,.andstudies of alloimperatorin induced autophagy in cervical cancer cells via reactive oxygen species pathway [J]., 2022, 13(6): 14299-14314.
[46] Zhang J, Gao R F, Li J,. Alloimperatorin activates apoptosis, ferroptosis, and oxeiptosis to inhibit the growth and invasion of breast cancer cells[J]., 2022, 100(3): 213-222.
[47] Li H, Chao X, He C-LAlloimperatorin and its epoxide derivative exhibit in vitro antitumor activity in HL-60 acute myeloid leukemia cancer cells via inducing apoptosis, cell cycle disruption and inhibition of cell migration [J]., 2016, 11(1): 194-199.
Bioactive components inand its mechanism on rheumatoid arthritis based on network pharmacology
JIANG Yong1, 2, ZHONG Shu-xin3, HE Sheng-hua4, LIANG Jia-bin1, 2, ZHANG Hao-yu1, 2, YE Yu-feng2, CHEN Han-wei2, 5
1. Guangzhou Panyu Central Hospital, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 2. Central Laboratory, Guangzhou Panyu Central Hospital, Guangzhou 511486, China 3. School of Medicine, Jinan University, Guangzhou 510632, China 4. The Fourth Clinical Medical College, Guangzhou University of Chinese Medicine, Shenzhen 518033, China 5. Guangzhou Panyu Health Management Center, Guangzhou 511495, China
To investigate the molecular biological mechanism ofin treating rheumatoid arthritis (RA) through a pharmacology-based strategy.The bioactive phytochemicals ofand potential targets for the treatment of RA were screened by network pharmacology, and phytochemicals-related parameters such as pharmacology and toxicology were evaluated. The protein interaction network was established to screen the core targets, and the correlation between the core targets and RA was further validated by bioinformatics strategy. Finally, molecular docking of core components and corresponding targets was performed. CCK-8 assay, cell migration and invasion, cell apoptosis, qRT-PCR, and Western blotting analysis were performed to clarify the regulation of prangenidin on phosphatidylinositol 3-kinase/protein kinase B (PI3K/Akt) pathway in MH7A cells.A total of 18 bioactive phytochemicals and 66 potential target genes intersecting with the screened RA disease target genes were identified from. Finally, core ingredients such as wogonin, β-sitosterol, 5--methylvisamminol and prangenidin were obtained. The underlying mechanism ofin treating RA might be achieved by regulating pathways such as PI3K/Akt, interleukin-17 (IL-17), apoptosis and multiple biological processes to exert anti-inflammatory and immunomodulatory effects. Molecular docking confirmed that all core ingredients and key targets had great docking activity. Prangenidin inhibited viability, migration and invasion (< 0.05, 0.01), induced apoptosis in MH7A cells (< 0.01), and significantly down-regulated,,, matrix metalloproteinase-1 () andgene expressions (< 0.01). Molecular analysis showed that prangenidin exerts its regulatory effect on MH7A cells by inhibiting PI3K/Akt pathway.This study successfully predict the effective components and potential targets ofin the treatment of RA, which provide a new theoretical basis for further exploring its molecular mechanism. It is revealed that prangenidin inhibits the activity, migration, invasion and expressions of cytokines and MMPs of RA fibroblast-like synovial cells through PI3K/Akt pathway, and induces cell apoptosis.
(Turcz.) Schischk; rheumatoid arthritis; network pharmacology; pathogenesis mechanism; prangenidin; wogonin; 5--methylvisamminol; fibroblast-like synoviocytes; PI3K/Akt signaling pathway
R285.5
A
0253 - 2670(2023)17 - 5601 - 18
10.7501/j.issn.0253-2670.2023.17.014
2023-04-03
国家自然科学基金资助项目(8217150266);国家自然科学基金资助项目(81729003);广州市卫生健康委员会科技项目(20211A011114);广州市番禺区科技计划重大项目(2022-Z04-114)
蒋 勇,博士研究生,主要从事中药药理学研究。E-mail: 20202120219@stu.gzucm.edu.cn
叶裕丰,教授,博士生导师。E-mail: 838554325@qq.com
陈汉威,教授,博士生导师。E-mail: docterwei@sina.com
[责任编辑 李亚楠]

