丁香酚酯及肉桂醇酯对氟比洛芬透皮吸收的影响*
王 晶,张金伟,张艺蓉,万旭春,尹 虹,李翰铭,赵利刚,2**
(1. 华北理工大学药学院 唐山 063210;2. 唐山市新型药物制剂与释药技术重点实验室 唐山 063210)
经皮给药系统(Transdermal drug delivery system,TDDS)是指药物以恒定或接近恒定速度进入皮肤,对全身或局部起到治疗作用的新型给药系统[1]。因皮肤角质层(SC)的阻碍作用,大部分药物经皮透过量达不到治疗浓度的需求[2]。目前应用透皮吸收促透剂是提高药物经皮透过量的常用手段。天然挥发油主要来源于中药材,是其活性成分的一类。由于促透时滞短、促透效果好、刺激性小,天然挥发油作为经皮吸收促透剂具有很大的优势和潜力[3]。
肉桂油是樟科植物肉桂的干皮经水蒸汽蒸馏后得到的黄色液体,肉桂醛为其中的主要成分,约占总提取成分的70%-85%[4],结合前期研究发现肉桂醇可以与皮肤中的神经酰胺产生更强的氢键作用,其促透能力强于肉桂醛,且肉桂醛在透皮吸收时会转化为肉桂醇[5],因而本研究选用肉桂醇;丁香油是桃金娘科植物丁香的干燥花蕾经水蒸汽蒸馏后得到的无色液体,丁香酚为其中的主要成分,约占总提取成分的70%以上[6]。已有研究表明,肉桂油和丁香油作为促透剂对阿魏酸、磷酸川穹嗪、参黄散等药物具有显著的促透效果[7-9]。由于中药挥发油成分复杂,因此选择丁香油和肉桂油中的主要成分丁香酚、肉桂醇对其进行深入系统的研究,但二者在室温下易挥发,严重制约其在经皮给药制剂中作为关键辅料的应用。对易挥发组分进行结构改造,降低其挥发性、优化其促透活性,如将异胡薄荷酮、香芹醇与脂肪酸酯化合可促进氨氯地平、氟比洛芬等药物的经皮吸收[10-11];或将香茅醇、肉桂醇与氨基酸成酯,促进茶碱、西多福韦等药物的经皮渗透[12]。因此,本研究以CIN、EUG 为先导化合物与硬脂酸合成硬脂酸肉桂醇酯(CIN-C18)、硬脂酸丁香酚酯(EUG-C18)作为新型促透剂,以氟比洛芬为模型药物,探究其促透活性,以期为新型经皮给药系统的研发提供可利用的关键辅料。
1 实验材料
1.1 实验动物
雄性大耳兔(2000±200)g,华北理工大学实验动物中心,动物合格证编号SCXK(京)2019-0008,实验过程均符合《实验动物调查伦理指南》。
1.2 实验药品及试剂
DURO-TAK 87-235A 压敏胶(医用级,德国汉高公司);氟比洛芬原料药(批号:20200316,上海源叶生物科技有限公司);尼泊金异丙酯(孝感深远化工有限公司);肉桂醇、丁香酚(上海麦克林生化有限公司);硬脂酸(津东天正化学试剂有限公司);色谱级甲醇(北京迈瑞达科技有限公司);其余试剂均为分析纯。
1.3 实验设备
TP-01 型卧式双室透皮仪(沈阳天美达科学仪器有限公司);ST-16R 型高速冷冻离心机(美国Thermo Fisher Scientific 公司);RC-8 溶出度测试仪(天津新天光技术开发有限公司);LC-2010A 型高效液相色谱仪(日本Shimadzu公司)包括LC-20AT型泵、SDP-20A型检测器;Hypersi ODS色谱柱。
2 实验方法
2.1 CIN-C18、EUG-C18的制备及结构确证
采用酰氯酯化法合成CIN-C18、EUG-C18,其反应路线如图1所示。取硬脂酸与氯化亚砜置于圆底烧瓶中,于油浴加热至65℃回流4 h,之后加入挥发油,继续油浴75℃反应4 h。以0.5 mol·L-1NaOH 溶液调节pH=9.0,将调节好PH 值的粗产物用乙酸乙酯(100 mL)萃取数次至无色,收集有机相,选用无水硫酸镁进行脱水处理。得到的粗产物,经过柱色谱(800 mm×20 mm,硅胶为200-300 目)分离,以石油醚:乙酸乙酯(50:1,v/v)为流动相进行洗脱。后经1H-NMR 检测产物结构,并通过气相法(GC)检测挥发油酯的纯度均>98%。

图1 CIN-C18、EUG-C18的合成路线
CIN-C18:1H-NMR (600 MHz, CDCl3)δ:7.48-7.40 (6H, m), 7.36 (6H, dd,J=8.4, 6.8 Hz), 7.34-7.27 (5H, m), 6.69 (3H, d,J=15.6 Hz), 6.35 (3H, dt,J=15.7, 7.2 Hz,), 4.28 (6H, dd,J=7.2, 1.2 Hz,), 7.61-0.70 (10H, m), 1.28 (4H, s), 0.91 (1H, t,J=6.9 Hz).产率:76.5%。
EUG-C18:1H-NMR (600 MHz, CDCl3)δ:7.05-6.69 (3H, m), 5.98 (1H, ddt,J=16.9, 10.1, 6.7 Hz), 5.25-4.86 (2H, m), 4.15 (3H, q,J=7.2 Hz), 3.83 (4H, s),3.40 (2H, dd,J=6.7, 1.6 Hz), 2.58 (2H, t,J=7.5 Hz),2.31 (4H, t,J=7.5 Hz), 1.90-1.70 (3H, m), 1.65 (4H, q,J=7.4 Hz), 1.44-1.37 (2H, m), 1.36-1.11 (12H, m),0.90 (4H, t,J=7.0 Hz)。产率:77.4%。
2.2 体外分析方法的建立及方法学考察
2.2.1 色谱条件
Hypersi ODS 色谱柱(4.6 mm×150 mm,5 mm);流动相:甲醇-含1%冰乙酸的水溶液(55:45,v/v);检测波长:247 nm;柱温40℃;流速:1.0 mL·min-1;内标为40 µg·mL-1尼泊金异丙酯溶液。
2.2.2 标准曲线方程
精密称量20.01 mg 的FP 于容量瓶中,加入甲醇定容,稀释至200 µg·mL-1,再稀释为浓度为0.2-100 µg·mL-1的FP溶液。分别加入等体积、浓度为40 µg·mL-1尼泊金异丙酯溶液。以尼泊金异丙酯为内标物,通过HPLC 进行溶液检测,分析药物与内标的峰面积比值(Ai)随模型药物的不同浓度(C)的变化曲线。对数据进行线性拟合,得到回归方程:Ai=0.0304C+0.0046,r=0.9999。证明在0.2-100 µg·mL-1范围内,二者具有良好的线性相关性。
2.2.3 精密度
日内精密度测定需在1 天时间内对高、中、低3 个浓度下的样品进行分析,日间精密度测定选用相同浓度样品连续3 天进样分析,得到3 种浓度的日内精密度均值分别为RSD:(0.98±0.13)%、(0.91±0.19)%和(1.12±0.37)%(n=6),日间精密度均值分别为RSD:(0.95±0.17)%、(0.98±0.29)%和(1.03±0.41)%(n=6)。
2.2.4 回收率
通过计算高、中、低三种药物浓度的比来确定回收率,得到FP平均加样回收率分别为(97.86±0.52)%、(98.36±0.36)%和(99.03±0.23)%(n=6)。
2.3 体外透皮实验
2.3.1 离体兔皮的制备
选取体质量(2000±200)g 的家兔,以质量浓度为20%的乌来糖溶液作为麻醉剂,将其背部朝上固定于兔台,用修剪器除去背部长毛后,用剃须刀除去细密绒毛。待皮肤裸露后,采用空气栓塞法处死大耳兔。之后,迅速剥离背部皮肤,剔除皮肤中的脂肪和结缔组织,裁剪成1cm2,于生理盐水下冲洗数次,之后置于密封袋中低温(-80℃)冷冻保存。兔皮须在7 天内使用,使用前应当保证其完整无破损。
2.3.2 贴剂的制备
称取FP 溶于乙酸乙酯溶液中,与促透剂、压敏胶混合,置于磁力搅拌器上搅拌15 min 至混匀,静置脱气10 min 直至气泡消失,将混合物均匀转移到硅酮纸上,室温下放置10 min 挥发溶剂,于50℃下烘干15 min,覆上背衬膜备用。同上制备含有促透剂(挥发油及其酯)的FP 贴剂,处方中FP、压敏胶(DUROTAK 87-235A)的比例保持不变。
2.3.3 体外渗透实验方法
采用水平卧式双室扩散池为实验装置,以离体兔皮为透过屏障,在其角质层一侧贴敷制备好含(不含)促透剂的贴剂,加入3.5 mL pH=7.4的PBS溶液,加入磁转子,32℃下恒温搅拌。于2、4、6、8、10、12、24 h 取样2 mL,同时补充2 mL PBS溶液。在4℃,4000 r·min-1条件下离心5 min,取300 µL 上清液与等量内标液混匀,经高效液相色谱仪分析测定含量。
计算单位面积累积透过量(Q)。以Q对时间t 作图,直线的斜率为稳态透皮速率(Jss),直线与横轴的交点为时滞(tlag),并计算增渗比(ER,即加入促透剂与不加促透剂时药物Q24h之比)
2.4 体外释放实验
选择FP 贴剂(含或不含促透剂)进行药物释放度测定。在(32±0.5)℃下进行实验,取磷酸盐缓冲溶液(900 mL)注入溶出杯中,将贴剂释放面朝上固定于碟网之间,并与桨底相距(25±2)mm 处平行放置[13],于0.5、1、2、4、6、8、10、12、24 h 取样5 mL,同时补充5 mL缓冲溶液。样品经微孔滤膜(0.45 µm)过滤后在室温下4000 r·min-1下离心5 min,与同体积内标液混合,涡旋20 s,通过HPLC检测。
2.5 分子模拟
Materials Studio 7.0 软件用于模拟促透剂-模型药物-神经酰胺三者之间相互作用的影响。从ChemDraw 16.0 中获得模型药物(FP)、神经酰胺(CER-NP)及促透剂(CIN、EUG、CIN-C18、EUG-C18)结构,在COMPASSII 力场下,首先在Forcite 模块下对结构进行优化,其次在Blend 模块下进行化合物的混合,寻找最优构象,最后在Dreding 力场下计算各化合物间结合的键能及键长。
2.6 ATR-FTIR
剔除兔背部毛发,标记15 个的不同区域(面积为1.0 cm2),随机分5 组(A:无水乙醇,B:1%CIN,C:3%EUG,D:CIN-C18,E:EUG-C18),并向区域内涂抹20 µL 含(不含)促透剂的无水乙醇溶液,渗透30 min后以空气栓塞法处死大耳兔,剥离背部皮肤(标记区域),室温下干燥15 min,利用ATR-FTIR 光谱仪进行检测,其中内反射晶体为硒化锌(ZnSe),入射角为45℃,角质层朝下置于检测器上,在1000-4000 cm-1的检测波长范围内扫描20 次,使用Origin 7.0 软件对红外吸收峰进行分析。
2.7 组织学评价
剔除兔背部毛发,标记5个面积为1.0 cm2的区域,涂抹20 µL含(不含)促透剂的无水乙醇溶液,5个区域分别为(A:无水乙醇,B:1%CIN,C:3%EUG,D:1%CIN-C18,E:3%EUG-C18)。渗透1 h 后,采用空气栓塞法处死大耳白兔,剥离给药区域背部皮肤,4%多聚甲醛溶液固定后将其包埋在石蜡块中,冠状切片,后用苏木精-伊红染料进行染色。组织切片均在Olympus显微镜下,10倍镜观察[14]。
2.8 统计学方法
3 实验结果
3.1 最佳促透浓度的筛选
按“2.3.2”项下的方法分别制备含1%、3%和5%挥发油的FP透皮贴剂,按“2.3.3”项下的方法进行体外经皮渗透实验。以经皮累积透过量(Q24h)为纵坐标、T为横坐标绘制经皮累积渗透曲线,结果见图2。由图可知,含有不同浓度的挥发油对FP的促透效果均显著高于空白组(P<0.05),1%、5%浓度的CIN对FP的Q24h分别为(205.04±29.28)µg·cm-2、(237.78±65.86)µg·cm-2,对FP的促透活性差异均无统计学意义(P>0.05),故选择较小浓度1%进行后续实验。当EUG浓度为3%时,促透效果最佳。在随后的实验中,挥发油酯的浓度与挥发油类化合物等摩尔浓度。
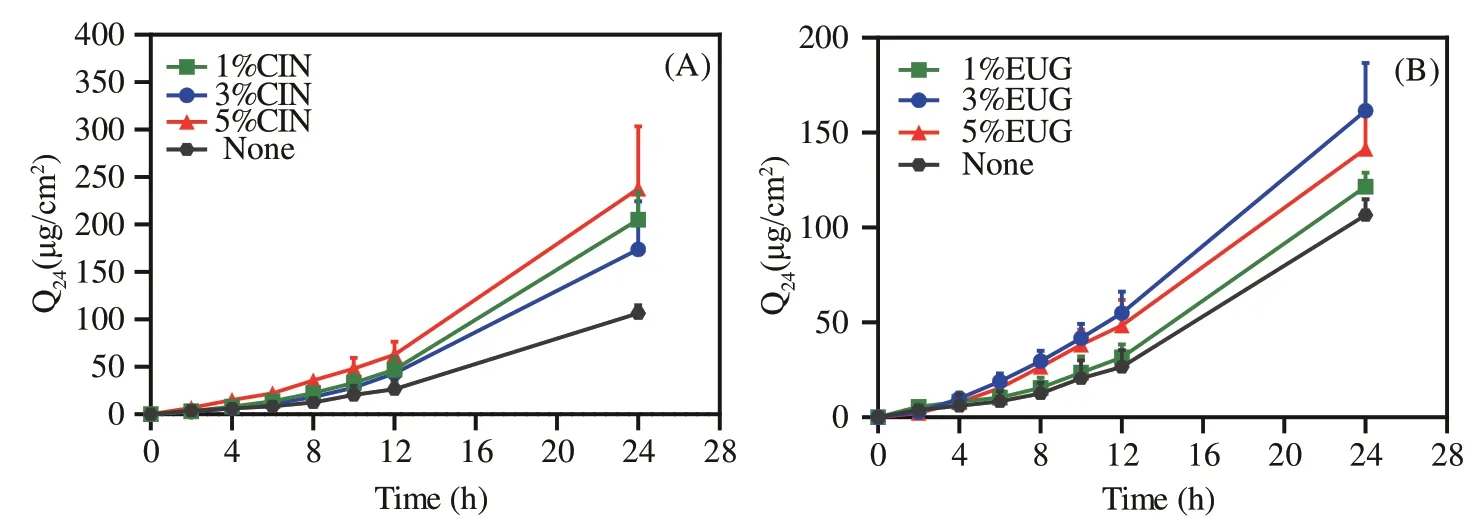
图2 含有不同浓度挥发油的贴剂中FP的经皮渗透曲线(,n=4)
3.2 最佳促透剂的筛选
按“2.3.2”项下的方法制备含挥发油酯的贴剂,考察挥发油及其酯对FP 经皮渗透参数的影响,结果见表1。从结果上看,与空白组相比,CIN、EUG 显著增强FP 的经皮透过量,其中对FP 的增渗比分别为1.92,1.52。体外经皮促透实验表明,促透剂组均能够显著提高FP 的经皮渗透(P<0.05),EUG-C18 对FP 产生的促透量最大,Q24h达到(295.03±45.08)µg·cm-2,CIN-C18仅次于EUG-C18(P<0.05)。结果发现,CIN 的促透效果优于EUG,而EUG-C18的促透效果优于CIN-C18。
表1 挥发油及其硬脂酸酯对FP的经皮渗透影响(,n=4)
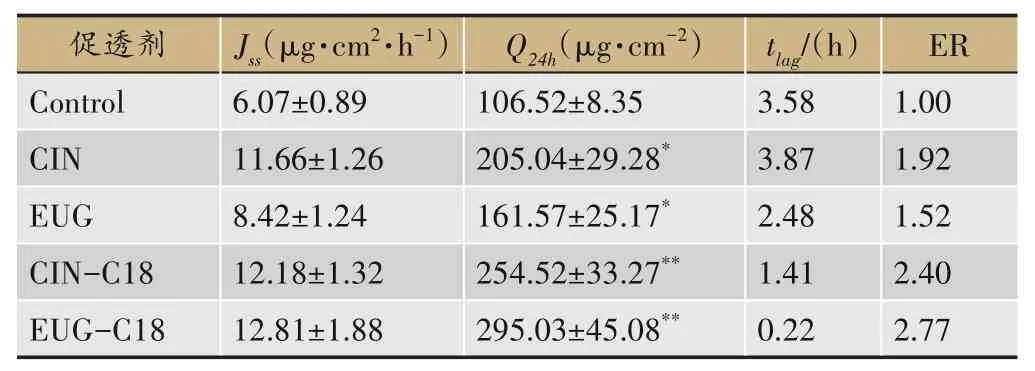
表1 挥发油及其硬脂酸酯对FP的经皮渗透影响(,n=4)
注:与Control相比,*P<0.05;与CIN、EUG相比,**P<0.05。
?
3.3 体外释放实验
如图3 所示,为含或不含促透剂的FP 贴剂的24 h内体外释放百分比,所选用促透剂分别为1%CIN、3%EUG、1%CIN-C18、3%EUG-C18,所有加入促透剂均显著增强了FP的释放(P<0.05),其累积释放度分别为35.06%、30.27%、40.06%、46.61%,高于对照组的23.38%,且促释放能力由大到小依次为EUG-C18>CIN-C18>CIN>EUG。

图3 含有挥发油及其硬脂酸酯的FP贴剂的累积释放度(,n=4)
3.4 分子模拟
如图4 所示,分别为使用Materials Studio 软件计算得到的FP-CER-NP 及FP-促透剂-CER-NP 的最小能量复合物。所有系统计算的氢键键能如表2 所示,结果表明促透剂组计算的氢键键能绝对值均显著高于FP与CER-NP。

表2 分子模拟计算各组氢键键能
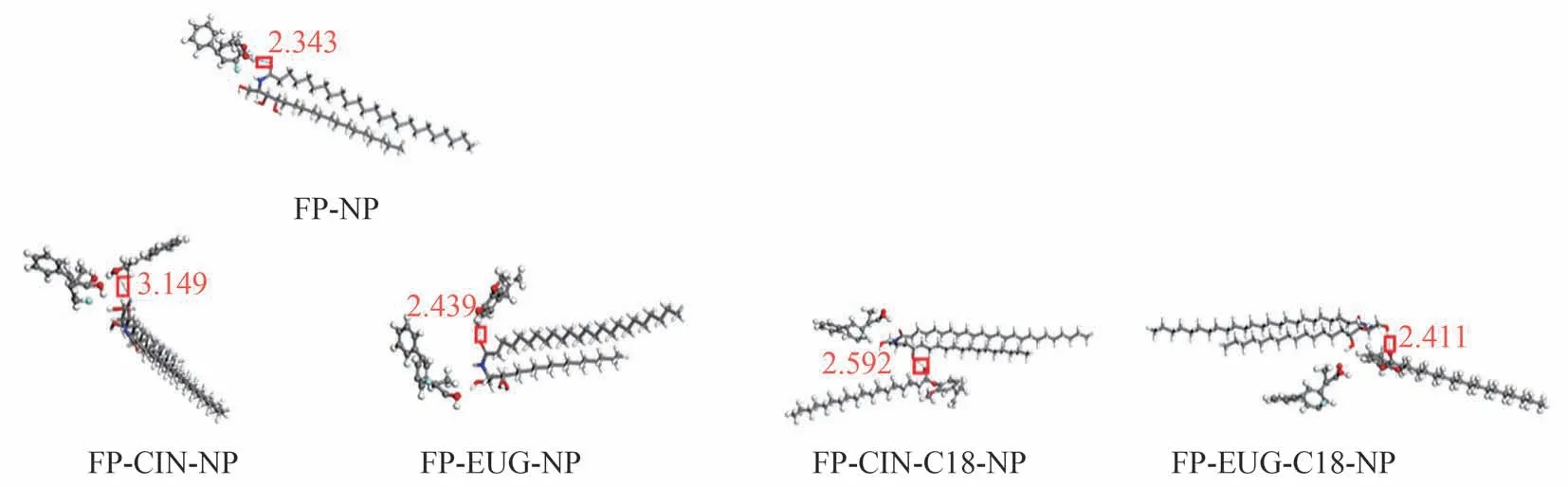
图4 FP、促透剂与NP间的氢键相互作用
3.5 ATR-FTIR
通过ATR-FTIR 检测特征峰位移情况,判断角质层“三明治”结构中烃链的有序度[15]。乙醇不会改变皮肤脂质烃链的排列方式及空间构象,且挥发快,短时间内可以恢复角质层屏障功能[16]。皮肤角质层的主要成分是脂质、角蛋白和水,在ATR-FTIR 中,脂质的特征吸收峰为vsCH2=2848.69cm-1及vasCH2=2918.12cm-1,反映脂质侧链自由度水平的指标可用CH2伸缩振动峰位移表示,波数位移的大小与CH2的偏转/全反构象体的比例有关[17]。角蛋白的特征吸收峰分为酰胺Ⅰ带(1639.39cm-1)及酰胺Ⅱ带(1544.89cm-1),代表蛋白质的二级结构α-螺旋及β-折叠[18],除此之外,角质层中OH的振动吸收峰为3278 cm-1。由图5可见,与对照组相比,实验组中皮肤角质层中脂质的CH2对称及不对称振动均向高波数发生移动,其中,EUG-C18 位移变化最大,除CH2振动吸收峰发生改变外,酰胺Ⅰ带的位移值也发生改变,均发生了蓝移现象,同时,角质层中OH的振动吸收峰也均向高波数发生移动。

图5 含或不含促透剂的皮肤ATR-FTIR光谱图
3.6 组织学评价
如图6 所示为在10 倍放大倍数下,含或不含促透剂的兔皮肤组织切片图像,图6a为对照组下的皮肤细胞形态,可清晰观察到角质层(角质层紧密排列在活性表皮上,角质层呈带状均匀分布)和附属器官,未观察到角质层脱落,且未见任何炎症细胞。经促透剂处理后的大耳兔皮肤组织切片可明显观察到角质层变薄,一些区域外层角质呈带状游离,并且在表皮区有空腔出现,表明挥发油及其酯改变了皮肤角质层有序致密结构,使其变得疏松,从而降低了皮肤的屏障作用。组织学切片结果表明促透剂仅会对皮肤产生的轻微的刺激性,并不会对皮肤细胞产生毒性。
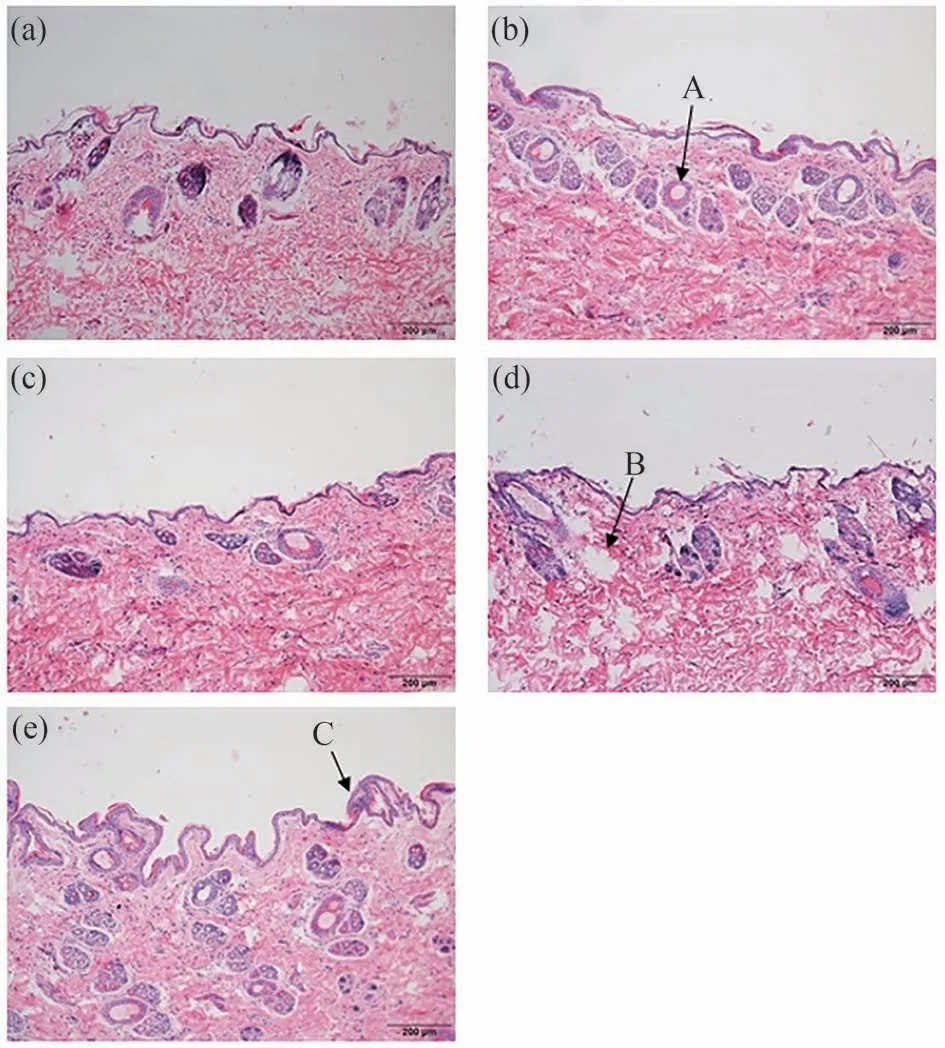
图6 含或不含促透剂的兔皮肤组织学切片
4 讨论
促透剂的作用机制主要是通过可逆性改变皮肤角质层结构来增加药物的经皮渗透量。近年来对挥发油类促透剂的研究显示,其作用于皮肤后可不同程度地改变皮肤的生理结构,增加其通透性且刺激性较小。但因其易挥发,不利于制剂的质量控制,限制了在经皮给药制剂中的应用。本文参考课题组之前的研究,选取了芳香族两种典型的挥发油醇酚成分,即肉桂醇和丁香酚,结合前期研究发现肉桂醇可以与皮肤中的神经酰胺产生更强的氢键作用,其促透能力强于肉桂醛,同时肉桂醛在透皮吸收时会转化为肉桂醇[5],因而本文选用肉桂醇;且因贴剂在制备过程中需加热,肉桂挥发油、丁香挥发油作为促透剂稳定性较差[19-20],本文对其结构进行酯化改造,以期改善挥发性且提高促透活性,同时不会增加其皮肤刺激性,并探究了酯类衍生物对FP的促透效果及作用机制。
体外经皮促透实验表明,挥发油对FP具有一定的促透活性,这表明丁香酚可通过影响皮肤角质层的角蛋白构象来增加其流动性从而发挥经皮促透作用;而肉桂醇可通过扰乱脂质侧链的有序排列使细胞间隙增大,增加药物经皮渗透量。同时研究表明挥发油酯的促透活性优于挥发油组,这表明脂肪酸酯可通过干扰脂质双分子层侧链的空间排列顺序来提高药物的经皮渗透量并缩短时滞[21]。组织学切片显示,在加入挥发油酯后有轻微水肿现象出现,但并未对皮肤活性造成影响,且在短时间内可以恢复,这表明其刺激性低。
体外释放研究表明,所有促透剂均可增加药物释放,而EUG-C18、CIN-C18 比EUG、CIN 更容易使药物释放。这可能是由于促透剂可以通过形成自由体积的填充剂来减少药物与压敏胶的相互作用,从而促进药物释放[22],而成酯后因其更容易占据压敏胶中氢键而形成位点,从而产生更多的自由药物分子,增加药物的释放。分子模拟结果表明促透剂与NP 混合后的氢键键能绝对值均显著高于FP-NP,可能是由于促透剂与神经酰胺结合后导致脂质结构被扰乱致使更多FP 游离而增加皮肤渗透量。ATR-FTIR 研究表明应用促透剂后SC脂质烷基侧链的自由度增大,分子间结合力减弱,角蛋白的二级结构可能受到促透剂的空间位阻效应而产生了挤压,使其排列发生变形,导致角蛋白分子间的空隙增加[23],同时二级结构的改变可能会造成角蛋白中的氢键网络发生断裂,扩张了角质细胞[24],OH振动吸收峰向高波数移动可能角质细胞含水量增加而膨胀有利于FP 的透过[25],无论是CH2的对称及不对称吸收峰、酰胺I 带及OH 振动吸收峰,EUGC18 显示了最大的位移变化,这为其具有最优促透能力提供了合理的解释。
综上所述,来源于芳香族挥发油的EUG 及CIN 均可增加FP的经皮渗透量,结构改造后的酯类衍生物通过促进FP 从压敏胶中的释放、影响SC 中角蛋白的构象及扰乱脂质侧链顺序来增加FP的经皮渗透。其中,EUG-C18 具有较好的经皮促透活性和较低的皮肤刺激性,值得进一步深入研究。

