丹酚酸B对肝癌H22小鼠TLR4/MyD88/NF-κB通路及肠道细菌的影响*
田 力,万端静,温扬敏**
(1. 泉州医学高等专科学校基础医学部 泉州 362000;2. 泉州市中医院 泉州 362000)
肝癌是世界最常见的恶性肿瘤之一,《2020 年世界癌症报告》显示,全球肝癌死亡人数超过83万,在全球癌症死亡人数中排名第三[1]。我国是肝癌高发区,2020 年有超过41 万人新患肝癌,超过39 万人死于肝癌,肝癌已成为导致全民死亡的第二大癌症,不仅严重威胁我国居民的健康,也对家庭和社会造成沉重的经济负担[2]。随着肿瘤的手术及放化疗技术的进步,虽然肝癌患者生存时间明显延长,但肿瘤的复发和转移以及化疗药物所产生的副作用一直是肝癌治疗的两大难题,因此从植物中发现有效且副作用小的抗肿瘤天然产物是人类获得药物的重要途径。
丹参(Salvia miltiorrhizaBge.)为唇形科植物丹参的干燥根及根茎,其性微寒、味苦,入心、肝经,具有活血祛痕、通经止痛、清心除烦、凉血消痈的功效,具有抗氧化、抗菌、抗炎、改善微循环、镇痛、抗心脑血管疾病等药理活性[3]。丹酚酸B(Salvianolic acid B,Sal B)由3 分子丹参素与1 分子咖啡酸聚合而成,是丹参水溶性有效成分丹酚酸中含量最高、活性最强的一种成分,是丹参的主要活性成分之一[4]。丹酚酸B对乳腺癌细胞、口腔鳞状癌细胞、鼻咽癌细胞、肝癌细胞和肺癌细胞等具有体外生长抑制作用,但其抗肿瘤的分子机制尚不清楚[5]。研究显示,丹酚酸B 能通过抑制TLR4/MyD88/NF-κB 信号通路减轻小鼠急性肝损伤的作用[6],而TLR4/MyD88/NF-κB 信号通路是广泛存在于各种细胞中参与炎症反应的关键通路,是介导肿瘤发生的重要调控机制[7]。此外,研究发现肠道菌群作为人体微生态的重要组成部分,可通过肠与肝脏的交互循环形成肝-肠轴调控参与人体内一系列重要的生理和病理过程[8]。肠道菌群失调可导致胆汁酸代谢异常、内毒素释放、肠道稳态破坏、模式识别受体激活等直接或间接促进肝癌的发展[9]。研究发现丹酚酸B 能影响肠道菌群的构成,增加肠道有益菌的相对丰度,减少有害菌相对丰度,改善肠道环境[10]。因此,本研究探讨丹酚酸B 对肝癌H22 小鼠TLR4/MyD88/NF-κB 通路及肠道菌群的影响,为阐明丹酚酸B 抗肿瘤的作用机制以及临床合理用药提供科学依据。
1 材料与方法
1.1 动物与药物
50只SPF级KM小鼠,体质量(20±3)g,购于北京维通利华实验动物技术有限公司,动物合格证编号:20210616Abzz0600000710。饲养于泉州医学高等专科学校SPF级动物实验室(SYXK(闽)2016-0001),温度控制在22-25℃,昼夜12 h自动切换。丹酚酸B:购自成都麦德生科技有限公司,纯度98%,批号:RP200120,丹参提取物,用于医药、化妆品;环磷酰胺(cyclophosphamide,CTX):购自上海麦克林生化科技公司,纯度98%。
1.2 H22肝癌细胞株
H22肝癌细胞株购自于北京天呈生物科技公司。
1.3 主要试剂
DMSO、RPMI-1640 培养基、小牛血清、胰蛋白酶消化液、细胞裂解液,赛默飞世尔科技公司;二甲苯、盐酸、双氧水、无水乙醇,西陇科学有限公司;RNA 提取试剂盒TransZolUp Plus RNA Kit、反转录试剂盒TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix、6 × Protein Loading Buffer,北京全式金有限公司;PCR 试剂盒Genious 2X SYBR Green Fast qPCR Mix、彩色预染蛋白marker、HRP 标记羊抗兔IgG、HRP 标记羊抗鼠IgG、髓样分化因子(Myeloid differentiation factor 88,MyD88)抗体(兔来源)、核转录因子NF-κB p65(Nuclear transcription factor-κB,NFκB p65)抗体(鼠来源)、Toll 样受体4(toll-like receptor 4,TLR4)抗体(兔来源)、Actin 抗体(鼠来源)、Genious 2X SYBR Green Fast qPCR Mix,武汉爱博泰克生物科技有限公司;RIPA 裂解液,SDS-PAGE 凝胶配制试剂盒、PMSF 蛋白酶抑制剂,碧云天生物技术公司;PVDF膜,Millipore公司。
1.4 主要仪器
病理切片机(KD-2258)、摊片机(KD-P)、组织包埋机(KD-BM),金华科迪有限公司;电泳仪(1645050)、电泳槽(16580001)、小型转印槽(1703930),美国伯乐公司;显微镜(OLYMPUS CK31),日本奥林巴斯;微量紫外-可见光分光光度计(NanoDrop One)、荧光定量PCR 仪(ABI QuantStudio 3)、全波长酶标仪(SPECTRO Star),赛默飞世尔科技公司;荧光发光成像仪(6100),上海勤翔科学仪器有限公司。
1.5 小鼠H22肝癌移植瘤模型的建立
参照文献方法[11],用含10%胎牛血清的RPMI-1640培养液,于5% CO2、37℃饱和湿度条件下,在细胞培养箱中培养小鼠H22 肝癌细胞株。小鼠腹腔接种H22肝癌细胞,选择腹腔接种6-8 天、生长良好荷瘤小鼠,处死并无菌抽取腹水,用生理盐水稀释制成1×107·mL-1肝癌细胞混悬液,每只小鼠皮下接种0.2 mL肝癌细胞混悬液。
1.6 小鼠的分组与给药
将H22 肝癌移植瘤小鼠随机分成4 组,每组10只,分别为模型组:每天灌胃等体积(0.2 mL)生理盐水;CTX 阳性对照组:每天灌胃等体积(0.2 mL)的环磷酰胺(20 mg·kg-1);丹酚酸B中、高剂量组:分别每天灌胃等体积(0.2 mL)50、100 mg·kg-1的丹酚酸B;此外,另设一组正常对照组:10只正常小鼠每天灌胃等体积(0.2 mL)生理盐水,每天给药1次,连续15天。末次给药24 h 后,收集粪便,称体质量,处死小鼠,解剖瘤组织并称重,计算抑制率。
肿瘤抑制率=(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重×100%;
1.7 小鼠肿瘤组织病理变化观察
取小鼠肿瘤组织,用10%甲醛固定,进行石蜡切片和苏木精-伊红(Hematoxylin-eosin staining,HE)染色,观察肿瘤组织病理变化。
1.8 实时定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,RT-qPCR)法检测肿瘤组织TLR4、MyD88、NF-κB的mRNA表达
取肿瘤组织,加入液氮预冷的研钵,研磨组织至粉末状,取约100 mg 样品加到离心管中,再根据TransZol Up Plus RNA Kit 说明书提取总RNA。以RNA为模板,按TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix 的说明书合成cDNA。反应体系(20 uL):Total RNA 1 µL,2 × TS Reaction Mix 10µL,TransScript®RT/RI Enzyme Mix 1 µL,gDNA Remover 1 µL,Olig (dT) Primer 1 µL,Random Primer 1 µL,ddH2O 6µL。42℃孵育15 min,85℃灭活5 s,得到cDNA,-20℃保存。
将稀释5 倍的cDNA 作为qPCR 的模板,Genious 2X SYBR Green Fast qPCR Mix 说明书配制qPCR 反应液,总反应体系20 µL:Template 2 µL,Forward Prime 0.4 µL,Reverse Primer 0.4 µL,Genious 2X SYBR Green Fast qPCR Mix 10 µL,Dye(II) 0.4 µL,ddH2O 6.8 µL。反应条件:95℃ 3 min,94℃ 35 s、60℃ 35 s、72℃ 50 s,共35 个循环,采用2-ΔΔCt法对基因的表达进行数据分析。实验设置3个重复,引物序列见表1。

表1 引物序列
1.9 蛋白免疫印迹(Western Blot)法检测肿瘤组织TLR4、MyD88、NF-κB的蛋白表达
取肿瘤组织剪碎后冰上研磨,按照每20 mg 肿瘤组织加入100 µL裂解液的比例加入裂解液,研磨至裂解液中组织块消失,离心取上清,测定蛋白浓度,经10%的SDS-PAGE 电泳分离后,电转至0.45 µm 的PVDF 膜,放入5%BSA 室温封闭2 h,分别加入一抗MyD88(1∶1000)、NF-κB p65(1∶1000)、TLR4(1∶1000)和Actin(1∶2500),4℃孵育过夜,加入辣根过氧化物酶(HRP)标记的羊抗小鼠二抗(1∶2000)室温孵育2 h后,TBST 洗膜15 min×5 次。加入化学发光检测试剂反应1 min,取出膜,甩去多余的液体,用保鲜膜包好PVDF膜,上机显色,以Actin为内参计算相对表达量。
1.1 0 肠道菌分析
分别从正常组、模型组和丹酚酸B 高剂量组随机选8 个样品,按试剂盒说明书提取DNA,合格DNA 样品送杭州联川生物公司进行16S rDNA 鉴定(16S ribosomal DNA identification),开展肠道菌群分析。首先通过筛选获得高质量的clean data。再构建独立细菌物种OUTs,基于OUTs 结果分析肠菌多样性,评价对小鼠肠道细菌结构。
2 数据处理
3 实验结果
3.1 丹酚酸B 对H22 肝癌移植瘤小鼠肿瘤生长和抑瘤率的影响
CTX 为最常见的广谱抗肿瘤药物,具有广泛的抗肿瘤活性,因此选择CTX 作为抗肿瘤阳性药物。实验结束后,模型组小鼠体质量与正常对照组之间不存在显著差异(P>0.05)。与模型组比较,除阳性对照组小鼠体质量显著降低之外(P<0.05),其它实验组小鼠体质量均差异不显著(P>0.05)。阳性对照组和丹酚酸B不同剂量组小鼠肿瘤质量均比模型组小鼠显著降低(P<0.05),显示对H22 肝癌移植瘤小鼠肿瘤生长均具有抑制效果,其中阳性对照组小鼠抑瘤率达90.3%,丹酚酸B 中剂量组和高剂量组小鼠抑瘤率分别为37.4%和47.1%。见表2。

表2 丹酚酸B对小鼠体质量及肿瘤生长的影响
3.2 小鼠肿瘤组织病理学改变
小鼠实体瘤细胞HE 染色后在显微镜下观察结果见图1,从图1可知,模型组小鼠肿瘤细胞分布均匀、核大、深染、坏死细胞少,而阳性对照组和丹酚酸B 各剂量组小鼠肿瘤细胞可见大量坏死的肿瘤细胞,细胞核碎裂、消失。显示丹酚酸B 对肿瘤细胞有明显的杀伤作用。
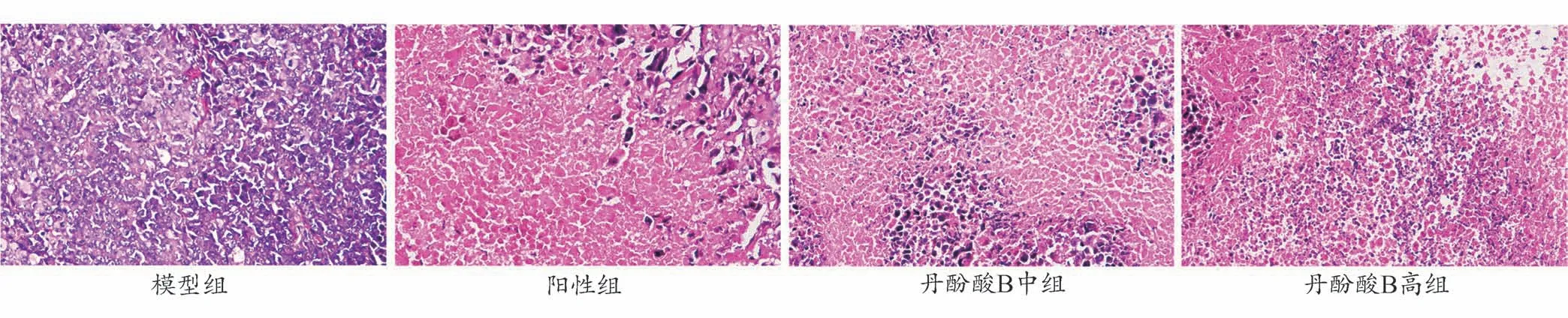
图1 小鼠实体瘤细胞形态HE染色结果
3.3 丹酚酸B 对TLR4、MyD88、NF-κB 的mRNA 表达的影响
TLR4/MyD88/NF-κB信号通路活化多发生于炎症和免疫反应。研究表明,CTX 具有免疫抑制等明显的毒副作用,能通过激活TLR4 信号通路,上调炎症因子、趋化因子及炎性介质表达[12]。本研究结果与以上结论相似,CTX 阳性对照组肿瘤组织TLR4、MyD88 和NF-κB 的mRNA 表达量比模型组上调(图2),其中MyD88 和NF-κB 的表达量差异显著(P<0.05)。与模型组比较,丹酚酸B 各剂量组小鼠肿瘤组织TLR4、MyD88和NF-κB的mRNA 表达量均下调,其中除丹酚酸B 中剂量组MyD88 的mRNA 表达量差异不显著外(P>0.05),其它实验组均存在显著差异(P<0.05)。与正常对照组比较,除丹酚酸B 高剂量组小鼠肿瘤组织TLR4的mRNA 表达差异不显著之外(P>0.05),其它实验组小鼠肿瘤组织MyD88、NF-κB 的mRNA 表达量均显著上调(P<0.05)。
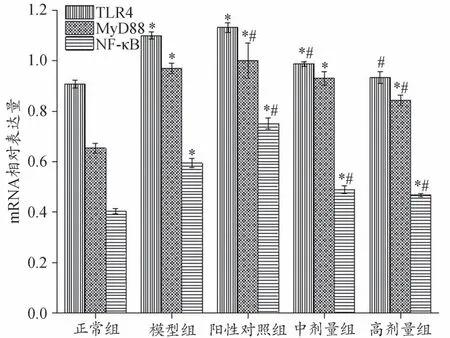
图2 丹酚酸B对TLR4、MyD88、NF-κB的mRNA表达的影响
3.4 丹酚酸B 对TLR4、MyD88、NF-κB 的蛋白表达的影响
小鼠瘤组织TLR4、MyD88、NF-κB 的蛋白表达量见图3。从图3 可以看出,与正常对照组比较,模型组小鼠肿瘤组织TLR4、MyD88、NF-κB 的蛋白表达量显著增加(P<0.05)。与模型组比较,丹酚酸B 中剂量组小鼠肿瘤组织TLR4、MyD88、NF-κB 的蛋白表达量有所下降,其中NF-κB 的表达量差异显著(P<0.05)。而丹酚酸B高剂量组小鼠肿瘤组织TLR4、MyD88、NF-κB的蛋白表达量均比模型组显著下降(P<0.05)。

图3 丹酚酸B对肿瘤组织TLR4、MyD88、NF-κB蛋白表达的影响
3.5 丹酚酸B 对H22 肝癌移植瘤小鼠肠道细菌的影响
3.5.1 丹酚酸B对H22肝癌移植瘤小鼠肠道细菌多样性的影响
Alpha 多样性反映一个特定环境物种丰富度和均匀度。丹酚酸B 对H22 肝癌移植瘤小鼠肠道细菌Alpha多样性指数影响见图4A。从图4A 可以看出,模型组小鼠Chao1、Shannon和Simpson等Alpha多样性指数均比正常对照组降低,其中除Simpson 指数外,其它Alpha 多样性指数均与正常对照组差异显著(P<0.05),显示肿瘤小鼠细菌Alpha 多样性降低。与模型组比较,丹酚酸B 高剂量组小鼠肠道细菌Alpha 多样性指数均不存在显著差异(P>0.05),显示丹酚酸B 对肿瘤小鼠肠道细菌Alpha多样性无显著影响。

图4 肠道细菌Alpha多样性指数和主成分分析
Beta 多样性是指不同环境群落之间的物种差异性,PCA(Principal component analysis)图中的距离越接近表明物种组成越相似。实验结果显示(图4B),与正常对照组比较,模型组小鼠肠道细菌Beta 多样性差异显著(P=0.001,R=0.8661),显示肿瘤能显著影响肠道菌群组成结构。与模型组比较,丹酚酸B 高剂量组小鼠肠道菌群Beta 多样性差异显著(P=0.001,R=0.4163),表明丹酚酸B 能改善肿瘤引起的肠道菌群改变。
3.5.2 丹酚酸B对H22肝癌移植瘤小鼠肠道细菌组成的影响
为分析不同样本小鼠肠道细菌群落组成,对样品门水平和科水平物种丰度进行统计(图5)。在门水平,小鼠肠道细菌主要有拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)等优势菌群组成(图5A)。从图5A 可以看出,模型组小鼠肠道细菌拟杆菌门和髌骨菌门(Patescibacteria)等相对丰度比正常对照组小鼠降低,其中拟杆菌门相对丰度差异显著(P<0.05);而厚壁菌门、变形菌门和脱铁杆菌门(Deferribacteres)等相对丰度比正常对照组小鼠增加,其中厚壁菌门和变形菌门相对丰度差异显著(P<0.05)。与模型组比较,丹酚酸B 高剂量组小鼠肠道细菌拟杆菌门相对丰度显著增加(P<0.05),而厚壁菌门相对丰度显著降低(P<0.05)。

图5 门水平和科水平微生物种类分布图
在科水平,3组样品中共包括60个科,其中主要有Muribaculaceae 科、毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)、理研菌科(Rikenellaceae)、乳杆菌科(Lactobacillaceae)等细菌组成(图5B)。从图5B 可以看出,模型组小鼠肠道Muribaculaceae 科细菌显著增加(P<0.05),而瘤胃菌科和毛螺菌科等细菌显著减少(P<0.05)。与模型组比较,丹酚酸B 高剂量组小鼠Muribaculaceae 科细菌显著减少(P<0.05),而瘤胃菌科和毛螺菌科等细菌显著增加(P<0.05)。结果显示,丹酚酸B 使小鼠肠道菌群在门水平和科水平比例和分布更加接近于正常对照组,表明丹酚酸B 对肿瘤引起的小鼠肠道菌群紊乱具有一定的调节作用。
4 讨论
肝细胞癌是最常见的恶性肿瘤之一,目前手术切除仍是肝癌治疗的首选手段,但肝癌手术治疗后5年生存率仍不理想,而且肝癌初诊可切除率仅为20%-30%,化疗是目前肝癌患者的主要治疗方案[13]。化疗药物在杀死肿瘤细胞的同时损伤肿瘤患者机体免疫功能,显著增大术后肿瘤病死率和复发率的风险。因此,改善患者的免疫功能状态是降低术后病死率和复发率的关键[14]。丹酚酸B是丹参中的主要有效成分之一,可通过提高机体免疫力、调控细胞周期、抑制细胞增殖、诱导细胞凋亡等发挥抗肿瘤作用[15]。但目前关于丹酚酸B的抗肝癌研究主要集中在对体外培养肝癌细胞的抑制作用[16-17],而关于丹酚酸B 对肝癌动物模型研究较少。本实验结果显示,不同剂量丹酚酸B 处理实验组小鼠肿瘤质量均比模型组小鼠显著下降(P<0.05),丹酚酸B中剂量组和高剂量组小鼠抑瘤率分别为37.4%和47.1%。小鼠实体瘤细胞HE染色结果显示不同剂量丹酚酸B 均对肿瘤细胞有明显的杀伤作用。结果表明,丹酚酸B对H22肝癌小鼠具有明显的抗肿瘤效果。
近年来研究表明,丹酚酸B 的抗肿瘤作用可能与调节机体免疫力有关[18]。TLR4信号通路与恶性肿瘤细胞增殖和迁移有密切相关性,在肿瘤形成发挥重要作用[19]。研究表明,肝癌细胞中TLR4信号通路的激活将引起免疫抑制因子的增加,使肝癌细胞发生增殖和免疫逃逸,从而促进肝癌细胞的迁移和转移[19]。汪红等[20]研究显示,丹酚酸B 可通过抑制TLR4/NF-κB 信号通信号通路,降低急性脑缺血小鼠炎症因子IL-lβ 和TNF-α 的含量,发挥抗脑缺血的作用。张云等[21]研究发现,丹酚酸B 通过抑制TLR4/NF-κB/TNFα 炎症通路保护缺氧培养的体外心肌细胞炎症损伤。推测丹酚酸B 可能通过调节TLR4信号通路提高肝癌小鼠免疫功能,从而达到抗肿瘤效果。因此,本实验建立H22肝癌实体瘤小鼠模型,以TLR4/MyD88/NF-κB 信号通路为切入点探究丹酚酸B的抗肿瘤作用机制。结果显示,模型组小鼠肿瘤组织TLR4、MyD88、NF-κB 的mRNA和蛋白表达量均比正常对照组小鼠显示显著上调(P<0.05)。而与模型组比较,不同剂量组丹酚酸B处理小鼠肿瘤组织TLR4、MyD88、NF-κB 的mRNA 和蛋白表达量均有所下调,其中丹酚酸B 高剂量组mRNA 和蛋白表达量均与模型组差异显著(P<0.05),其结果与既往研究结论一致,表明丹酚酸B 对H22 肝癌小鼠的抗肿瘤作用可能与抑制TLR4/MyD88/NFκB信号通路活化有关。
随着对肠道菌群及其与疾病之间的相关性研究的逐步深入,肠道菌群在疾病的发生发展过程中发挥的重要作用越来越受到关注[22]。研究表明,肠道菌群作为肝-肠轴的重要组成部分,在肠道与肝脏的相互作用中发挥着关联作用[23]。Jia等[24]从蛋白表达角度研究肠道菌群与肝脏疾病的发生关系,结果表明,清除小鼠肠道菌群1 周后,肝脏中有324 种蛋白表达出现差异,小鼠对肝损伤的敏感性降低。Chen 等[25]研究表明,肠道菌群合成的LPS 可通过调节TLR4等多种信号通路,诱导TNF-α 等免疫因子的释放,影响肝脏微环境,导致肝癌的发生。本实验结果显示,与正常对照小鼠比较,肿瘤能引起小鼠肠道细菌群落结构发生改变,而丹酚酸B能改善肿瘤引起的肠道菌群改变,使小鼠肠道细菌的群落结构更加接近于正常对照组,表明丹酚酸B 能增加肠道有益菌的相对丰度,减少有害菌相对丰度,改善肠道环境。关于丹酚酸B 的抗肿瘤作用是否与影响肠道菌群有关,以及相关机制有待进一步研究。

