基于IL-6、IL-8、TNF-α和COX-2表达探讨通脉化癥汤抑制AM模型小鼠炎性反应的研究*
张毅然,石雅馨,张科科,宁 婕,李雅琳,姚 巍,师 伟**
(1. 山东中医药大学中医学院 济南 250014;2. 山东中医药大学第一临床医学院 济南 250014;3. 山东中医药大学附属医院 济南 250011)
子宫腺肌病(Adenomyosis,AM)是指具有活性的子宫内膜组织(腺体和间质)在子宫肌层内出现,引起子宫肌层增生或肥厚,从而形成以痛经、月经异常为主要症状,子宫体积增大,弥漫性或局限性病灶为主要体征的一类疾病[1]。AM 虽不属于妇科恶性疾病,但其病灶具有增殖、迁移与侵袭等肿瘤细胞的特性。目前认为其发病机制多与子宫内膜基底部内陷及组织损伤修复、苗勒管遗迹化生及成体干细胞分化、炎症刺激和上皮—间质转化等密切相关,但尚无确切发病机制[2]。继发性痛经、月经异常、不孕等症状严重危害女性的生活和工作[3]。当针对AM 的常规治疗手段分为介入治疗、西药治疗及手术治疗,但介入治疗效果还存在诸多争议,西药治疗常伴随明显副作用,而手术治疗则不能满足有生育计划妇女的治疗需求[4]。中医药以其治疗方法多样、综合疗效显著、副作用少等特点,近年来被广泛应用于AM 的治疗中,《子宫腺肌病诊治中国专家共识》指出中医中药对于缓解AM 所致的痛经疗效确切[5]。
研究证实,AM 所致的痛经、月经异常和不孕与多种炎症因子及炎症刺激密切相关[2]。肿瘤坏死因子α(TNF-α)、环氧合酶2(COX-2)、白细胞介素6(IL-6)、白细胞介素8(IL-8)等作为主要炎症因子参与其中[6]。为了探究通脉化癥汤对AM 炎症刺激的抑制作用,通过建立AM 小鼠模型,采用HE 染色法、蛋白免疫印迹法(Western Blot)、免疫组化法、酶联免疫吸附法(ELISA)等方法评价小鼠模型构建情况及通脉化癥汤对TNF-α、COX-2、IL-6、IL-8 等炎症因子的调控作用,以探求AM 发病机制及治疗靶点,为临床针对性地指导AM用药提供借鉴。
1 实验材料
1.1 实验动物
随机选取出生2 日的SPF 级雌性ICR 小鼠70 只,皆由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2016-0006。实验动物饲养于山东中医药大学附属医院SPF 级动物实验中心,室内温度控制在(22.6±0.4)℃,相对湿度60%-65%,2-21 天由母鼠喂养,22 日分笼,自由摄食摄水。本研究已获山东中医药大学附属医院伦理委员会批准(AWE-2021-83)。
1.2 实验药品
药物组成如下:桂枝15 g、重楼12 g、赤芍15 g、牡丹皮15 g、炒桃仁15 g、天花粉15 g、血竭2 g、醋五灵脂9 g、茯苓15 g、土鳖虫9 g、牡蛎30 g、醋鳖甲15 g、醋没药6 g、皂角刺15 g、黄芪18 g、蜜麻黄3 g、炙甘草6 g,均来自于山东中医药大学附属医院。
孕三烯酮(每粒2.5 mg),华润紫竹药业有限公司生产(批号53200201);枸橼酸他莫昔芬(每片10 mg),由山东健康药业有限公司生产(批号H37022925)。
1.3 实验试剂
Mouse Interleukin 6(IL-6) ELISA 试剂盒(基因美,货号:JYM0012Mo)、Mouse Interleukin 8(IL-8) ELISA试剂盒(基因美,货号:JYM0457Mo)、COX2 Monoclonal Antibody(Proteintech,货号:66351-1-Ig)、Rabbit Anti-TNF alpha antibody(博奥森,货号:bs-0078R)、Goat Anti-Rabbit IgG (H+L) HRP(思科捷,货号:EF0002)和Goat Anti-Mouse IgG (H+L) HRP(思科捷,货号:EF0001)。
1.4 实验器械及仪器
1.4.1 实验器械
止血钳、组织剪、眼科剪、眼科镊、一次性注射器、无菌棉球、无菌纱布等皆为山东中医药大学附属医院提供。
1.4.2 实验仪器
BCS-6-SN 电子秤(China,佰伦斯);ST8 型低速离心机(USA,Thermo Scientific);5424R 高速低温离心机(Germany,Eppendorf);Multiskan Go1510 酶标仪(USA,Thermo);ZNCL-BS 磁力搅拌器(China,上海一科),Trans-Blot Turbo 转膜仪(USA,Bio-Rad);病理组织漂烘仪(常州派斯杰医疗设备有限公司);轮转式切片机(徕卡);免疫组化笔(Vector);Powerpac 通用电泳仪(USA,Bio-rad),Innotech Fluor Chem Q 成像分析系统(USA,Alpha)等。
2 实验方法及分析
2.1 建立动物模型
使用枸橼酸他莫昔芬诱导建立AM 小鼠模型[7],按照2:1 的比例将雌鼠与雄鼠进行原则随机交配,在小鼠出生后第2-5天(出生日为第1日),滴喂5 µL·g-1的花生油、卵磷脂和炼乳的混合液(体积比2∶0.2∶3),并按小鼠体质量加入2.7 µmol·kg-1的他莫西芬,1-21 日龄均由母鼠哺乳饲养,22日龄起与母鼠分笼。选择雌性小鼠常规饲养75 天后,随机选取10 只小鼠取子宫组织,见子宫组织明显扭曲变形增粗,表面可见多个突出结节。即用4%甲醛固定,石蜡包埋后选5个以上横断面切片,采用HE 染色法染色后置于光镜下观察,子宫内膜结构紊乱,腺体及间质细胞侵入子宫肌层,证明造模成功。
2.2 分组及给药
将造模成功的50只小鼠随机分为模型组、通脉化癥汤低剂量组(临床1/2倍等效用量)、通脉化癥汤中剂量组(临床等效用量)、通脉化癥汤高剂量组(临床2倍等效用量)、孕三烯酮组;另设空白组,每组各10只。
按照人和动物间按体表面积折算的等效剂量公式,将通脉化癥汤临床等效剂量换算成小鼠每日用药量。将方中所有药材加入1 L 蒸馏水浸泡0.5 h 后,煎煮1.5 h,过滤后得到滤液,煎煮两次,合并滤液,浓缩至6.82 g·mL-(1生药量)。
(1)空白组:10只,予蒸馏水灌胃,0.2 mL·20 g-1体重,每日1次,不予特殊处理。
(2)模型组:10只,予蒸馏水灌胃,0.2 mL·20 g-1体重,每日1次,不予特殊处理。
(3)通脉化癥汤低剂量组:10 只,将药物浓度用蒸馏水稀释为1.71 g·mL-1,小鼠给药量为13.6 g·kg-1,每日予0.2 mL·20 g-1体重中药灌胃。
(4)通脉化癥汤中剂量组:10 只,将药物浓度用蒸馏水稀释为3.41 g·mL-1,小鼠给药量为27.2 g·kg-1,每日予0.2 mL·20 g-1体重中药灌胃。
(5)通脉化癥汤高剂量组:10 只,药物浓度为6.82 g·mL-1,小鼠给药量为 54.4 g·kg-1,每日予0.2 mL·20 g-1体重中药灌胃。
(6)孕三烯酮组:10 只,根据临床等效剂量,将孕三烯酮胶囊用蒸馏水配置成0.026 mg·mL-1的水溶液,小鼠给药浓度为0.32 mg·kg-1,每周两次予0.2 mL·20 g-1体重的药液灌胃。
2.3 动物组织取材过程
小鼠给药干预2个月后,于末次灌胃12 h后禁食,取材前2 h 禁水。消毒麻醉后,逐层打开腹腔,行腹主静脉穿刺取血后于促凝管中,室温静置20 min 后离心取血清,保存于-80℃用于后续ELISA 检测;分离双侧子宫,部分置于4%多聚甲醛溶液中进行固定,以备后续HE 染色及免疫组化实验;另一部分置于-80℃冰箱用于后续的Western Blot实验。
2.4 检测方法
2.4.1 HE染色
4%甲醛固定标本48 h→石蜡包埋切片(切片厚度为4 µm)→60℃加热60 min→二甲苯透明→乙醇脱蜡水化(乙醇浓度逐级降低)→苏木素染色后→光学显微镜下观察→伊红染色→乙醇脱水(乙醇浓度逐渐升高)→二甲苯透明→中性树胶封片。
2.4.2 免疫组织化学分析
4%甲醛固定标本48 h→石蜡包埋切片(切片厚度为4 µm)→60℃加热60 min→二甲苯透明→乙醇脱蜡水化(乙醇浓度逐级降低)→柠檬酸钠抗原修复(高压锅内修复液提前15 min 左右煮沸备用,注意防止组织干片)→内源性过氧化物酶去除(覆盖组织后室温孵育20 min)→封闭(约45 min)→孵育一抗(4℃过夜)→孵育二抗30 min(孵育二抗前可滴加反应增强液)→DAB 显色液显色(现用现配,冲洗切片终止显色)→苏木素复染→乙醇脱水(乙醇浓度逐级升高)→二甲苯透明→晾干后中性树胶封片→用CellSensStandard 进行图像采集。
2.4.3 Western Blot检测
按比例混合胶水灌胶→预电泳→上样→一阶电泳→二阶电泳→制造低温环境→切胶→裁膜→转膜→封闭→一抗孵育过夜→二抗孵育→显影。
2.4.4 ELISA检测
腹主静脉穿刺取血后置于促凝管内室温静置20 min后离心取血清,按照ELISA说明书检测指标:包被→加入样品→加入酶标抗体→使用底物液显色→终止反应→结果判定,于酶标仪上在450 nm 条件下检测OD值。
2.5 评价标准
2.5.1 HE染色
该方法主要检验AM 成模与否,若HE染色显示子宫内膜结构紊乱,腺体及间质细胞侵入子宫肌层,则证实造模成功。随机选取造模后两只小鼠的子宫,立即用4%甲醛固定,石蜡包埋后选5 个以上横断面切片,采用HE 染色法染色后置于光镜下观察。按子宫内膜腺体与间质侵人子宫肌层的程度进行分级,即在100 倍光学显微镜下进行子宫内膜腺体与间质细胞计数同时测量浸润深度,并按5 级标准分级量化评分以评估AM 的严重程度,具体分级方法:①正常子宫为0 级,评0 分;②子宫内膜间质细胞侵入肌肉内层为1 级,评1 分;③子宫内膜问质与腺体侵入肌肉内层为2 级,评2 分;④子宫内膜间质与腺体侵人内外肌层结合带为3 级,评3 分;⑤子宫内膜腺体囊性增生且浆膜层下出现结节为4级,评4分(Morit分级法),以此作为AM动物模型成功建立与否的标准。
2.5.2 免疫组织化学分析
采用Image Pro Plus 6.0 图像分析软件对各组3 个不同区域的图片进行分析,通过测量被覆上皮面积(Aera)与该面积中阳性表达的积分光密度(IOD),得到平均积分光密度(平均积分光密度=IOD/Area),平均积分光密度越大,表示阳性表达程度越高。
2.5.3 ELISA检测
以酶标仪检测所得OD值为最终记录标准。
2.5.4 Western blot检测
采用Image J 图像分析软件对Western blot 的3 次不同结果进行灰度值分析,以所对应的内参GAPDH作为标准,进行数据校准。
2.6 数据统计
采用SPSS 21.0 和GraphPad Prism 9.0 统计软件进行分析及作图,计量资料采用均值±标准差()形式表示,符合正态分布的多组之间比较采用单因素方差分析(One-Way ANOVO),不符合正态分布的多组之间比较采用Kruskal-Wallis H 秩和检验,以P<0.05 表示差异具有统计学意义。
3 实验结果
本研究灌胃干预过程中,因操作不当共死亡小鼠11 只,存活49 只,为减少组间样本数差异引起的实验误差,各组选取5只小鼠进行实验。
3.1 造模情况
实验开始前随机选取空白模型组各1只小鼠检验造模结果,由图1可见,造模后的小鼠子宫组织明显扭曲变形,表面可见多个突出结节。而造模前的小鼠子宫组织光滑平整流畅,未见变形,表面未见突出结节(见图1)。

图1 小鼠子宫造模情况
3.2 HE染色结果
小鼠分组情况对评分医师置盲后由2名病理科医师独立对HE 染色切片进行评分(见图2 和图3),正态性检验后结果提示HE 染色评分服从非正态分布(shapiro-wilk test=0.81,P<0.001),各组评分以中位数(百分位数P25-百分位数P75)展示。结果如下(见表1):药物治疗组HE评分相较于模型组HE评分显著下降(Wilcoxon test: W=148.00,P=0.005)。

表1 HE染色评分结果

图3 小鼠子宫横切面HE染色图(400×)
3.3 COX-2、TNF-α免疫组化结果
图4 可见,模型组COX-2 的表达显著高于空白组(P<0.05)。与模型组比较,低、中、高剂量组和孕三烯酮组显著降低,差异具有统计学意义(P<0.05);与低、中剂量组比较,高剂量组与孕三烯酮组有显著性差异(P<0.05)。此外,高剂量组与孕三烯酮组差异无统计学意义(P>0.05)。

图4 COX-2免疫组化结果比较
图5 可见,模型组TNF-α 表达显著高于空白组(P<0.05);与模型组比较,低、中、高剂量组及孕三烯酮组表达程度显著降低(P<0.05),高剂量组及孕三烯酮组较低中剂量组下调作用明显,差异均具有统计学意义(P<0.05),高剂量组与孕三烯酮组差异无统计学意义(P>0.05)。
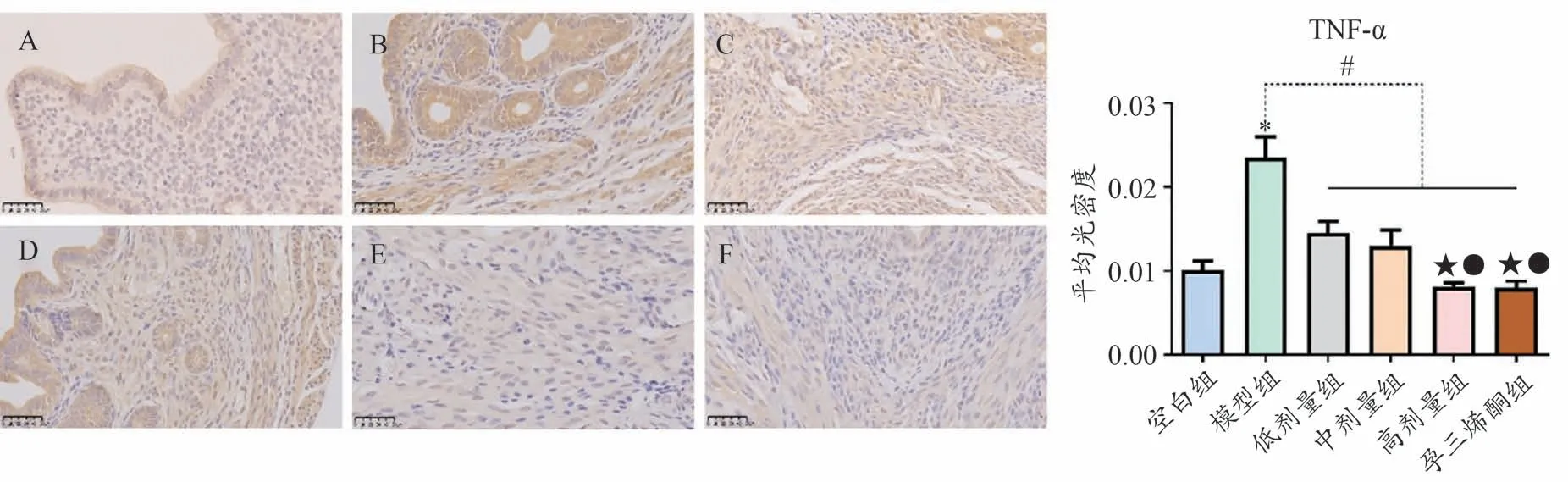
图5 TNF-α免疫组化结果比较
3.4 COX-2和TNF-α的Western Blot结果
图6 可见,模型组COX-2、TNF-α 表达较空白组明显升高(P<0.05),低、中、高剂量组和孕三烯酮组较模型组明显降低(P<0.05);高剂量组和孕三烯酮组较低、中剂量组存在统计学差异(P<0.05),高剂量组和孕三烯酮组无明显统计学差异(P>0.05)。

图6 各组小鼠COX-2、TNF-α Western Blot结果
3.5 IL-6、IL-8的血清ELISA结果
由图7 可见,与空白组对比,模型组血清IL-6、IL-8 表达水平明显升高(P<0.05);与模型组对比,低、中、高剂量组及孕三烯酮组均明显下降,差异具有统计学意义(P<0.05);但各治疗组间无明显统计学差异(P>0.05)。

图7 各组小鼠血清IL-6、IL-8血清ELISA结果
4 讨论
AM 属中医学“癥瘕”“痛经”“月经量多”“经期延长”范畴,临床常表现为渐进性加重的痛经、月经异常和不孕等症状,伴随子宫体积增大、压痛等体征。中医病因病机主要认为其与“瘀血内停”有关,因气机阻滞、脉络不通而致。2020 年《子宫腺肌病中国专家诊疗共识》推荐使用中药治疗AM 所致的痛经[5]。针对“瘀血内停”这一病机,以桂枝茯苓丸、宫血宁胶囊(重楼)为主方,融入土瓜根散、夺命丹等方义合而成方,形成以桂枝、重楼为核心的具有通脉活血、化瘀消癥功效的通脉化癥汤,且临床研究已证实以该方为核心的AM中医综合诊疗方案疗效确切[8]。
目前西医关于AM 的发病机制尚未明确,前期对AM异位内膜和在位内膜病灶进行单细胞RNA测序分析发现,AM 异位内膜存在炎症刺激、细胞运动、细胞增殖等通路和模块的富集[9]。研究证实,AM 所致的痛经、月经异常和不孕与多种炎症因子及炎症刺激密切相关[2]。IL-6、IL-8、IL-1β、TNF-α、COX-2 作为主要炎症因子参与其中[7]。TNF-α 是由巨噬细胞分泌的介导机体炎症反应、免疫调节相关的细胞因子,可作为NF-κB 的诱导剂诱导NF-κB 通路的激活,从而促进AM 基质细胞中COX-2、VEGF、转录因子(TF)等表达的增加,介导体内的炎症反应、血管生成等活动。COX-2 作为编码催化前列腺素E2(PGE2)的限速酶的因子,催化花生四烯酸生成前列腺素(PGs)和PGE2,PEG2 诱导P450 的合成,进而促使局部雌二醇(E2)的合成与活化,其反过来又诱导COX-2 的进一步生成,循环形成恶性循环,加重子宫腺肌症炎症反应,增强细胞增殖、侵袭活动,是子宫腺肌症患者痛经、月经异常的主要原因之一[10]。IL-6 和IL-8 作为主要细胞炎症因子,参与AM 的发生发展进程中,IL-6可调节体内巨噬细胞的活性,促进机体的炎症及免疫反应,又通过正反馈于AM 异位病灶,加剧其生长[11]。研究表明,AM 异位病灶中IL-6 水平明显高于对照组,且与巨噬细胞共培养后,IL-6 mRNA 水平增加[12]。Luo等[13]发现Toll 样受体通过激活p38/ERK 信号通路,使IL-8 等表达增加,促进AM 病灶的炎症反应、血管生成及增殖等异常活动。在AM患者中亦发现IL-8表达高于对照组及周期变化消失的现象,可能与AM 内膜异常损伤修复密切相关[7,14]。由此可见,AM 的慢性炎症反应及痛经、月经异常等症状与TNF-α、COX-2、IL-6、IL-8 的异常有关。AM 可以通过实验手段在实验动物中产生,因为不同的激素失衡形式已被证明可以促进该物种AM发展,所以小鼠模型被认为是AM最常用的研究模型之一[15]。尽管该模型中AM 所需的确切激素变化不明确,但经过病理和分子改变的研究表明,相较于其他造模方法,如垂体移植术,枸橼酸他莫昔芬所诱导的子宫间质、血管和子宫肌层的紊乱是AM 发展的关键[16],故本研究使用枸橼酸他莫昔芬诱导建立小鼠模型来观察通脉化癥汤对AM 发展的进程,从而探讨对子宫腺肌病形成后所导致的炎性反应的影响。通脉化癥汤中桂枝、重楼,牡丹皮等多种药物现代药理学研究已证实可通过NF-κB等多条通路下调TNF-α、COX-2、IL-6 等多种炎症因子的表达,发挥抗炎、镇痛、免疫调节等作用[17-19],且全方具有较强的抗炎、镇痛效果,对于缓解AM 疼痛、月经异常等症状疗效确切。
实验结果显示HE 染色观察模型组子宫内膜与肌层边界紊乱,内膜间质细胞及腺体侵入肌层,证明造模成功。在免疫组化及Western blot实验中,通脉化癥汤各剂量组及孕三烯酮可显著降低TNF-α 和COX-2的表达水平,其中以高剂量组和孕三烯酮组疗效最佳,说明孕三烯酮与通脉化癥汤各剂量组尤其是高剂量组可抑制AM 小鼠病灶的炎症因子等表达,调节机体免疫水平,抑制AM 的发展进程,值得进一步深入研究。在ELISA 血清检测结果中发现,模型组IL-6、IL-8 水平升高,说明AM 能引起机体炎症因子表达升高,介导机体的炎症反应;各治疗组IL-6、IL-8 水平不同程度地降低,说明通脉化癥汤低、中、高剂量及孕三烯酮组均能减少炎症因子的表达,延缓AM 发展的进程,但各治疗组间无显著差异,可能是由于试剂盒、检测仪器存在误差、动物自身差异等问题,仍需进一步重复实验以验证结果。进一步关于AM 发病机制研究表明,发现AM 诱导的炎症因子在病灶局部呈高表达,结合痛经、不孕等表现,AM 被认为属于慢性炎症性疾病,多种炎症因子参与其中。前期临床研究发现通脉化癥汤对于患者AM 多种症状疗效显著,现代药理学已证实所含桂枝、重楼等多种中药及有效成分可发挥抗炎、镇痛、调节免疫功能等作用[17-18]。
本研究发现通脉化癥汤各剂量组均可下调AM 小鼠TNF-α、COX-2、IL-6、IL-8 的表达,其中高剂量组在下调TNF-α、COX-2 方面与孕三烯酮组疗效相近,均优于低、中剂量组,各治疗组在下调模型小鼠血清IL-6、IL-8 的表达方面疗效相当。证实了通脉化癥汤可通过下调炎症因子TNF-α、COX-2、IL-6、IL-8 的表达,进而抑制AM 模型小鼠的炎性反应,在研究AM 发病机制及治疗靶点方面提供了方向,为指导临床治疗AM针对性用药提供了借鉴。

