基于网络药理学及实验验证探讨喉咽清治疗咽炎的作用机制*
张 恒,王玉凤,唐纯玉,张坚强,王雄龙,李 丹,刘实琪,涂红英,李顺祥**,欧阳文,4,**
(1. 湖南中医药大学药学院 长沙 410208;2. 湖南省普通高等学校中药现代化研究重点实验室 长沙 410208;3. 湖南时代阳光药业股份有限公司 永州 410116;4. 湖南时代阳光博士后科研流动站协作研发中心 永州410116;5. 浏阳市中医医院 浏阳 410300)
咽炎(Pharyngitis)是咽部粘膜、粘膜下组织及其淋巴组织的炎症反应,包括急性咽炎与慢性咽炎[1-2]。近年来,随着社会的发展与环境的改变,咽炎的发病率不断呈上升的趋势,该病一年四季均可染病,无论是急性咽炎还是慢性咽炎,如果反复发作,对人体特别是肺部的伤害十分严重,不仅会影响患者的呼吸功能,而且大大降低了患者的生活质量。相比于西医通过使用单一的抗生素、糖皮质激素等药物以达到治疗咽炎的目的,中医的治疗方法疗效更加显著,且不良反应相对较少、安全性更高[3]。因此,寻找开发出能对咽炎产生显著疗效的中药制剂,一直是社会医疗中的热点关注问题。
喉咽清口服液(颗粒)是湖南时代阳光药业股份有限公司自主研制开发的国家级新药,由土牛膝、马兰草、车前草、天名精四味中药加水煎制而成,四味中药均属寒凉药、归肝经,且均有清热解毒的效果,四药合用,增其清热解毒之功,另有凉血利咽之效,临床常用于肺胃实热所致的咽部红肿、咽痛、口渴、发热、急性扁桃体炎、急性咽炎见上述证候者[4],连续被2010、2015、2020 版《中国药典》收录[5]。该制剂具有良好的研究前景,并且在2020年新型冠状病毒肺炎(COVID-19)的治疗过程中被湖南省卫生健康委纳入《湖南省儿童新型冠状病毒感染临床诊断与治疗专家共识(试行第一版)》[6]。大量研究表明,喉咽清在治疗咽炎方面具有良好的抗炎作用[7-10],胡蓉等[11]对喉咽清颗粒治疗风热喉痹的临床疗效及安全性进行研究,并将其与连花清瘟颗粒的临床疗效进行比较,结果表明喉咽清颗粒治疗风热喉痹的安全性、有效性均高于连花清瘟颗粒。喉咽清因其在抗炎方面安全有效,在临床上已有多次药物联用研究,宁来忠[12]对喉咽清口服液联合利巴韦林气雾剂治疗儿童急性咽炎的临床疗效进行研究,结果显示两种药物联用后临床总治疗率升高,且无不良反应的增加。多次研究结果表明[13-18],当其他药物与喉咽清联用后,可在临床上获得更好的疗效并降低前者药物的毒副作用,喉咽清还可用于放射性化疗等治疗方式引起的口腔溃疡等炎症反应,均取得良好的临床反馈。但是,目前对喉咽清抗炎机制的研究报道相对较少。
网络药理学融合多向药理学、计算生物学、网络分析等多学科的技术和内容,具有整体性、系统性的特点,能揭示“药物-基因-靶点-疾病”之间相互作用的关系,与中药复方多成分、多靶点、多途径的特征相吻合,能够加速中药药效物质与作用机制的发现过程,改进药物研究策略[19-20]。因此,本研究通过网络药理学及动物实验对喉咽清抗炎机制进行研究,以期为其临床应用奠定理论基础。
1 材料与方法
1.1 喉咽清有效成分筛选
通过传统中药系统药理学数据库和分析平台(https://old.tcmsp-e.com/tcmsp.php,TCMSP)[21]及相关文献检索喉咽清的主要活性成分。根据中药成分药物代谢动力学相关参数进行筛选,设置OB(口服利用度)≥30%,DL(药物相似性)≥0.18 为筛选条件。并结合课题组前期研究结果[22],将符合要求的活性成分同时纳入,汇总后得到喉咽清的主要活性成分。
1.2 喉咽清潜在靶点预测、抗炎靶点筛选
利用TCMSP 数据库、Swiss 数据库(http://www.swisstargetprediction.ch/)[23]查询喉咽清主要活性成分所对应的靶点,同时通过Uniprot 数据库(https://www.uniprot.org/)[24]查询靶点对应的基因名,选择物种为“人类(Homo sapiens)”,建立数据集,将靶点蛋白名称对应Uniprot数据集统一转换为基因名。检索GeneCards在线数据库(https://www. genecards. org/)[25],选择“antiinflammatory”为关键词,获得与抗炎相关靶点的数据集。使用TBtools 软件[26]中“Graphics Venn”功能,提取药物与疾病交集靶点作为喉咽清抗炎潜在作用靶点。
1.3 喉咽清PPI网络的构建
将喉咽清抗炎的潜在作用靶点导入STRING 在线数据库(STRING: functional protein association networks(string-db.org))获取PPI 网络,选择物种为“人类”,置信度设置为0.400,使用Cytoscape 3.9.0[27]中CytoNCA插件中的degree 值算法筛选出得分前30 的潜在核心靶点,将30个潜在核心靶点导入STRING数据库,选择物种为“人类”,置信度设置为0.900,得到喉咽清潜在核心靶点蛋白的PPI网络。
1.4 “药材-成分-靶点”网络构建与分析
将“药材-成分”、“成分-靶点”信息导入Cytoscape 3.9.0 绘制“药材-成分-靶点”网络图。药材、成分、靶点在网络图中用节点表示,两个节点间的相互作用用边表示。
1.5 “核心靶点-活性成分”网络构建
将筛选得到的核心靶点匹配相应的活性成分,通过Cytoscape3.9.0绘制“核心靶点-活性成分”网络图。
1.6 喉咽清GO及KEGG通路富集分析
通过DAVID Bioinformatics Resources 6.8在线分析平台[28](DAVID Functional Annotation Bioinformatics Microarray Analysis (ncifcrf.gov))对喉咽清核心靶点进行GO和KEGG富集分析。选取BP(生物学过程)、MF(分子功能)及KEGG富集通路前30个条目进行气泡图绘制。
1.7 喉咽清活性成分和核心靶点分子对接验证
核心靶点蛋白的三维结构通过PDB 数据库[29](https://www.rcsb.org/)下载得到,活性成分的三维结构图通过PubChem 在线数据库[30](https://pubchem.ncbi.nlm.nih.gov/)下载获得。通过Open Babel-2.4.1 软件[31]将活性成分的三维结构统一成PDB 格式。在Autodock 4.2.6软件[32]中将准备的靶点蛋白与活性成分进行前处理,随后通过Autodocking 将处理好的蛋白与小分子进行对接,使用Auto 工具计算成分与靶蛋白的对接结合能,再通过Pymol程序[33]将对接结果可视化。
1.8 实验验证
1.8.1 实验动物
25 只SPF 级大鼠,周龄6-8 周,体质量(200±20)g,雌雄各半,动物生产许可证号:SCXK(湘)2019-0004,购自湖南斯莱克景达实验动物有限公司。常规饲养于湖南中医药大学动物实验中心,自由饮食及进水。实验过程经湖南中医药大学实验动物伦理委员会审查通过。
1.8.2 试剂
喉咽清口服液,由湖南时代阳光药业股份有限公司提供,生产批号:20210716;大鼠白介素6(IL-6)ELISA 试剂盒、大鼠白介素-1β(IL-1β)ELISA 试剂盒、大鼠肿瘤坏死因子(TNF-α)ELISA 试剂盒、大鼠血清一氧化氮(NO)ELISA 试剂盒,货号:G0132W,购自北京四正柏生物科技有限公司。
1.8.3 仪器
TGL-16.5M 台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);SuPerMax 3100 型多功能酶标仪(上海闪谱生物科技公司);梅特勒ME104E 万分之一电子天平(上海子期实验设备有限公司)。
1.8.4 分组、造模及给药
将25只大鼠在实验条件下适应性饲养1周后随机分为5组,每组5只。咽炎大鼠模型参照文献方法[34]建立,除正常对照组外,其余各组均在适应性喂养1周后在第1-3 天对大鼠咽部涂抹15%氨水(反复涂抹3次,使咽部黏膜充血肿胀,形成急性炎症)。正常对照组以等量生理盐水进行涂抹。将氨水诱导的咽炎模型大鼠随机分为喉咽清高剂量治疗组(5只)、喉咽清低剂量治疗组(5 只)、地塞米松治疗组(5 只)及模型组(5 只)。实验第4 天开始每日1 次灌胃治疗,给药剂量参考《药理实验方法学》中人与动物体表面积折算等效比值表进行折算(大鼠比表面积/人体比表面积=6.6),喉咽清高剂量治疗组以2.67 g·kg-1进行灌胃治疗,喉咽清低剂量治疗组以1.34 g·kg-1进行灌胃治疗,地塞米松治疗组以5 mg·kg-1进行灌胃治疗,连续灌胃5天。
1.8.5 行为研究和咽组织病理评估
根据行为和身体评分标准,对喉咽清和地塞米松治疗后的氨诱导咽炎大鼠模型的饮食、活动、口腔抓痕、口腔毛发、咳嗽和唾液分泌变化进行行为学评分。根据咽炎病理评分标准,对各组大鼠黏膜增生、细胞浸润、血管扩张出血、腺体肥大改变进行咽组织病理评分。
1.8.6 标本采集及处理
末次给药24 h 后,大鼠腹主动脉取血后处死,分离血清,用ELISA 法检测血清中NO、TNF-α、IL-6 及IL-1β含量。取咽组织,用4%多聚甲醛固定液浸泡,标本脱水,石蜡包埋。切片后在显微镜下观察各组大鼠咽部组织情况并进行评估。
1.8.7 统计学方法
采用SPSS 21.0软件对数据结果进行统计分析,计量结果以均值±标准差()表示。使用单因素方差分析对组间数据结果进行比较,P<0.05 表示具有统计学差异。
2 结果
2.1 喉咽清治疗咽炎的网络药理学分析
2.1.1 有效成分及靶点筛选
经筛选得到喉咽清中潜在成分65个,其中土牛膝23 个,车前草21 个,马兰草15 个,天名精13 个。其中牛膝、马兰草共有成分1 个,命名为A1;牛膝、车前草共有成分3 个,分别命名为B1、B2、B3;牛膝、车前草、马兰草共有成分1 个,命名为C1;车前草、马兰草共有成分1 个,命名为D1。喉咽清潜在活性成分筛选结果见表1,其中部分成分在TCMSP数据库中未收录,该部分数据结果见表2。
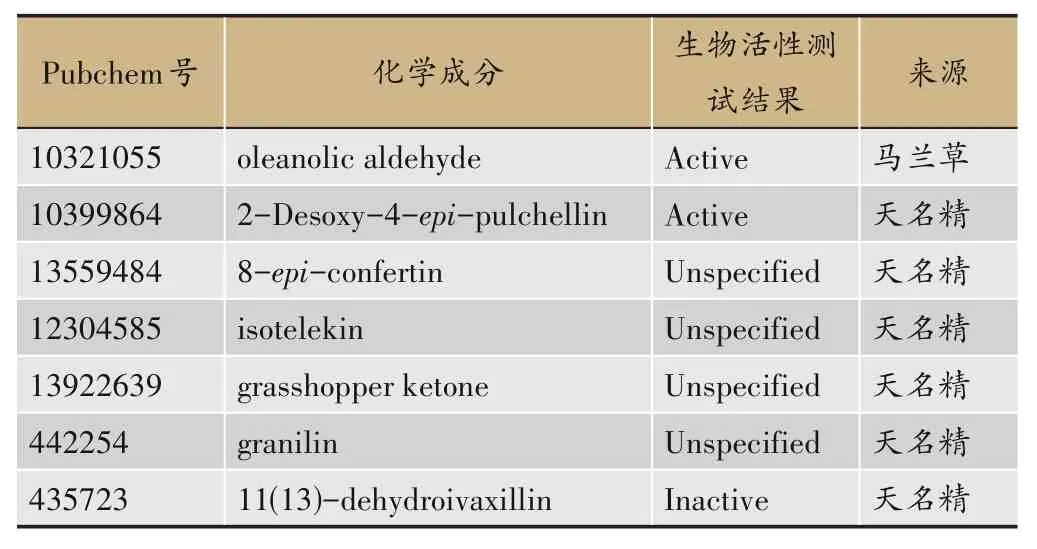
表2 从喉咽清中筛选出的潜在成分及其参数
将以上成分及对应的靶点导入Cytoscape 3.9.0绘制“成分-靶点”网络,喉咽清“成分-靶点”网络图如图1所示,其中土牛膝对应233个靶点,车前草对应177个靶点,马兰草对应75个靶点,天名精对应96个靶点,去除各药材重复靶点后进行汇总,最终喉咽清共含333个靶点。

图1 喉咽清潜在活性成分与靶点网络
2.1.2 喉咽清抗炎作用靶点预测
如图2所示,在GeneCards数据库共检索得到抗炎相关靶点1502个,其中喉咽清抗炎的潜在作用靶点有165个。
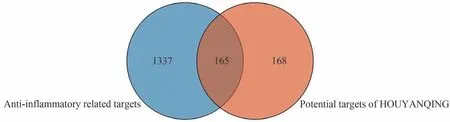
图2 喉咽清筛选成分潜在靶点与抗炎靶点韦恩图
2.1.3 喉咽清抗炎潜在作用靶点的PPI网络的构建
将165 个交集靶点导入STRING 在线数据库获得靶点间的相互作用关系,在0.4 的中等置信度条件下,网络中含有165 个节点,3630 条相互作用关系。使用Cytoscape 3.9.0 软件中的CytoNCA 插件对STRING 数据库导出的PPI网络进行degree值算法分析,将degree值排名前30 的网络靶点作为喉咽清的核心靶点,如图3 所示。喉咽清核心靶点包括:丝氨酸/苏氨酸蛋白激酶(Serine/threonine protein kinase,AKT1,degree=124)、肿瘤坏死因子(Tumor necrosis factor,TNF,degree=121)、白细胞介素-6(Intedeukin-6,IL-6,degree=117)、抑癌基因P53(Tumor Protein P53,TP53,degree=109)、前列腺素内过氧化物合酶2(Prostaglandinendoperoxide synthase 2,PTGS2,degree=108)。将30个潜在核心靶点导入STRING 数据库,选择物种为“Homo sapiens”,置信度为0.900,得到喉咽清潜在核心靶点蛋白的PPI网络,见图4。

图3 喉咽清核心靶点柱状图(前30)
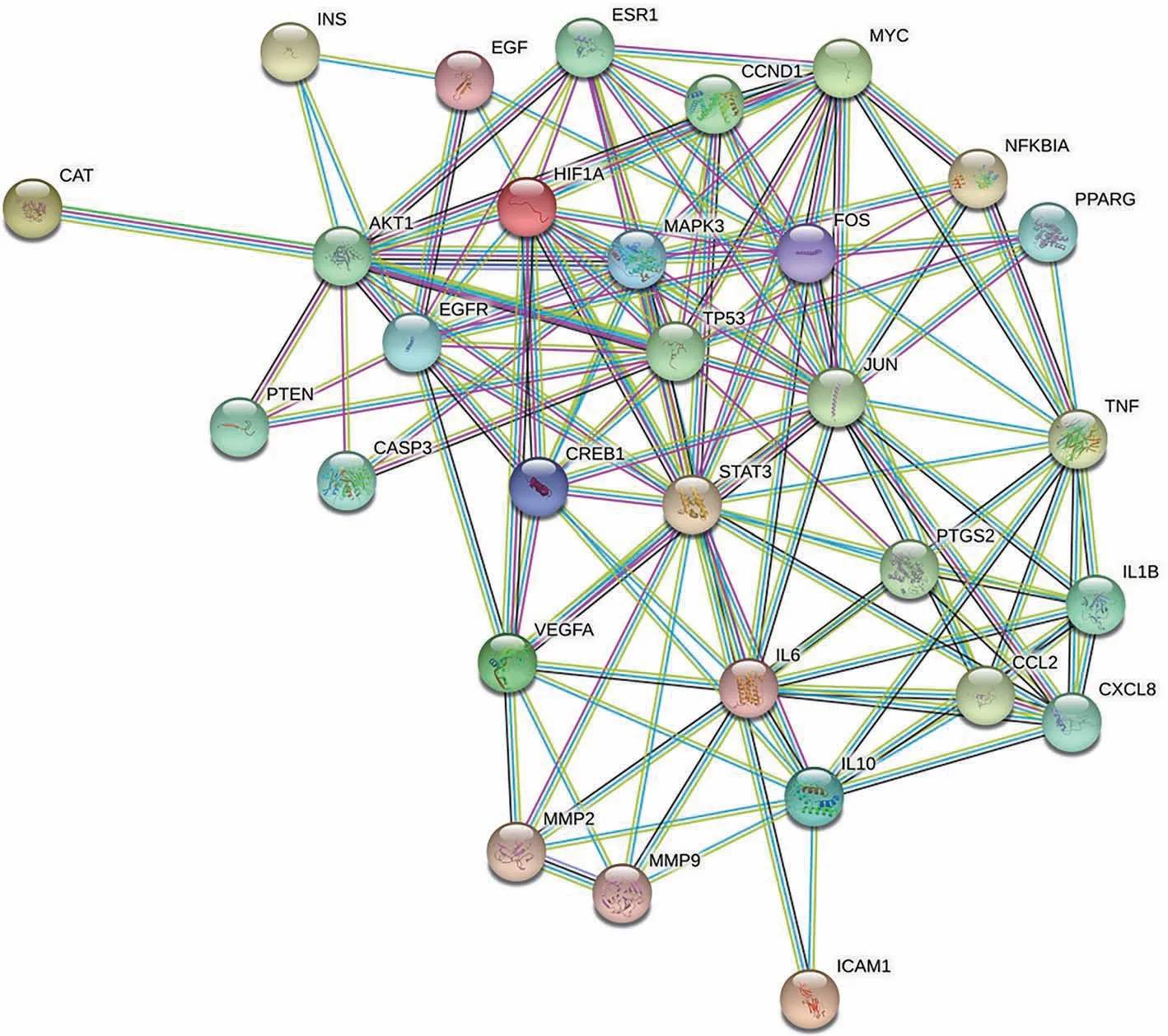
图4 喉咽清核心靶点的PPI网络(前30)
2.1.4 喉咽清“核心靶点-活性成分”网络构建
将“2.1.3”中筛选得到的核心靶点匹配喉咽清中对应的活性成分,其“核心靶点-活性成分”网络图如图5所示。其中,绿色节点代表药物来自土牛膝,深黄色节点代表药物来自马兰草,橙色节点代表药物来自车前草,深蓝色节点代表药物来自天名精。
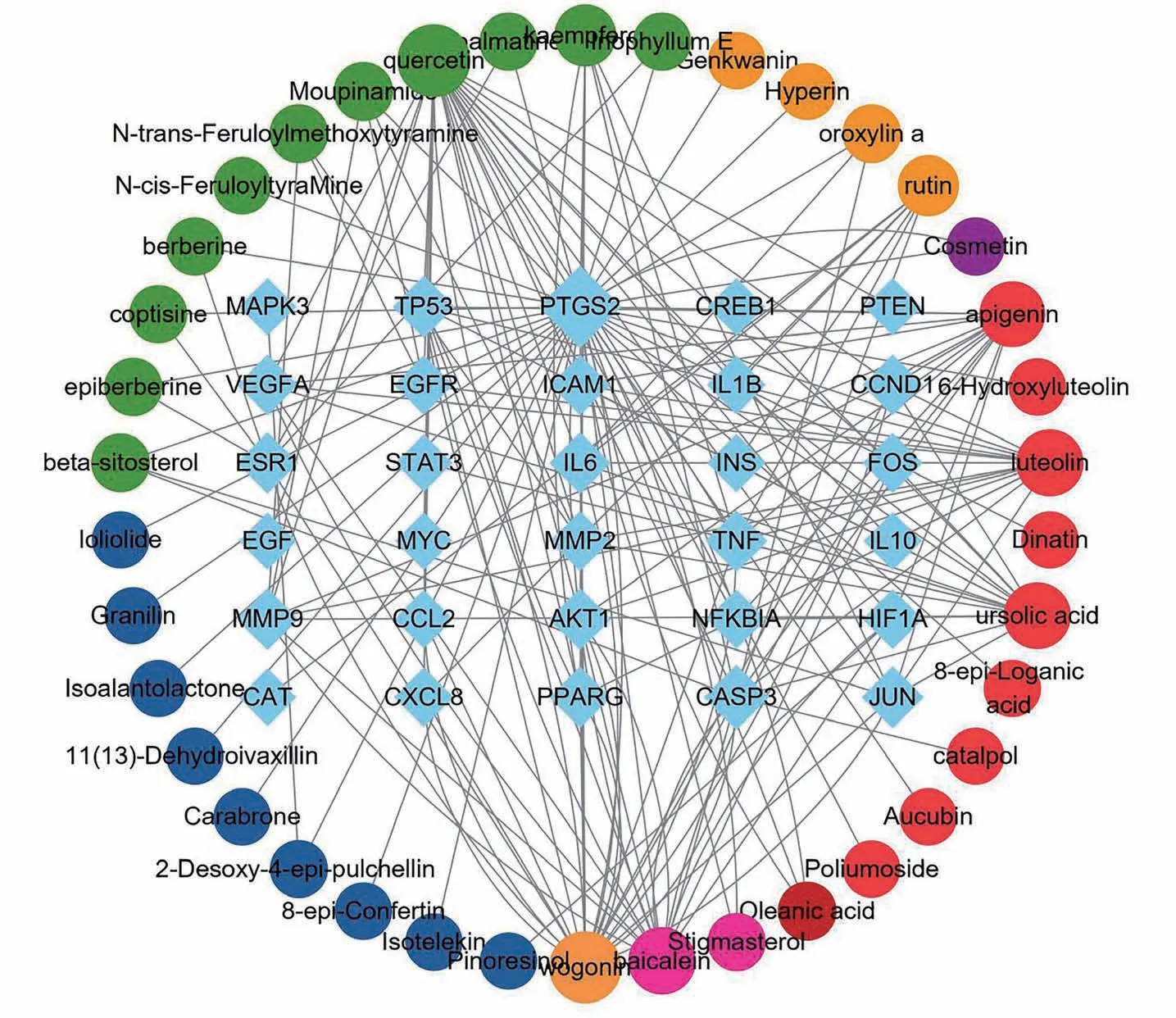
图5 喉咽清“核心靶点-活性成分”网络图
2.1.5 GO及KEGG通路富集分析
DAVID在线分析平台结果显示,得到286条GO条目与生物学过程(Biological process,BP)有关,筛选出P<0.05 且排名前10 的条目,GO-BP 富集结果见图6,该富集结果表明喉咽清抗炎的机制可能与对药物的反应、调节NO生物合成过程、抑制细胞凋亡和细胞老化、促进基因的转录与表达,以及和细胞的增殖与分化密切相关。分子功能(Molecular function,MF)通路富集得到36条相关GO 条目,筛选出P<0.05且排名前10的条目,得到GO-MF富集结果见图7,该富集结果表明喉咽清抗炎机制可能和酶结合、蛋白质结合、转录因子结合、影响转录因子活性及DNA、RNA 序列的特异性结合、蛋白磷酸酶结合、调节一氧化氮合酶活性等功能密切相关。KEGG富集条目共得到102条,筛选出P<0.05且排名前10 的条目,KEGG 通路富集结果见图8,该通路结果表明喉咽清抗炎可能与影响肿瘤合成途径、乙型肝炎相关通路、肿瘤坏死因子信号通路、肿瘤蛋白的合成、叉头转录因子(Forkhead Box O signaling pathway,FOXO)信号通路等密切相关。
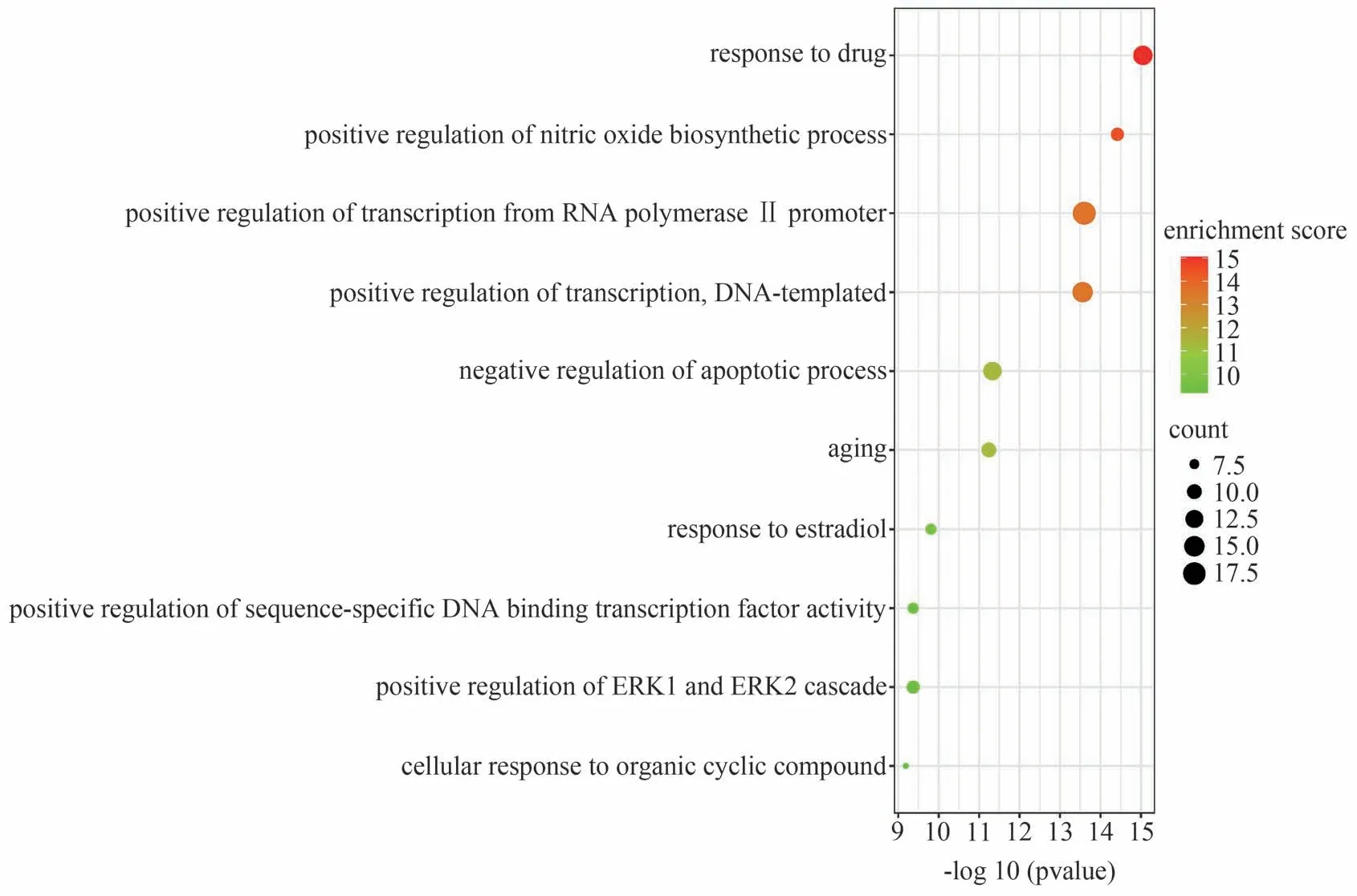
图6 喉咽清抗炎潜在核心靶点的GO-BP富集分析(前10)
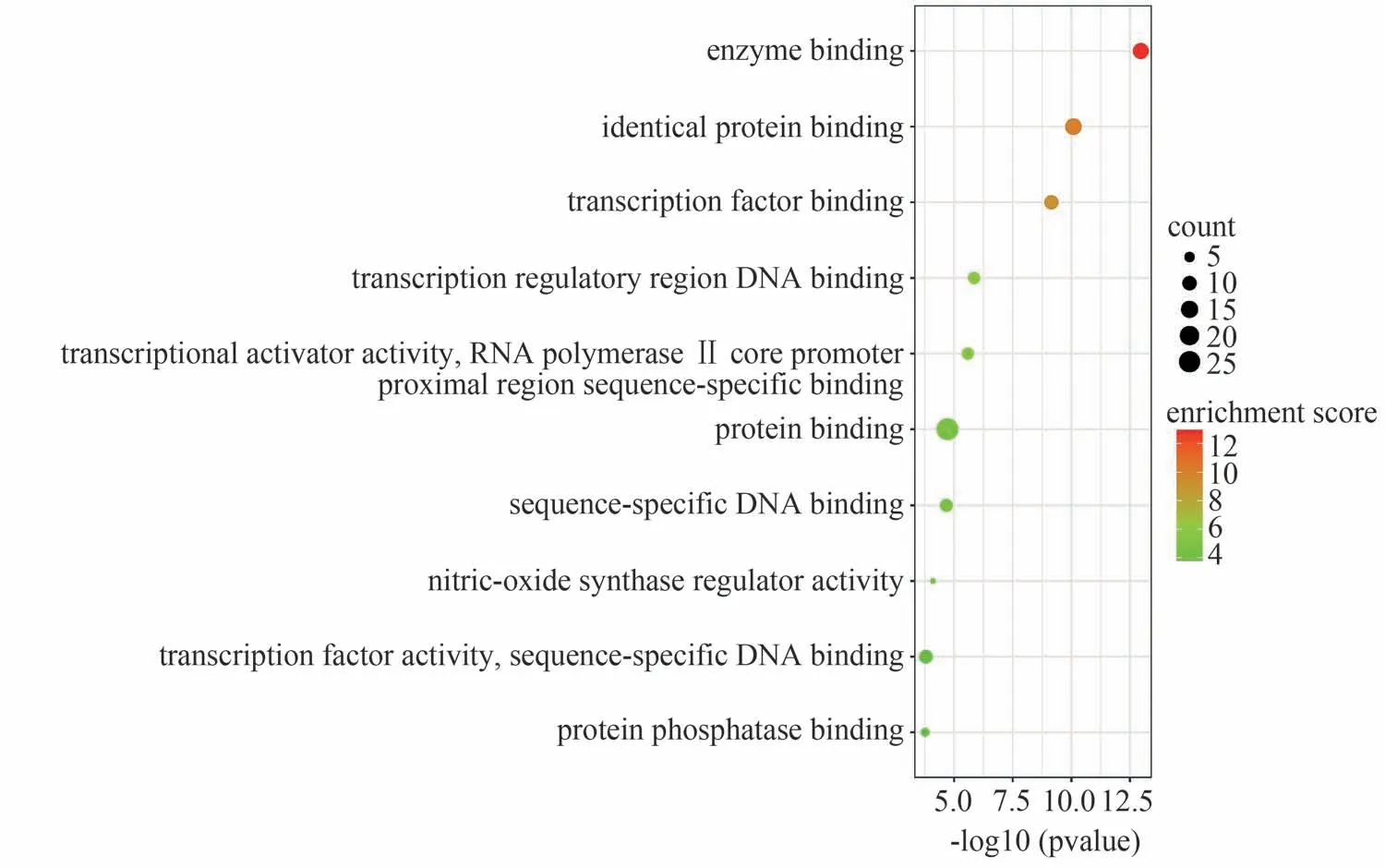
图7 喉咽清抗炎潜在核心靶点的GO-MF富集分析(前10)
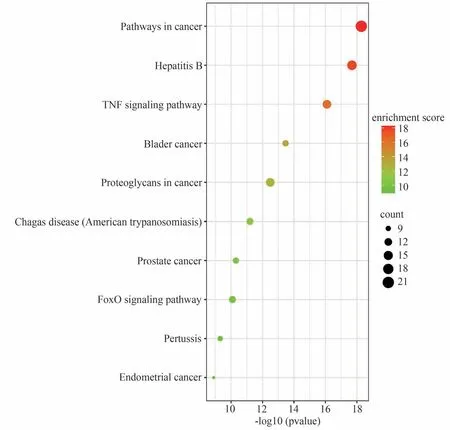
图8 喉咽清抗炎潜在核心靶点的KEGG通路富集分析(前10)
2.1.6 喉咽清分子对接验证结果
通过AutoDock 软件对喉咽清复方筛选得到的活性成分与核心靶点蛋白进行分子半柔性对接验证,通过图片的形式将活性成分的优势构象与核心靶点蛋白相互作用的关系直观的展示出来,其分子对接结果见表3,喉咽清活性成分与核心靶点蛋白的对接结合能均为负数,该结果表明进行分子对接的配体与受体之间能够自发结合。其中NRF2 蛋白与β-蜕皮甾酮、齐墩果酸、熊果酸的对接结合能均小于-39 kJ·mol-1,结合能分别为-39.92、-47.66、-46.15 kJ·mol-1;AKT1蛋白与齐墩果酸的对接结合能为-42.63 kJ·mol-1。其对接结合负能如此之大,说明受体与配体间能自发紧密结合,活性成分与核心靶点蛋白之间的结合情况与之前的预测关系相符。
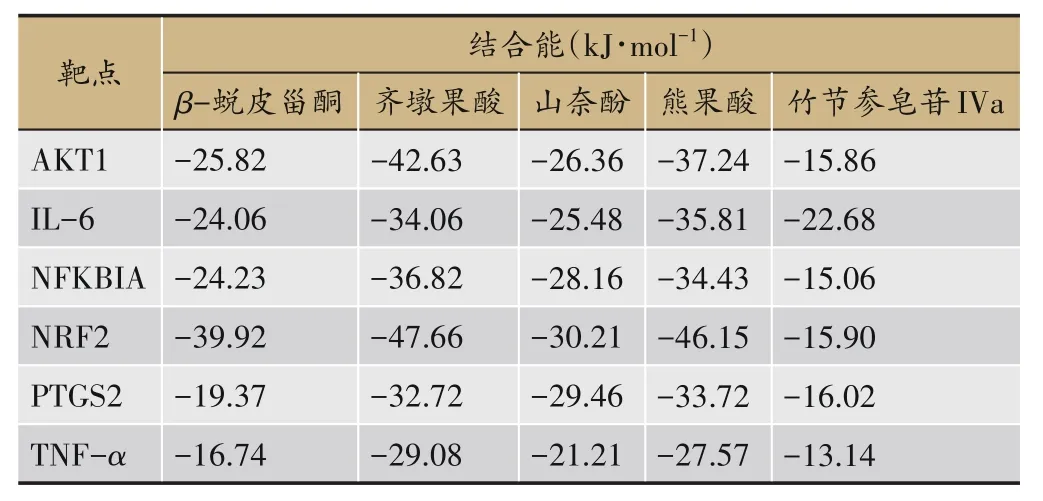
表3 喉咽清活性成分分子对接结果
如图9-1 所示,β-蜕皮甾酮与AKT1 的TYR-350、ASN-351、ARG-367 和ARG-370 等残基的氢键对接;如图9-5 所示,齐墩果酸与NRF2 的ILE-559、GLY-367、VAL-467 和VAL-606 等残基的氢键连接;如图9-8 所示,竹节参皂苷IVa 与IL-6 的ILE-136 和LYS-128 残基的氢键相连。喉咽清复方筛选所得的活性成分与核心靶点具有较强的对接亲和力,说明喉咽清复方可能是通过调节以上靶点蛋白来发挥抗炎作用,与网络药理学抗炎机制预测相吻合。
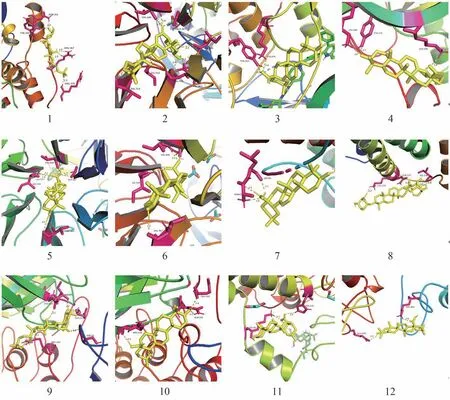
图9 分子对接模式图
2.2 动物实验结果验证
2.2.1 喉咽清对咽炎大鼠一般情况的影响
造模后,模型组大鼠挠口、咳嗽次数增加,进食量与饮水量减少,咽部红肿,粘液分泌物从口溢出,形成浅表溃疡,部分模型组大鼠口腔毛发逐渐脱落;正常组大鼠行为学特征无异常,整体身体状况良好,进食量与饮水量正常,咽部无红肿,咽粘膜无溃疡,口腔毛发光泽;与模型组大鼠相比,各治疗组大鼠咳喘、咽部红肿情况、唾液量分泌情况及口腔溃疡情况均有一定程度的改善。急性咽炎大鼠行为学评分结果见表4,各组大鼠咽部情况见图10。
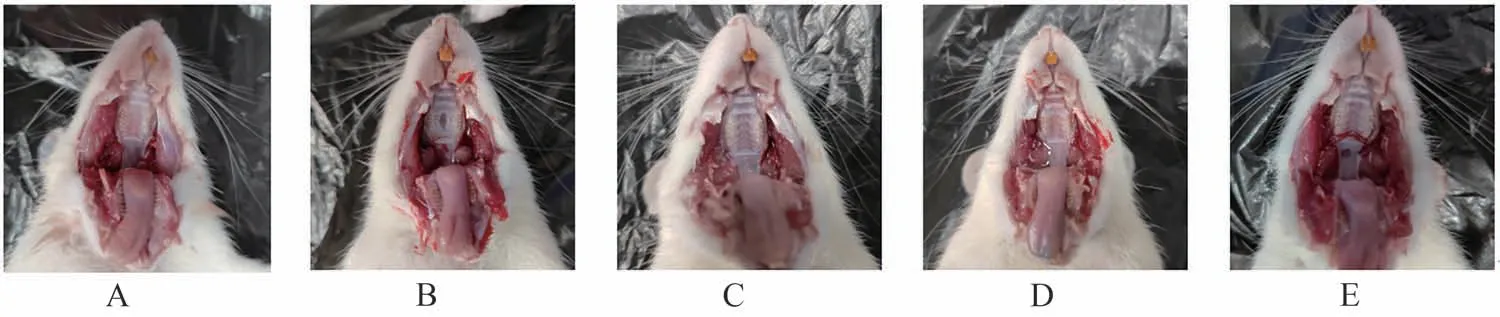
图10 各组大鼠咽部组织情况图
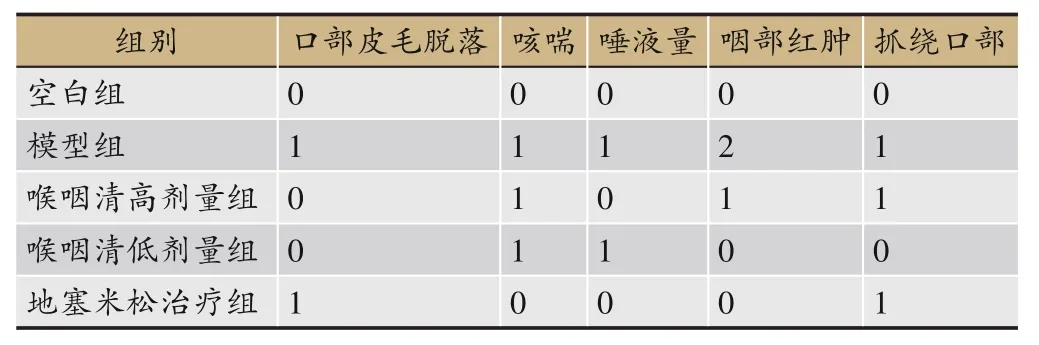
表4 急性咽炎大鼠行为学评分表
2.2.2 喉咽清对咽炎大鼠咽部组织病理学的影响
HE染色结果显示,正常组大鼠咽部软腭组织结构无异常,软腭主要由肌、肌腱和黏膜构成,由图11-A1可见,大鼠咽部软腭组织结构清晰,无明显炎症病变的发生。与正常组相比,模型组大鼠咽部软腭组织炎症病变明显,组织结构大面积增厚肥大。与模型组相比,地塞米松治疗组及喉咽清不同剂量组大鼠咽组织炎症及咽组织增厚程度均有一定的减轻,其中地塞米松治疗组及喉咽清高剂量组治疗效果明显。各组均可见咽组织增厚及炎症反应,说明咽炎大鼠模型造模成功(见图11)。急性咽炎大鼠咽炎病理评分结果见表5。
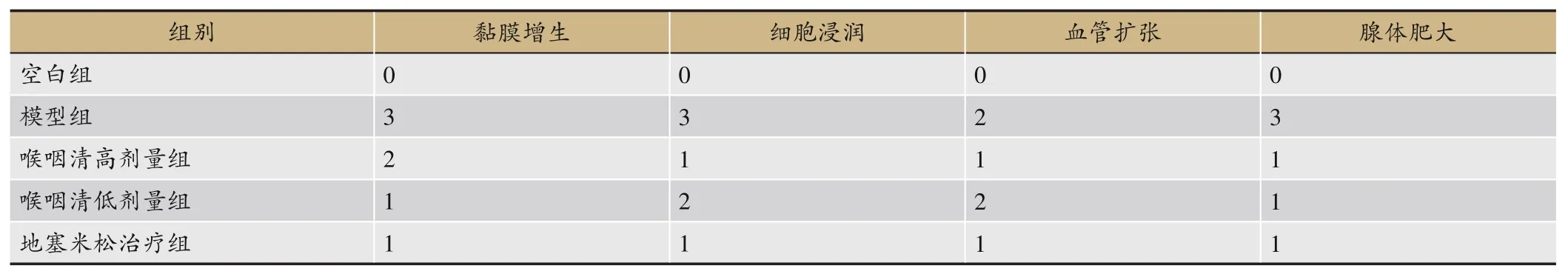
表5 急性咽炎大鼠咽炎病理评分表
2.2.3 咽炎大鼠行为学评估和咽组织病理评估分析结果
行为学评分及咽组织病理评分均是各组大鼠的综合得分,在此基础上对咽炎大鼠行为学及咽组织病理评分进行组间差异显著性统计分析(见表6)。该结果表示,与空白组相比,模型组咽炎大鼠行为学及咽组织病理情况具有明显恶化(P<0.01);与模型组相比,各治疗组均有不同程度的改善效果。
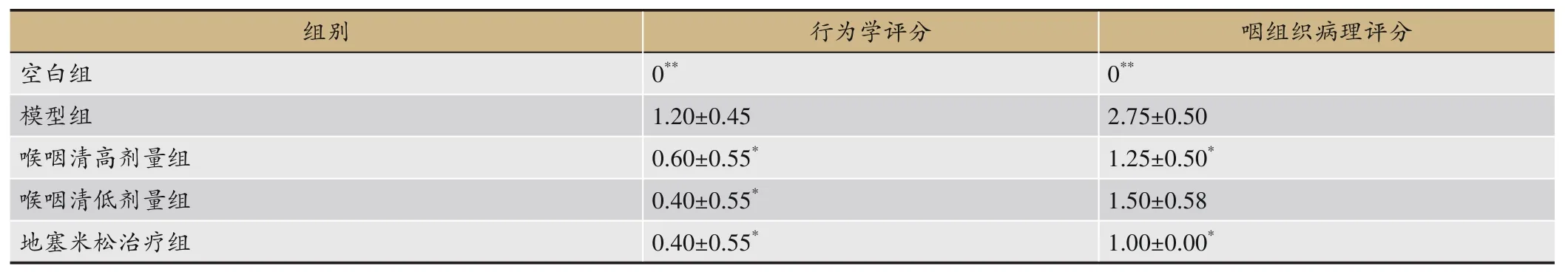
表6 咽炎大鼠行为学及咽组织病理评分分析结果
2.2.4 喉咽清对咽炎大鼠血清NO、TNF-α、IL-6、IL-1β的影响
由表7可见,与正常组相比,模型组IL-6、IL-1β含量均明显升高(P<0.01),TNF-α含有量同样明显升高(P<0.05);与模型对照组相比,喉咽清高剂量组TNFα、IL-6、IL-1β含有量明显降低(P<0.05);喉咽清高、低剂量组IL-6含有量明显降低(P<0.05)。
表7 喉咽清对咽炎大鼠血清NO、TNF-α、IL-6和IL-1β含量的影响(,n=5)
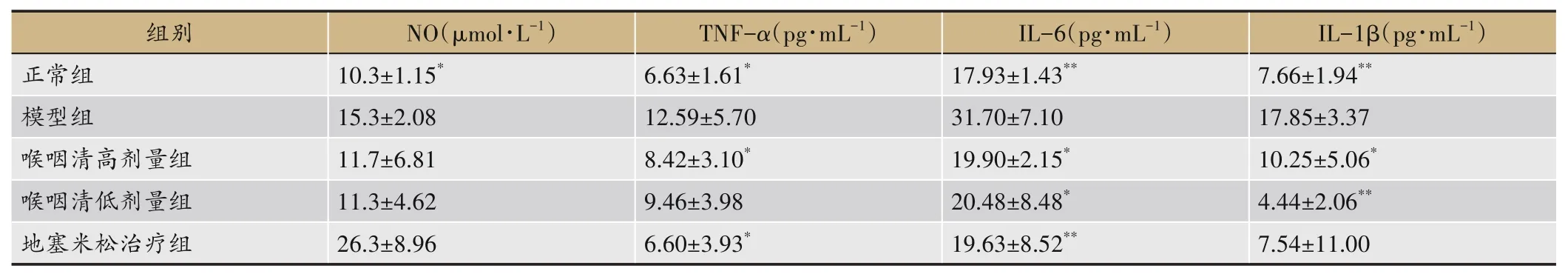
表7 喉咽清对咽炎大鼠血清NO、TNF-α、IL-6和IL-1β含量的影响(,n=5)
注:与模型组比较,*P<0.05,**P<0.01。
?
3 讨论与展望
本文对喉咽清进行抗炎机制的网络药理学预测,并结合动物实验对关键炎症因子进行验证。对于本文网络药理部分,笔者按照《网络药理学评价方法指南》[35-36]对文章中出现的数据库、软件等进行了溯源,以保证数据的可靠性。其中TCMSP 数据库中药物的口服利用度、类药性、相关靶点及所参与的信号通路等数据均是通过查阅大量文献所获得,且进行了人工验证,其准确性及查全性可靠[37-39]。同时笔者对文中数据进行了多次查搜,结果具有一致性,以保证数据的准确性和可重复性。但由于文中所进行的靶点及机制预测是分别建立在四味中药而不是整体复方的基础上,且喉咽清复方在煎煮过程中也可能存在化学成分的变化,因此本研究仍存在一定的局限性,即无法纳入喉咽清煎煮后新产生的化学成分。
对其网络药理学的研究通过成分、靶点匹配和通路富集,以及对药材中成分含量的考察,发现喉咽清中活性成分β-蜕皮甾酮、汉黄芩素、黄芩素、山奈酚、齐墩果酸、熊果酸能对应到较多的靶点数目,还有竹节参皂苷IVa、竹节参皂苷V 以及牛膝皂苷I、牛膝皂苷II、牛膝皂苷III 等成分也是其中起抗炎作用的关键成分。研究表明,β-蜕皮甾酮具有抗炎、抗氧化、延缓衰老等功能[40-41],山奈酚具有抗炎抑菌、抗癌、抗动脉粥样硬化等功能[42],齐墩果酸具有抗炎、抗氧化、抗变态反应等功能[43],熊果酸具有抗肿瘤、抗菌、抗炎、抗病毒、保肝等作用[44]。课题组前期研究表明竹节参皂苷IVa 具有良好的抗炎作用,是喉咽清中关键的抗炎活性成分[22]。由此可见,喉咽清在抗炎方面具有潜在的防治作用。“活性成分-靶点”网络显示喉咽清抗炎具有多成分、多靶点的特点。
本研究筛选得到喉咽清抗炎相关靶点165 个,潜在核心靶点30个,分别为PTGS2、AKT1、丝裂原活化蛋白激酶3(Mitogen-activated protein kinase 3,MAPK3)、信号转导和转录激活因子3(Signal transducer and activator of transcription 3,STAT3)、IL-6、IL-1β、IL-10、TNF、NFKBIA(NF-kappa-B inhibitor alpha)、胱天蛋白酶3(CASP3,Caspase-3)等。上述核心靶点与抗炎相关信号通路联系密切,其中最典型的核心靶点为IL-6、TNF。IL-6 是多功能炎性细胞因子,是炎性介质网络的关键成分,在炎症反应中起重要作用,其可以通过抑制巨噬细胞产生IL-1 和肿瘤坏死因子而在细菌内毒素诱导的实验性肺损伤中起细胞保护和抗炎作用[45]。TNF-α同样也是一种炎症因子,与炎症反应关系密切,它可通过激活细胞因子网络系统而诱发全身炎性反应,阻断诱导TNF-α表达通路上的任一环节均可在转录前水平抑制TNF-α的合成[46]。核心靶点预测结果显示喉咽清治疗咽炎主要涉及MAPK3、IL-6、TNF-α等靶点,与文献报道[1,47]一致,证明了该预测的可靠性。因此,喉咽清可能通过调控IL-6和TNF-α等炎症因子来起到抗炎的效果。通过AutoDock 软件对活性成分与核心靶点进行分子对接验证,结果表明活性成分与核心靶点之间存在高度对接结合力,进一步验证了网络药理学抗炎机制的预测。
动物实验结果证实喉咽清不同剂量组均可降低大鼠血清中TNF-α、IL-6、IL-1β等炎症因子的表达,减轻大鼠咽组织炎症程度,改善咽部组织结构,从而发挥治疗咽部炎症的作用。但喉咽清高、低剂量组之间的治疗效果差别不大,因此对于喉咽清的给药剂量还需后续进一步研究探讨。此外测大鼠血清IL-1β含量时,喉咽清低剂量组测量值比正常组大鼠更低,且地塞米松治疗组血清NO 含量远高于模型组,与理论值相差较大,通过对比实验记录发现,存在问题的两组数据均来自于体质量增长较慢的大鼠,因大鼠个体对急性炎症模型的抵抗力存在一定的差异性,从而导致实验结果产生部分误差,与理论值有一定的偏差,但本研究实验数据总体上还是能对喉咽清靶向抗炎起到验证作用。
综上所述,本研究通过网络药理学结合动物实验的方法探讨喉咽清治疗咽炎的作用机制,发现喉咽清能够通过多靶点、多途径的方式影响肿瘤合成途径、基因转录与表达、炎症相关蛋白合成等过程,作用于炎症相关通路、肿瘤相关通路、STAT3 信号通路等产生抗炎的作用。

