联合脑小血管病影像学总负担评分与血液炎症、代谢指标预测认知障碍的风险
祁林瑞,耿新,曾嵘,胡风云
脑小血管病(cerebral small vessel disease,CSVD)是临床常见的一类年龄相关的脑血管疾病,由各种因素影响脑内微小动、静脉及毛细血管导致。CSVD 继发的认知障碍是血管性认知障碍最常见的原因[1],早期发现及干预有助于预防进展为血管性痴呆[2]。目前,全球公认的6种CSVD关键性损伤的神经影像标志包括近期皮质下小梗死、MRI 白质高信号、腔隙灶、血管周围间隙、脑微出血及脑萎缩,以这些影像学标志物总结出的CSVD总负担评分也被作为评价CSVD患者全脑严重程度的“金标准”[3]。CSVD 不同影像学表现可能是认知障碍的潜在发病机制的基础[4,5],采用CSVD 总负担评分预测认知障碍具有一定的价值。但核磁影像作为一种高成本的检查手段,并不能很好地应用在疾病预防中,单一的评价指标也会降低预测准确率,因此纳入多项指标对于预测CSVD继发的认知障碍是必需的。
根据我们的既往研究,血液炎症指标如脂蛋白磷脂酶A2(lipoprotein phospholipase A2,Lp-PLA2)、白细胞介素6(interleukin 6,IL-6)以及代谢指标如同型半胱氨酸(homocysteine,Hcy)、胱抑素C(cystatin C,CysC)与CSVD 认知障碍的发生有相关性,具有临床应用价值[6]。现在此基础上研究联合影像学总负担评分和血液学指标预测CSVD 认知障碍发病风险,并构建预测模型,旨在为预防、识别和早期治疗CSVD继发认知障碍提供帮助。
1 资料与方法
1.1 一般资料
选择2020年9月至2022年5月于山西医科大学第五临床医学院神经内科就诊的CSVD 患者170例进行回顾性研究。纳入标准:①符合2015 年版《中国脑小血管病诊断共识》[7]中相关诊断标准;②配合入院检查,自愿参加神经心理学检测;③年龄>18周岁。排除标准:①伴有意识不清、谵妄状态、昏迷等;②无法配合完成神经心理学检测,如有言语障碍、听力障碍等;③存在头颅MRI扫描禁忌证或无法扫描者;④患有严重的重要系统疾病,如呼吸、循环、血液系统疾病等;⑤有肺部感染、消化系统感染及泌尿系统感染等;⑥有遗传性疾病、代谢性疾病、脑肿瘤、帕金森、癫痫、脱髓鞘疾病、既往或新发非腔隙性脑梗死、颅脑外伤等其他神经系统疾病;⑦患有焦虑、抑郁等精神障碍类疾病;⑧长期服用降糖、降脂类药物;⑨患者或家属不愿参加者;⑩由阿尔茨海默病等脑部疾病引起的认知障碍者。
研究通过了山西医科大学第五临床医学院审批(审批号2022-221),所有患者均签署了知情同意书。
1.2 方法
1.2.1 收集资料 收集所有入组患者的一般资料,包括性别、年龄、吸烟史、饮酒史、既往病史,包括高血压病史、糖尿病史等。
1.2.2 认知功能评分和分组 入组后采用蒙特利尔认知评估(montreal cognitive assessment,MoCA)量表对患者进行评分,总分30分,教育年限≤12年加1分。根据得分将患者分为无认知障碍组(MoCA≥26分)60例和认知障碍组(MoCA<26 分)110 例。从无认知障碍组随机抽取10 例,认知障碍组随机抽取20 例,共同组成验证集,其余140 例作为训练集进行相关性分析和模型构建。
1.2.3 血标本采集与检测 所有入组患者均在入院第2天清晨空腹采集静脉血,在我院检验科进行炎性指标(Lp-PLA2、IL-6)和代谢指标(Hcy、CysC)检测。
1.2.4 CSVD影像学标志物诊断 所有患者在入院后于我院核磁室进行全序列MRI 扫描(3.0T),扫描序列包括T1加权像、T2加权像、液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)、弥散加权像(diffusion weighted imaging,DWI)和磁敏感加权像(susceptibility weighted imaging,SWI)。核磁判读参照神经影像学血管性改变报告标准(STRIVE),由经过训练的2 名中级以上影像学和神经内科医师完成,如判读结果存在分歧则由另一位高年资神经内科医师最后确定。需要观察并记录的指标如下:①腔隙性梗死:充满液体的圆形或卵圆形腔隙灶,直径为3~15 mm,与前期1条穿支动脉供血区域的急性深部脑梗死或出血部位相一致;②脑白质高信号:T2像上表现为高信号,T1像上表现为等信号或低信号,包括脑深部白质高信号和脑室旁白质高信号;③脑微出血:T2像或其他影像序列图像上小的散在异常信号,对磁化效应敏感;④血管周围间隙:穿过灰质或白质时的走向与常见血管走向一致的充满液体的间隙,与脑脊液的信号强度相同,在与血管走向平行的层面上呈线性,在与血管走向垂直的层面上呈圆形或卵圆形,直径<3 mm[8]。
1.2.5 CSVD 总负担评分 包括:①腔隙性梗死灶数量≥1 个;②脑微出血数量≥1 个;③中重度(>10 个)基底节区扩大的血管周围间隙;④脑室旁白质高信号的Fazekas 评分≥3 分或脑深部白质高信号的Fazekas评分为2~3 分。上述项目各计1 分,各项相目加和为CSVD总负担评分。
Fazekas 评分法:脑室旁白质高信号评分:0 分-无病变;1分-帽状或铅笔样薄层病变;2分-病变呈光滑的晕圈;3 分-不规则的脑室旁高信号,延伸到深部白质。脑深部白质高信号评分:0 分-无病变;1 分-斑点状病变;2分-部分病变融合呈斑块状;3分-病变弥漫性融合呈斑片状。总分0~6分,分值越高表示脑白质高信号越严重。
1.3 统计学处理
采用SPSS 26.0 软件处理数据。计数资料以率表示,采用χ2或Fisher精确概率法检验;符合正态分布以及方差齐性的计量资料以(±s)表示,采用t检验;非正态分布的数据以中位数和四分位间距[M(Q25, Q75)]表示,采用非参数U检验。以是否存在认知障碍为因变量,差异具有统计学意义的因素为自变量,进行Logistic回归,分析CSVD 患者发生认知障碍的因素。P<0.05 表示差异具有统计学意义。各因素之间的多重共线性,用方差膨胀因子(VIFs)进行评估,当VIF>10时提示有多重共线性。对独立危险因素进行单项及多项联合绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评价其对认知障碍的诊断价值。通过R软件构建列线图。
2 结果
2.1 训练集2组CSVD患者一般临床资料比较
2组患者性别、年龄、基础疾病等基线临床资料差异均无统计学意义(均P>0.05),见表1。
表1 训练集2组CSVD患者各项指标情况比较[例(%)或(±s)或M(Q25,Q75)]
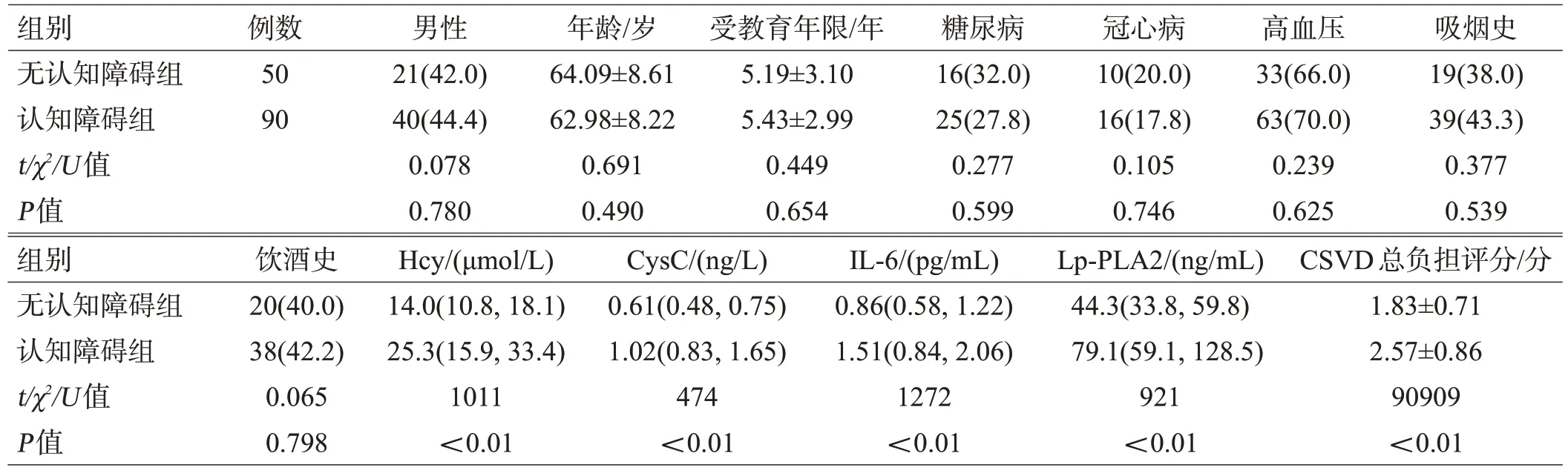
表1 训练集2组CSVD患者各项指标情况比较[例(%)或(±s)或M(Q25,Q75)]
组别无认知障碍组认知障碍组t/χ2/U值P值例数50 90男性21(42.0)40(44.4)0.078 0.780年龄/岁64.09±8.61 62.98±8.22 0.691 0.490受教育年限/年5.19±3.10 5.43±2.99 0.449 0.654糖尿病16(32.0)25(27.8)0.277 0.599冠心病10(20.0)16(17.8)0.105 0.746高血压33(66.0)63(70.0)0.239 0.625吸烟史19(38.0)39(43.3)0.377 0.539组别无认知障碍组认知障碍组t/χ2/U值P值饮酒史20(40.0)38(42.2)0.065 0.798 Hcy/(μmol/L)14.0(10.8,18.1)25.3(15.9,33.4)1011<0.01 CysC/(ng/L)0.61(0.48,0.75)1.02(0.83,1.65)474<0.01 IL-6/(pg/mL)0.86(0.58,1.22)1.51(0.84,2.06)1272<0.01 Lp-PLA2/(ng/mL)44.3(33.8,59.8)79.1(59.1,128.5)921<0.01 CSVD总负担评分/分1.83±0.71 2.57±0.86 90909<0.01
2.2 训练集2组CSVD患者血液指标及影像标志物比较
认知障碍组患者代谢指标Hcy、CysC 和炎症指标IL-6、LP-PLA2 均明显高于无认知障碍组(均P>0.05),见表1。认知障碍组患者CSVD 的总负担评分高于无认知障碍组(P<0.05),见表1。
2.3 认知障碍的多因素分析
以是否存在认知功能障碍为因变量,血清Lp-PLA2、IL-6、Hcy、CysC表达水平以及CSVD的总负担评分为自变量,进行Logistic回归分析。结果显示血清Hcy、Lp-PLA2 及CSVD 总负担评分升高是CSVD患者发生认知障碍的独立危险因素(P<0.05),见表2。且VIFs均<10,各因素间不具备共线性。
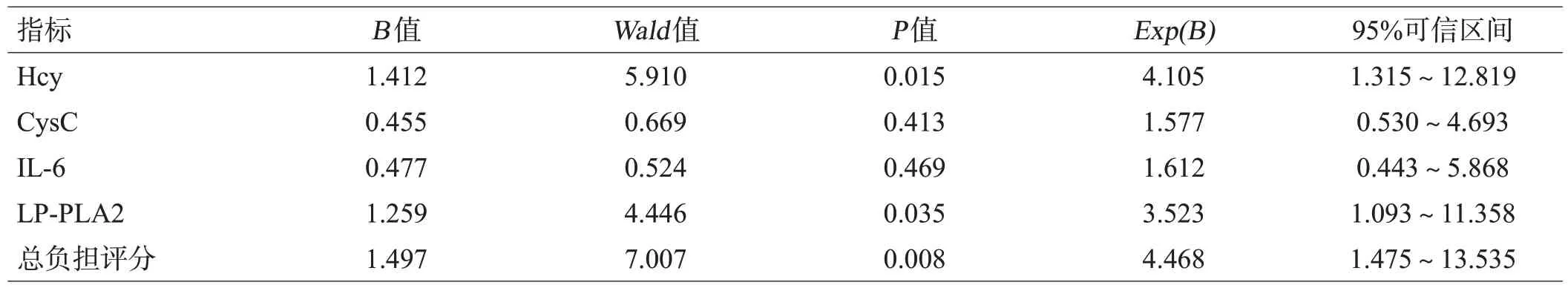
表2 CSVD患者发生认知障碍的多因素Logistic回归分析
2.4 血清Hcy、Lp-PLA2 及CSVD 总负担评分对认知障碍的诊断价值
血清Hcy、Lp-PLA2、CSVD 总负担评分诊断CSVD 患者继发认知障碍的ROC 曲线下面积分别为0.775、0.795、0.877,cut off值分别为21.8、57.9、1.5。联合检测的曲线下面积为0.929,高于任一单一指标,见图1。
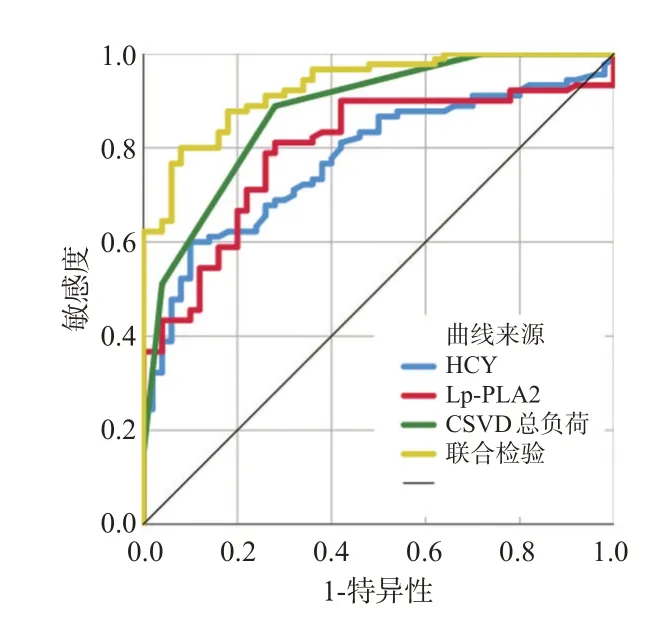
图1 Hcy、Lp-PLA2、CSVD总负荷各单项指标及联合3 项指标预测CSVD 患者认知障碍的受试者工作特征曲线
2.5 血清Hcy、Lp-PLA2 及CSVD 总负担评分构建的认知障碍风险模型
通过R软件对血清Hcy、Lp-PLA2及CSVD总负担评分进行分析,构建列线图,作为预测认知障碍发病风险的模型,见图2。

图2 血清Hcy、Lp-PLA2及CSVD总负担评分构建预测认知障碍风险列线图
2.6 认知障碍风险模型效能验证
通过验证集30 例CSCD 患者的临床资料构建ROC曲线,验证所构建的模型效能是否优于单独使用CSVD 总负担评分。结果显示,预测模型ROC 曲线的AUC 值为0.935,大于单独使用CSVD 预测的ROC 曲线AUC 值0.905,提示模型效能优于单独使用CSVD总负担评分,见图3。
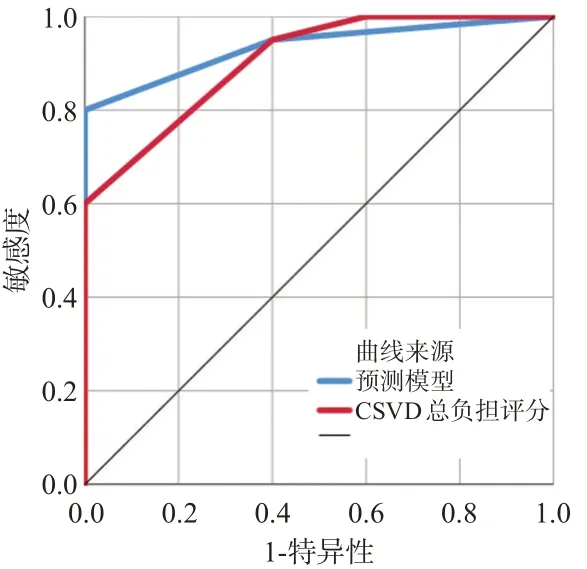
图3 CSVD总负担评分及预测模型预测CSVD 患者认知障碍的受试者工作特征曲线
3 讨论
CSVD 导致的认知障碍约占血管性认知障碍的36%~67%[9],目前基于核磁的神经影像学仍是诊断CSVD 的重要手段[10]。2013 年,Huijts 等[11]提出了CSVD 总负担评分,更好地反映了CSVD 对全脑功能状态的影响,可作为衡量病情严重程度的一种评估手段,得到了临床广泛的认可及应用[12]。采用量化的CSVD 总负担评分评估CSVD 具有更加直观、简单的优势。
本研究结果表明CSVD总负担评分增加是认知障碍的独立危险因素。Hilal S等[13]的研究认为总评分与全脑的认知功能下降,特别是执行功能、语言和视觉建构的损害显著相关;Uiterwijk R 等[14]通过纵向研究证明总负担评分与认知功能受损有显著相关性。这可能是与多种影像学特征合并存在的CSVD具有更广泛的脑微结构损伤有关,在视空间与执行能力、记忆力、语言能力、延迟回忆4个认知领域受损更重[15]。国内有研究通过对海马体积进行测量,发现随着总负担评分增加,海马体积下降显著,进而得出CSVD 患者全脑NAWM区结构损伤和海马体积减少,随CSVD总负担评分增加而加重,支持CSVD 是神经血管变性过程中的关键环节这一论点,不断加重的CSVD 促进了神经变性过程和认知障碍的进展[16]。总之,总负担评分增高,代表血管周围间隙、腔隙性梗死、脑微出血和脑白质变性不同标记物共存,提示有更复杂的病理生理机制参与了CSVD 患者的大脑网络损伤和认知障碍发展,总负担评分可能是认知障碍的预测因素。
目前研究表明,血液炎性及代谢指标异常可能反映CSVD的发病过程,促进认知功能损伤[17]。CSVD的炎性发病机制,可能是CSVD 可持续破坏血脑屏障继而引起神经血管单元的慢性炎症反应,神经血管单元中的纤维蛋白原是一种在血脑屏障破坏后沉积在中枢神经系统的中枢凝血蛋白,也可以激活小胶质细胞产生趋化因子,导致外周炎症细胞迁移到中枢神经系统,产生慢性炎症微环境[18,19]。IL-6是一种细胞因子,在调节免疫及炎症反应中起着重要作用,被认为是与CSVD 发病相关的危险因素之一[20]。Lp-PLA2 是一种血液特异性炎性指标,属于PLA2 超家族的第7 组,它与血管炎症疾病的相关性已被广泛研究[21,22]。当Lp-PLA2水平升高,炎症反应进一步加重,可导致血管内皮功能障碍,损伤神经通路及功能,引起CSVD血管性认知障碍。
针对CSVD 代谢指标方面,Hcy 是由蛋氨酸经过脱甲基作用而产生的一种含硫非必需氨基酸,正常情况下在人体内经肾脏排泄,当代谢障碍引起人体内Hcy 浓度升高时,可导致心脑血管疾病的发生。既往研究显示血浆Hcy 浓度的高低与CSVD 患者认知功能损害的程度相关[23],可能与高水平Hcy 浓度引起NMDAr-ROS-ERK1/2/p38 NF-jB 信号通路异常有关[24]。而CysC 是产生于所有有核细胞的一种组织蛋白酶抑制物,是临床上用于预测肾功能的敏感生物学标志,肾脏血管与脑血管解剖结构及血流动力学相似,因此CysC也在一定程度上对CSVD的发生、发展有提示作用。本研究发现认知障碍患者的CysC 水平高于无认知障碍患者,但并非是其独立危险因素。而刘霞等[25]研究表明CSVD患者血CysC水平明显增高,且是患者认知障碍的重要危险因素,此差异可能与样本量大小及CSVD 不同时期的进程有关。其次,CSVD 患者常合并高血压、糖尿病等危险因素,本研究对比2组患者,未发现与认知功能有明显相关性。
综上所述,本研究提示炎症指标Lp-PLA2 及代谢指标Hcy表达水平、CSVD总负担评分与CSVD患者继发认知损伤显著相关,是其独立危险因素。联合影像学总负担评分及炎症指标Lp-PLA2、代谢指标Hcy 水平建立早期预测模型,诊断效能优于单纯血液学指标或影像学指标。在临床工作中,应重视监测CSVD 患者的影像学检查及Lp-PLA2、Hcy水平,对于评分高危人群定期监测血液指标,可以有效减少过度的检查,减轻患者负担。而对于CSVD总负担评分与患者实际出现的认知障碍不符的病例,可以通过联合血液指标来综合评判患者是否需要积极干预来预防继发认知障碍,对于个体化治疗具有一定的价值。但本研究为回顾性研究,存在一定的局限性,样本量相对较少,未能动态观察CSVD 患者的影像学表现、血液指标及临床表现等,今后应进一步随访CSVD 患者,认识疾病发生、发展的各个阶段,从而寻找更精准的治疗及预防靶点。

