花椒中代森联·吡唑醚菌酯的残留分析及膳食风险评估
张耀海,赵其阳,王成秋,焦必宁
1(西南大学/中国农业科学院柑桔研究所,重庆,400712)2(农业农村部柑桔及苗木质量监督检测测试中心,重庆,400712)3(农业农村部柑橘类果品质量安全控制重点实验室,重庆,400712) 4(农业农村部柑桔产品质量安全风险评估实验室,重庆,400712)5(国家柑桔工程技术研究中心,重庆,400712)
花椒,属于芸香科、花椒属,是一种落叶小乔木。其果实是一种重要的食品添加剂和中草药,尤其在川菜中具有独特的麻木味道,具有温中行气、逐寒、止痛、杀虫等功效[1-2]。近年来,花椒产业快速发展,种植面积已达50万hm2以上,产量已达10万t以上,是我国西南地区最主要的经济作物之一[3]。然而,花椒在种植过程中极易受到病虫害的侵袭,会导致产量和品质严重下降[4]。花椒生产上遇到的最大挑战为病虫害问题:主要病害如根腐病、锈病、溃疡病、黑茎腐病、果实黑腐病等,主要害虫如蚜虫和凤蝶等。
为了防治病虫害,人们会在花椒生长期间施用杀虫剂和杀菌剂等多种农药,这会导致花椒中农药残留的污染[2]。长期或短期食用受农药污染的食品可能对人类健康造成潜在危害,导致各种症状,如头痛、恶心、生殖功能下降、内分泌系统紊乱等[3]。因此,食品中的污染物含量是否超过相关机构设定的最大残留限量(maximum residue limit,MRL),已引起公众和科学界的关注。遗憾的是,国内外明确的花椒农药残留MRL标准甚少。在我国,花椒上只登记了2种农药,分别是40%环丙唑悬浮剂和40%丙环唑水乳剂。目前,人们对杀虫剂、杀菌剂等农药在花椒上残留消解状况及其膳食风险的报道甚少:ZHOU等[5]开展了花椒四地田间试验,以QuEChERS结合超高效液色谱-二级质谱分别测定干、鲜花椒中吡虫啉及其5种代谢物残留量,并进行了膳食风险评估;唐光辉等[6]研究了树干注药后戊唑醇在花椒树不同组织中的分布残留动态;范金平等[7]开展了烯效唑在冷冻条件下花椒贮藏稳定性研究;杨双昱等[8]评价戊唑醇、肟菌酯和吡唑醚菌酯3种杀菌剂在青花椒中的残留消解行为。
作为一种高效杀菌剂,60%百泰水分散粒剂是德国巴斯夫公司研制的新型复配杀菌剂,有效成分为5%吡唑醚菌酯和55%代森联,可有效防治真菌性病害,并且对非靶标生物和环境安全,为果蔬、油料作物等农作物的品质和产量都起着积极的作用。国内外陆续报道了百泰在葡萄[9]、苹果[10]、柑桔[11]、荔枝[12]、花生[13]、棉花[14]等上的使用状况,但未报道在花椒等香辛料中的使用现状和残留现状。而在GB 2763—2021食品安全国家标准食品中农药最大残留限量中,仅制定了部分香辛料中的MRL(香辛料允许使用的灭菌剂如毒菌酚MRL为0.01 mg/kg、乐杀螨MRL为0.05 mg/kg、氯苯甲醚MRL为0.05 mg/kg和乙烯菌核利MRL为0.05 mg/kg,代森联在胡椒、茴香和豆蔻中MRL均为0.1 mg/kg),但花椒中代森联和香辛料中吡唑醚菌酯的MRL尚无明确标准。此外国外已评估了百泰的遗传毒性,结果表明百泰能够损伤DNA,并毒害细胞[15]。因此有必要通过田间试验,探明百泰在花椒上的残留消解规律,并探讨其可能产生的膳食健康风险,为制定其在花椒中的MRL提供数据支撑。
本研究以花椒为对象,采用超高效液相色谱-串联质谱法和气相色谱-火焰光度检测器(gas chromatography coupled with flame photometric detector, GC-FPD)检测技术,分析了代森联和吡唑醚菌酯在花椒中的消解与残留分布,并对其可能产生的人群膳食风险进行评估,以期为我国花椒安全生产、监测和消费引导提供重要的技术依据和参考。
1 材料与方法
1.1 材料与试剂
代森联(纯度≥75%),上海源叶生物科技有限公司;二硫化碳(纯度≥99%)、甲酸(色谱纯)和氯化亚锡二水合物(分析纯),上海麦克林生化科技有限公司;吡唑醚菌酯(纯度≥98%)和乙撑硫脲(ethylene thiourea, ETU)(纯度≥99.5%),德国Dr.Ehrenstorfer GmbH公司;乙腈、甲醇和正己烷(色谱纯),美国Sigma-Aldrich公司;抗坏血酸(分析纯),上海国药化学试剂有限公司;无水硫酸镁和氯化钠(均为分析纯),江苏强盛化工有限公司;盐酸(分析纯),重庆川东化工有限公司;氨水(分析纯)、乙二胺基-N-丙基(40~63 μm,6 nm)和石墨化碳黑(120~400目),上海安谱科学仪器有限公司;60%代森联·吡唑醚菌酯水分散粒剂,上海悦联化工有限公司。
1.2 仪器与设备
Agilent 7890B气相色谱仪,配FPD 检测器(含硫滤光片)、DB-1(30 m×0.25 mm×1.0 μm)气相色谱柱、Agilent 1290-6495A液相色谱串联质谱仪,美国Agilent公司;Acquity UPLC BEH C18超液相色谱柱(2.1 mm×10 cm,1.7 μm),美国Waters公司;CL31/CL31R冷冻离心机,美国Thermo Fisher公司;CK2000高通量研磨仪,北京托摩根公司;Milli-Q 超纯水器,美国Millipore公司;THZ-C恒温振荡器,苏州培英实验设备有限公司;有机相针式滤器(0.22 μm),上海安谱科学仪器有限公司。
1.3 实验方法
1.3.1 田间试验和样品采集
花椒于2020年4~5月在重庆市江津区(消解和终残)、重庆市忠县(消解和终残)、山东省济南市(终残)、四川省资阳市(终残)四地采集。施药方法:60%吡唑醚菌酯·代森联水分散粒剂于花椒叶斑病发生初期喷雾施药,推荐施药剂量400~800 mg a.i./kg(稀释倍数750~1 500倍),用水量1 500~2 250 L/hm2;施药次数:2~3次;施药间隔7~10 d,安全间隔期:14 d。施药器具:背负式电动喷雾器。
最终残留量试验设置4个试验点。每个试验点设1个处理小区,小区面积50 m2(约6~8棵花椒树),以800 mg a.i./kg(750倍稀释液)的有效剂量,用水量为2.5 L/棵树(即处理小区每次施药称取26.67 g 60%吡唑醚菌酯·代森联水分散粒剂,用20 L水勾兑配制而成),于花椒成熟前28 d进行第一次施药,分别间隔7 d再进行第2次、第3次施药。每个试验点在末次施药后间隔14、21 d分别采集,每小区每次均采集2个独立样品。对照区:另外设置,不施药。采集处理小区时,应同时采集对照小区。
残留消解试验设置2个试验点。在最终残留试验小区中开展,无需额外设置小区。每个试验点在末次施药后间隔2 h、7 d和28 d分别采集,每小区每次均采集2个独立样品。对照区:另外设置,不施药。第一次和最后一次采集时,应同时采集对照小区。
样品采集:应戴一次性手套,先采对照区,再采集处理小区。按设计方案要求,采用随机法在树的不同方向及上、下、中、外、里、向阳和背阴面等不同部位采集不少于2 kg无明显病害、正常生长、成熟的果实样品,装入容器中,包扎妥当,容器内外各加上标签。处理小区需分2次采集2个独立样品。样品运输:采集后在8 h内进行处理,并冷冻保存。样品在冷冻状态下运输,并记录运输过程中的温度。
将田间采集的花椒的每个独立样品在实验室内均分别制备鲜花椒150 g样品2份、干花椒150 g样品2份,分别装入封口袋中,贴好标签,-18 ℃低温保存。干花椒制备,参照相关标准GH/T 1289—2020 干花椒流通规范和GB/T 30391—2013 花椒。
1.3.2 样品前处理
1.3.2.1 代森联的样品前处理
代森联样品前处理采用衍生方法,在加热的密闭顶空瓶中,样品中代森联遇氯化亚锡盐酸溶液反应生成的二硫化碳气体被瓶中的正已烷吸收,形成二硫化碳的正已烷溶液,GC-FPD测定有机相中的二硫化碳的量,用二硫化碳定量代森联的含量。
具体步骤参考相关文献[16-17],并做了一定改进,如下:称取样品10.00 g(精确到0.01 g)于100 mL顶空瓶中,加入50 mg抗坏血酸、40 mL氯化亚锡盐酸溶液、10.00 mL水、10.00 mL正已烷,迅速将瓶口密封,放入恒温振荡器中85 ℃下2 h,时间到后拿出冷却至室温,吸取上层有机相,0.22 μm有机相滤头过滤,经GC-FPD测定。
1.3.2.2 吡唑醚菌酯和ETU的样品前处理
吡唑醚菌酯和ETU样品前处理采用优化的QuEChERS法提取净化,液相色谱-三重四极杆质谱联用仪检测。
具体步骤如下:准确称取2 g(精确到0.01 g)样品于50 mL离心管中,加入20.00 mL 1%(体积分数)氨水乙腈和2.00 mL去离子水,于高通量组织研磨仪上以1 000 r/min振荡提取10 min;加入2.0 g无水硫酸镁和0.5 g NaCl,振荡2 min;10 000 r/min离心5 min,吸取1.00 mL上清液于含有50 mg乙二胺基-N-丙基、30 mg石墨化磷黑的离心管中,再加入1.00 mL乙腈稀释,涡旋2 min;3 000 r/min离心5 min,取上清液过0.22 μm有机滤膜,待测。
1.3.3 标准工作液的配制
二硫化碳的标准母液:25 mL容量瓶中加入5 mL正已烷,向其中加入25.00 mg二硫化碳,用正已烷定容至刻度,即为1 000 mg/L的母液,于-50 ℃避光保存。
二硫化碳的标准工作溶液:用正己烷将标准母液逐级稀释配成30、20、10、5、2、1、0.5、0.2、0.1 mg/L系列标准溶液,测试前现配。
吡唑醚菌酯和ETU的标准母液:分别称取吡唑醚菌酯和ETU标准品10.00 mg于10 mL棕色容量瓶中,用乙腈定容,摇匀,配制成1 000 mg/L标准母液,转移到带盖棕色试剂瓶中,置于-50 ℃超低温冰箱中待用。
吡唑醚菌酯和ETU的标准工作溶液:各取1 mL 1 000 mg/L吡唑醚菌酯和ETU标准母液,乙腈定容至10 mL,配制成100 mg/L的混合标准溶液,用花椒基质空白将混合标准溶液逐级稀释配成1、0.5、0.1、0.05、0.01、0.005、0.002 mg/L系列标准溶液,测试前现配。
1.3.4 仪器条件
1.3.4.1 气相条件
色谱柱:DB-1(30 m×0.25 mm×1.0 μm);流速:0.8 mL/min;柱温:50 ℃(1 min),以20 ℃/min升温至120 ℃(1 min);进样口温度:120 ℃;检测器:200 ℃,载气:氮气,30 mL/min;空气:60 mL/min;氢气:50 mL/min;进样量:1 μL。
1.3.4.2 高效液相色谱-串联质谱条件
色谱柱:Acquity UPLC BEH C18(2.1 mm×10 cm),1.7 μm;柱温:40 ℃;进样量:1 μL;流动相A:0.1%(体积分数)甲酸水溶液;流动相B:乙腈;流速:0.25 mL/min。梯度洗脱条件见表1。

表1 流动相梯度洗脱
离子源:AJS-ESI+;扫描方式:MRM模式;干燥气温度:250 ℃;干燥气流速:14 L/min;氮气压力:30 psi;鞘气温度:375 ℃;鞘气流速:12 L/min;毛细管电压:4 000 V;喷嘴电压:500 V。MRM质谱条件见表2。

表2 MRM监测条件参数
1.3.5 定性和定量方法
代森联测定采用GC-FPD进行定性定量,其中代森联的衍生物二硫化碳定性采用其相对保留时间,定量采用代森联的衍生物二硫化碳标准曲线法。用二硫化碳的含量[ω(二硫化碳)]定量代森联的含量,单位以毫克每千克(mg/kg)表示,按公式(1)计算:
ω(代森联)=1.79×ω(二硫化碳)
(1)
式中:ω(代森联),代森联质量浓度,mg/kg;ω(二氧化硫),二氧化硫质量浓度,mg/kg。
吡唑醚菌酯和ETU采用液相色谱-三重四级杆串联质谱仪进行定性定量,如表2所示。根据《农药登记残留试验待测残留物和植物源性食品膳食风险评估残留物目录(2021版)》的要求,代森联与ETU的残留量之和计算如公式(2)所示:
总残留量=ω(代森联)+7.5×ω(ETU)
(2)
式中:ω(代森联),代森联质量浓度,mg/kg;ω(ETU),ETU质量浓度,mg/kg。
当代森联或ETU质量浓度小于其定量限(limits of quantitation,LOQ)时,以LOQ计算总残留量。
1.3.6 降解动态方程
按照一级反应动力学方程拟合代森联和吡唑醚菌酯在花椒中的残留降解动态,消解系数K通过公式(3)计算,半衰期通过公式(4)计算:
CT=C0e-KT
(3)
T1/2=ln(2/K)
(4)
式中:CT,T时间目标农药的残留浓度(mg/kg);C0,施药后目标农药的初始沉积量(mg/kg);K,消解系数;T1/2,降解半衰期,d;T,施药后时间,d。
1.3.7 加工因子
采用加工因子(processing factor,PF)表示鲜花椒加工成干花椒过程对农药残留的影响,其计算如公式(5)所示:
加工因子=干花椒中的农药残留量/鲜花椒中的农药残留量
(5)
1.3.8 膳食评估
根据WHO规定的方法,花椒中农药残留慢性膳食风险(chronic risk quotient,RQc)按公式(6)和公式(7)计算,急性膳食风险(acute risk quotient,RQa)按公式(8)和公式(9)计算,风险值<1时,健康风险在可接受范围内;而风险值>1时,存在不可接受的健康风险。
NEDI=(STMR×F)/bw
(6)
RQc=NEDI/ADI
(7)
NESTI=(LP×HR)/bw
(8)
RQa=NESTI/ARfD
(9)
式中:NEDI,每日估计摄入量(the national estimated daily intake), mg/kg bw/d;STMR,农药残留试验中值(the supervised trials median residue), mg/kg;F,花椒人均消费量(the average fruit consumption), kg/d;bw,人群体重(the average body weight), kg;ADI,每日允许摄入量(the acceptable daily intake of pesticide), mg/(kg bw·d);NESTI,短期估计摄入量(the national estimated short term intake), mg/(kg bw·d);LP, 花椒消费大份餐(the large portion), kg/d;HR,最终残留试验得到的最高残留浓度(the highest residue in available samples), mg/kg;ARfD,急性参考剂量(the acute reference dose of pesticide), mg/(kg bw·d)。代森联的ADI为0.03 mg/(kg bw·d),吡唑醚菌酯的ADI和ARfD分别为0.03和0.05 mg/(kg bw·d)[18]。
2 结果与分析
2.1 方法验证
二硫化碳的标准色谱图见图1-A,ETU和吡唑醚菌酯的总离子色谱图见图1-B。

A-二硫化碳;B-ETU和吡唑醚菌酯
二硫化碳的峰面积Y对数与其质量浓度X(0.1~30 mg/L)对数呈现正相关,决定系数(R2)为0.997 2,标准曲线方程为:lgY=2.317 4×lgX+2.771 2,这与文献吻合[22]。鲜花椒、干花椒均不存在较强的基质效应,因此样品检测采用正己烷配标定量。
吡唑醚菌酯和ETU的峰面积Y均与其质量浓度X(0.002~1 mg/L)呈现正相关,标准曲线方程分别为:吡唑醚菌酯:鲜花椒Y=1 583 872.991 3X-3 374.619 9,R2=0.999 9,干花椒Y=747 048.453 9X-3 102.174 2,R2=0.999 7;ETU:鲜花椒Y=295 622.614 4X+44.255 6,R2=0.999 9,干花椒Y=165 530.301 7X-1 578.354 8,R2=0.996 7。可以看出,标准曲线相关性良好,决定系数均在0.996以上。
分别在空白鲜花椒、干花椒中添加4档质量浓度的代森联标准溶液,3档质量浓度的吡唑醚菌酯和ETU混合标准溶液,每档加标质量浓度水平均重复5次,结果见表3。代森联回收率为85.5%~106.7%,RSD为1.0%~4.2%;ETU回收率为81.2%~93.1%,RSD为1.6%~9.5%;吡唑醚菌酯回收率为83.4%~91.3%,RSD为2.3%~4.6%。

表3 代森联、ETU和吡唑醚菌酯添加回收率结果
代森联、ETU和吡唑醚菌酯在鲜花椒、干花椒中的定量限均为0.05 mg/kg。
由上可见,采用的方法具有良好的准确度和精密度,根据农作物中农药残留试验准则(NY/T 788—2018),可满足所选农药残留检测分析要求。
2.2 降解动态曲线
施药2 h后,吡唑醚菌酯在2个产地鲜花椒上的初始沉积量为3.96~5.80 mg/kg,在干花椒上的初始沉积量为8.97~9.20 mg/kg(图2)。施药28 d时,吡唑醚菌酯在鲜花椒中的消解率可达94.1%~96.9%,在干花椒中的消解率可达97.3%~97.5%。消解规律均符合一级动力学方程,消解曲线决定系数(R2)为0.840 7~0.992 2,指数关系良好。吡唑醚菌酯在鲜花椒中的半衰期为5.59~6.93 d,在干花椒中的半衰期为5.87~6.13 d。

图2 吡唑醚菌酯在花椒中的残留消解变化
施药2 h后,代森联、ETU在2个产地鲜花椒上的初始沉积量分别为15.44~32.68 mg/kg和2.87~8.03 mg/kg,在干花椒上的初始沉积量分别为6.88~18.16、2.26~4.77 mg/kg(图3)。施药28 d时,代森联在鲜花椒中的消解率分别可达95.3%~97.7%,在干花椒中的消解率分别可达92.4%~96.2%。代森联消解规律均符合一级动力学方程,消解曲线决定系数(R2)为0.916 0~0.993 8,指数关系良好。代森联在鲜花椒中的半衰期为5.10~6.86 d,在干花椒中的半衰期为5.63~7.37 d。可见,代森联和吡唑醚菌酯在花椒上的消解速度都比较快。

A-鲜花椒重庆市江津区;B-干花椒重庆市江津区;C-鲜花椒重庆市忠县;D-干花椒重庆市忠县
2.3 最终残留
表4显示,14 d鲜花椒中代森联、吡唑醚菌酯残留量分别为4.31~11.33 mg/kg、0.25~0.94 mg/kg,干花椒中代森联、吡唑醚菌酯残留量分别为2.17~9.09 mg/kg、0.30~2.86 mg/kg;21 d鲜花椒中代森联、吡唑醚菌酯残留量分别为2.29~4.41 mg/kg、0.11~0.59 mg/kg,干花椒中代森联、吡唑醚菌酯残留量分别为1.87~3.63 mg/kg、0.21~2.02 mg/kg。

表4 代森联和吡唑醚菌酯在花椒上的最终残留量
2.4 加工因子
由表5可知,干花椒中代森联的残留量均低于鲜花椒中的残留量,加工因子均小于1(0.47~0.83),而干花椒中吡唑醚菌酯的残留量均高于鲜花椒中的残留量,加工因子均大于等于1(1.00~3.86)。加工后能显著降低代森联在干花椒中的残留,而吡唑醚菌酯在干花椒中发生了显著的富集效应。

表5 代森联、吡唑醚菌酯在花椒中的加工因子
2.5 膳食评估
膳食暴露风险评估是农产品质量安全评估的重要组成部分,也是衡量产品安全性的手段之一。由表6可知,慢性和急性暴露风险值随安全间隔期延长而降低,均低于安全界限1。慢性暴露风险表现为代森联>吡唑醚菌酯,吡唑醚菌酯的分布范围为0.000 26~0.000 67,代森联的分布范围为0.001 8~0.003 8;急性暴露风险,吡唑醚菌酯的分布范围为0.000 37~0.001 8。由于代森联缺乏ARfD值,故暂不考虑其急性暴露风险。与加工因子相似,对代森联而言,鲜花椒的慢性暴露风险>干花椒的慢性暴露风险;对吡唑醚菌酯而言,干花椒的慢性暴露风险>鲜花椒的慢性暴露风险,干花椒的急性暴露风险>鲜花椒的急性暴露风险。因此,按照良好农业规范在花椒上施用代森联·吡唑醚菌酯农药后,间隔14、21 d,花椒中代森联和吡唑醚菌酯的急性和慢性膳食暴露风险均在可接受范围内。

表6 代森联和吡唑醚菌酯残留对我国消费者的慢性和急性膳食风险
利用GB 2763—2021中代森联和吡唑醚菌酯在不同食物中的MRL,结合19种食物的人均膳食量,通过公式(6)和公式(7),评估了代森联和吡唑醚菌酯在19种食物中的慢性暴露风险,如表7所示。代森联和吡唑醚菌酯在不同食物中的慢性暴露风险贡献率差异较大,累计慢性暴露风险均超过了100%,代森联和吡唑醚菌酯在酱油类食物的慢性暴露风险贡献率占总比仅分别为0.83%和0.47%。再结合表6中农药最高残留值,估算出代森联在鲜花椒和干花椒的风险阈值分别为15、10 mg/kg,吡唑醚菌酯在鲜花椒和干花椒的风险阈值分别为1、3 mg/kg。
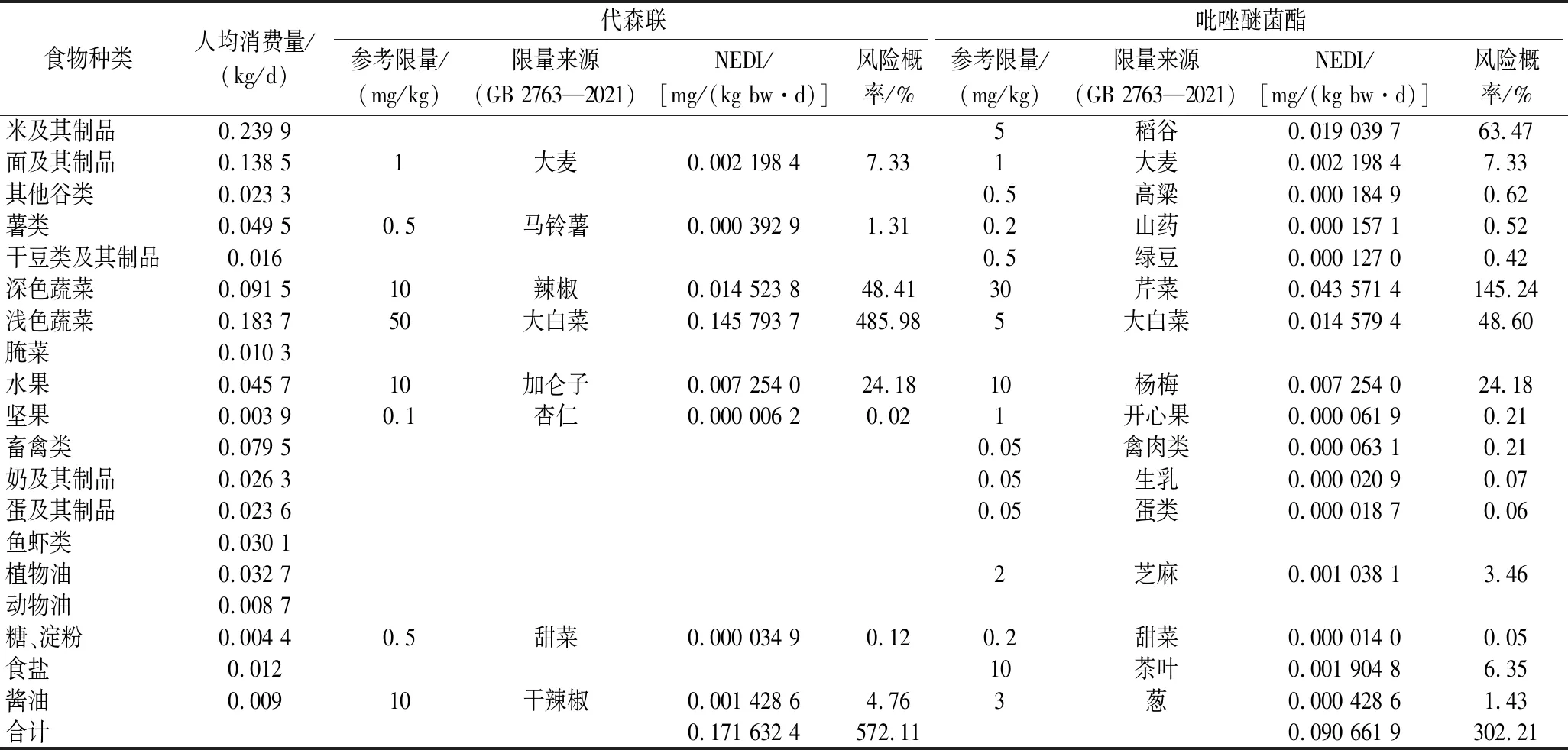
表7 代森联和吡唑醚菌酯残留在不同食物中的慢性膳食风险
3 结论
花椒样品分别经QuEChERS方法处理和衍生化,再分别采用高效液相色谱-串联质谱法和气相色谱-火焰光度检测器检测代森联和吡唑醚菌酯。结果表明该方法操作简单,具有良好的准确度和精密度,可满足试验农药残留检测分析要求。在花椒生长发育过程中,代森联和吡唑醚菌酯均快速消解。按照良好农业规范在花椒上施用代森联和吡唑醚菌酯后,花椒中代森联和吡唑醚菌酯的急性或慢性膳食暴露风险均在可接受范围内。

