腹腔镜下不同膀胱入路治疗前列腺癌根治术疗效及对围术期指标术后尿控功能和勃起功能的影响
高 丹, 程 继, 王志刚, 付 国
(陕西省人民医院泌尿外科, 陕西 西安 710068)
前列腺癌(prostate cancer,PCa)是一种恶性肿瘤,由前列腺上皮细胞恶性增生所导致,近年来发病率明显上升,对男性健康威胁较大[1]。前列腺癌病情进展缓慢,在疾病早期,患者无明显表现,当癌细胞快速扩散至前列腺外时,病情愈加严重[2]。当前,随着腹腔镜技术在医学中的快速发展,临床治疗PCa主要采用腹腔镜前列腺癌根治手术[3]。但是由于对不同手术入路的选择不同,其效果也不同。而腹腔镜下膀胱前入路以及后入路是目前应用较为广泛两种方式。前入路是从膀胱前表面分离,即以经耻骨后间隙入路治疗,该技术能较好保护神经血管束,但学习曲线较长。后入路从膀胱后表面寻找分离层面,能够较好地保护尿控功能以及性神经。鉴于此,本文主要研究了腹腔镜下膀胱前入路以及后入路治疗前列腺癌根治术疗效,通过对围术期指标、术后尿控功能和勃起功能进行评估,以期为前列腺癌患者找到一种更为有效的手术入路。
1 资料与方法
1.1一般资料:选取我院2020年1月至2022年1月收治106例前列腺癌患者作为研究对象。入选标准:①符合前列腺癌诊断标准[4]:以前列腺穿刺活检,所取得组织的病理化验结果进行诊断;②无显著增加手术危险性的疾病;③无严重出血倾向。排除标准:①复发性Pca;②临床资料不全。按照简单随机分组方法分为观察组(53例,采用腹腔镜下膀胱前入路治疗)和对照组(53例,采用腹腔镜下膀胱后入路治疗)。对照组年龄60~73岁,平均年龄(67.22±5.64)岁;格里森(Gleason)评分为4~9分,平均分(6.56±2.24)分;前列腺特异抗原(PSA)值为11~22ng/mL,平均值为(16.63±3.16)ng/mL;临床分期:T1期12例,T2期21例,T3期20例。观察组年龄60~74岁,平均年龄(67.63±5.21)岁;Gleason评分为4~9分,平均分(6.69±2.38)分;PSA值为11~22ng/mL,平均值为(16.64±3.11)ng/mL;临床分期:T1期13例,T2期20例,T3期20例。
1.2治疗方法:对照组:采用腹腔镜下膀胱后入路治疗。首先游离双侧精囊,切开狄氏筋膜,进行钝性分离沿着直肠前脂肪层,切开直肠膀胱返折部壁层腹膜,分离并切断精囊以及输精管,直到前列腺尖部,做一个U形切口在膀胱轮廓前缘,将膀胱前壁以及侧壁显露,切开两侧的盆筋膜,分离前列腺侧壁,缝扎耻骨后血管复合体,提起双侧精囊,游离前列腺侧后壁,剪断后尿道以及耻骨前列腺韧带,切除整个前列腺。观察组:采用腹腔镜下膀胱前入路治疗。分离脐部韧带外侧,切开两侧内筋膜,分离前列腺侧壁。小心剪断脐内侧韧带,分离脐部中韧带,切断近脐部将脐尿管。形成一个倒U形切口在腹前壁内侧面。进入Retzius腔,将前列腺尖部显露,游离双侧精囊,处理阴茎血管神经束。游离前列腺侧后壁,分离狄氏筋膜尧直肠以及前列腺,剪断后尿道,然后对整个前列腺进行切除。
1.3观察指标及效果评价标准:①观察两组患者临床疗效。显效:经治疗,影像学检查前列腺肿瘤可测病灶基本消失;有效:经治疗,影像学检查前列腺肿瘤可测病灶有较为显著的降低;无效:患者病情未得到改善。②观察两组患者围术期指标[5]。包括手术时间,住院时间,术中失血量,留置尿管时间情况。③观察两组的尿控功能。包括残余尿量(residual urine volume,RUV)及最大尿流率(Qmax)。④观察两组勃起功能[6]。包括性交、性活动、射精、性刺激,满分20分,分数越高代表勃起功能越强。⑤观察两组并发症。统计两组切口裂开、输尿管损伤、膀胱损伤等并发症发生情况。
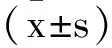
2 结 果
2.1两组患者临床疗效比较:治疗后,观察组临床总有效率高于对照组(P<0.05),详见表1。

表1 两组临床疗效比较n(%)
2.2两组患者围术期指标比较:治疗后,观察组围术期指标均低于对照组(P<0.05),详见表2。

表2 两组患者围术期指标比较
2.3两组尿控功能比较:治疗后,两组患者残余尿量较治疗前下降,最大尿流率较治疗前上升,数据差异有统计学意义(P<0.05);且观察组患者残余尿量低于对照组患者(P<0.05),最大尿流率高于对照组患者(P<0.05),详见表3。
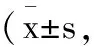
表3 两组尿控功能比较分)
2.4两组患者勃起功能比较:治疗后,两组患者性交、性活动、射精、性刺激等勃起功能评分较治疗前升高(P<0.05);且观察组上述评分均高于对照组(P<0.05),详见表4。
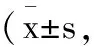
表4 两组患者勃起功能比较分)
2.5两组患者并发症比较:治疗后,观察组并发症总发生率为1.89%,低于对照组5.66%,但P>0.05,详见表5。
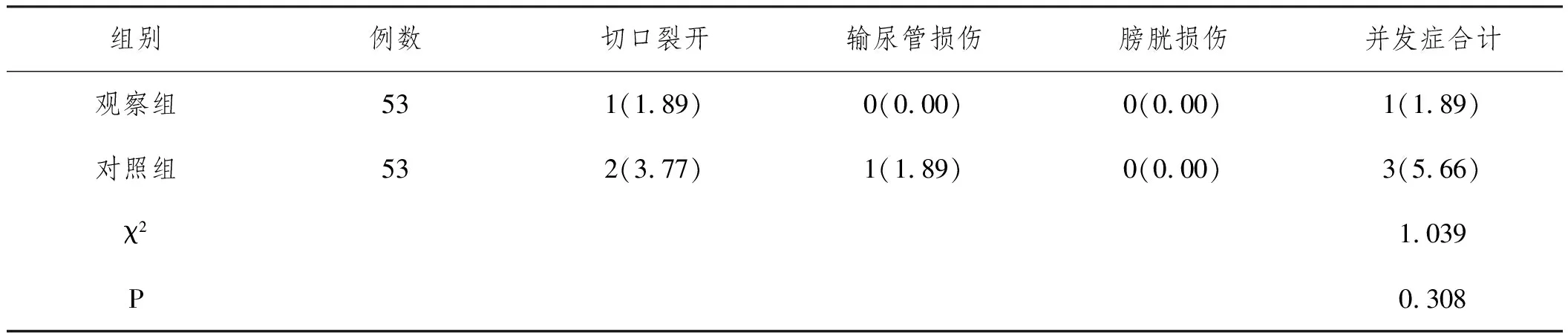
表5 两组并发症比较n(%)
3 讨 论
前列腺癌根治术切除范围需要包括完整前列腺、双侧精囊、双侧输精管、壶腹段和膀胱颈部,同时需彻底清扫盆腔淋巴结,包括髂动脉和髂静脉、前方和后方以及之间的纤维脂肪组织,下到腹股沟管,后置鼻孔神经后方。目前常用手术途径包括经会阴和经耻骨后,主要的手术方法包括传统开放及腹腔镜前列腺根治术,腹腔镜下前列腺根治术具有恢复快的作用,此外在腹腔镜下通过成像系统可以将病灶放大,通过手术的腹腔镜器械可以在狭小的空间里完成手术,术后预后较好。
腹腔镜下前列腺癌根治术主要有前入路和后入路两种方式,目前认为两种入路各有优缺点[7]。腹腔镜下经膀胱后入路先要探寻Douglas腔,将腹膜横向切开,显露两侧精囊,手术操作空间小,易损伤输尿管。腹腔镜下经膀胱前入路能够保护膀胱颈括约肌,对处理了阴茎背部血管复合体,有效降低了出血量。鉴于此,本文主要研究了腹腔镜下前入路与后入路治疗前列腺癌根治术疗效,通过对围术期指标、术后尿控功能和勃起功能进行评估,以期为前列腺癌患者找到一种更为有效的手术入路。
治疗后观察组总有效率高于对照组,提示腹腔镜下膀胱前入路治疗前列腺癌患者能够提高其临床疗效。考虑其原因为腹腔镜可以在术者行手术时将术野放大,使得能够清晰地观察到解剖结构,可以精准的切除病灶[8]。经膀胱后入路首先要探查Douglas腔,然后横向切开前列腺后方腹膜,使得两侧精囊显露,其操作空间小,容易损伤输尿管。而膀胱前入路术野宽大,操作简便,解剖结构也较为清晰,其盆筋膜能够被充分剪开,然后便于观察以及分离前列腺尖部,然后切开膀胱后壁,探寻分离精囊,吻合时期张力小,有利于缝合,提高了对于淋巴结清扫便利性,有利于临床疗效提高[9]。
本研究发现,治疗后观察组各项围术期指标均低于对照组患者,提示腹腔镜下膀胱前入路治疗前列腺癌患者能够促进患者恢复。考虑其原因为膀胱前入路可以将狄氏筋膜切开,可以有效的降低出血量[15]。同时前入路创伤小,视野清晰,因此手术效率较高。观察组残余尿量低于对照组患者,最大尿流率高于对照组患者,提示腹腔镜下膀胱前入路治疗前列腺癌患者能够改善术后尿控功能。其原因可能为前入路采用连续性单针缝合,通过可吸收线在尿道内进行连续缝合然后打结,提高了黏膜对合程度,利于术后尿控恢复。
本研究结果显示,观察组患者性交、性活动、射精、性刺激等勃起功能评分均高于对照组,提示腹腔镜下膀胱前入路治疗前列腺癌患者能够改善术后勃起功能。考虑其原因为前入路保留输精管及精囊,采用回肠原位新膀胱术,与保留的前列腺包膜吻合,一定程度上保证了顺行射精功能,因而提升了术后勃起功能。治疗后,虽然观察组患者并发症总发生率为1.89%,低于对照组患者5.66%但P>0.05,提示腹腔镜下膀胱前入路与后入路安全性均较高,无明显并发症。其原因可能为腹腔镜手术具有创伤小、恢复较快、瘢痕小、术后容易恢复的优点,患者并发症发生率较低。
综上所述,与腹腔镜下膀胱后入路相比,前入路治疗前列腺癌患者能够提高其临床疗效,促进患者恢复,改善术后尿控功能与勃起功能,无明显并发症,值得临床推广。

